外源ABA对水分胁迫条件下甘薯幼苗生理特性的影响
2021-02-07李浩解备涛冯向阳汪宝卿董顺旭段文学张海燕张立明
李浩,解备涛,冯向阳,汪宝卿,董顺旭,段文学,张海燕,张立明
(1.青岛农业大学农学院,山东 青岛 266109;2.山东省农业科学院作物研究所/农业农村部黄淮海薯类科学观测实验站/特色作物山东省工程实验室,山东 济南 250100;3.昌乐县农业农村局,山东 昌乐 262400;4.山东省农业科学院,山东 济南 250100)
甘薯是我国仅次于水稻、小麦和玉米的第四大粮食作物,因其适应性广、耐贫瘠等特性,多种植在水分等条件恶劣地区[1]。近年来,极端天气频繁发生,干旱问题不断,其潜在的生产能力因水分供应不足而不能正常发挥,产量下降。在干旱及半干旱贫瘠地区种植甘薯是增加粮食产量的一种有效可行方式。甘薯虽耐旱,但在土壤水分不足情况也会受到干旱胁迫的影响,导致产量下降。
我国北方甘薯种植区干旱多发生在4月中下旬至7月上旬[2],影响甘薯田间栽培和根系生长,尤以苗期最为严重,成为甘薯幼苗生长的主要限制因素。研究表明,干旱条件下,甘薯幼苗成活率下降,地上部生长明显减慢,而且干旱持续时间愈长,其受伤害程度越大[3]。
目前甘薯的抗旱研究多集中于覆盖地膜、干旱胁迫后供水和施氮施钾肥等栽培方法[4-6];干旱胁迫下喷施生长调节剂可缓解干旱胁迫的影响[7],其中外源ABA可显著降低干旱胁迫条件下甘薯减产的幅度[8]。植物响应水分胁迫的一种重要调节因子是植物激素脱落酸ABA,在干旱、盐渍以及低温条件下,植物细胞内ABA积累[9]。ABA作为一种胁迫信号,在调节植物的水分平衡以及诱导胁迫的耐性方面起着重要作用[10]。目前,关于ABA提高植物抗旱性的研究在小麦、玉米、大豆等作物[11-13]中已有相关报道。甘薯作为干旱地区的主栽作物,有关干旱胁迫对甘薯生理特性、产量影响的研究较多,而干旱胁迫下喷施外源激素对其影响的研究报道较少。因此筛选ABA最佳施用浓度对其在甘薯生产上的推广应用具有重要意义。本研究以济薯21和济紫薯1号为试验材料,研究甘薯幼苗在水分胁迫条件下,不同浓度外源ABA处理对其生理特性的影响,以探讨外源ABA对水分胁迫下甘薯幼苗生长的缓解机制,筛选最佳的施用浓度,为干旱地区甘薯的抗旱栽培提供理论依据。
1 材料与方法
1.1 试验材料与设计
供试品种为抗旱品种济薯21(国品鉴甘薯2007001;JS21)和不抗旱品种济紫薯1号(国品鉴甘薯2015009;JZ1)。试验在山东省农业科学院作物研究所人工气候室内进行。大田中剪取已萌发至株高约20 cm的幼苗移入1/2 Hoagland培养液中,光照下23~30℃培养10 d后,叶面分别喷清水和不同浓度的ABA溶液,3 d后将长出大量根系的培养苗转入5%、10%、15%、20%浓度聚乙二醇(PEG-6000)的1/2 Hoagland培养液中进行根际胁迫处理,时间间隔3 d,胁迫时间共12 d(表1)。
1.2 测定项目与方法
1.2.1 取样方法 分别于培养10 d、叶面喷施ABA 3 d、干旱胁迫12 d,选取代表性植株5株,取主茎第4片展开叶,用于测定功能叶相对含水量、相对电导率和叶绿素含量;部分样品锡箔纸包装,编号后放置液氮中,用于叶片MDA含量测定。取纤维根根尖处5 cm用于根系活力和MDA含量的测定。

表1 溶液培养与根际胁迫处理设计
1.2.2 功能叶相对含水量测定 采用称重法[16]测定。分别称取鲜重(Wf)、饱和重(Wt)和干重(Wd)。叶片相对含水量(LWC,%)=(Wf-Wd)/(Wt-Wd)×100。
1.2.3 功能叶相对电导率测定 采用Lutts等[17]的方法。称取样品0.1 g,蒸馏水洗净表面2~3次后置于25 mL蒸馏水的烧杯中浸泡24 h,测定电导率(L1);放置烧杯沸水浴30 min,冷却后补充蒸馏水到原位置,测定电导率(L2)。相对电导率(%)=L1/L2×100。
1.2.4 功能叶叶绿素含量测定 参考李合生[18]的方法。称取样品0.1 g,充分研磨后装入试管,加95%乙醇15 mL,封口,闭光保存48 h,中间振荡数次,以95%乙醇为空白,在波长665、649 nm下测定光密度。Ca=13.95D665-6.88D649;Cb=24.96D649-7.32D665,其中,D665和D649为叶绿素溶液在波长665 nm和649 nm处的吸光度,Ca、Cb分别为叶绿素a和b的浓度。叶绿素含量(mg/gFW)=叶绿素浓度 (mg/L)×提取液体积(L)/样品鲜重(g)。
1.2.5 根系活力测定 采用TTC还原法测定。
1.2.6 MDA含量测定 采用硫代巴比妥酸比色法。称取样品0.2 g,加入10%三氯乙酸5 mL迅速研成匀浆,于12 000×g离心10 min,取上清液2 mL,加入0.6%硫代巴比妥酸2 mL,于沸水浴中反应15 min,冰水浴中迅速冷却后,分别在600、532 nm 和450 nm 波 长 下 比 色。MDA 含 量(μmol/gFW)=[6.45×(D532-D600)-0.56×D450]×(酶液体积)/样品重。
1.3 数据分析
用DPS v8.01软件进行数据处理,用Microsoft Excel 2007制图。
2 结果与分析
2.1 外源ABA对水分胁迫条件下甘薯功能叶生理特性的影响
2.1.1 功能叶相对电导率 随着水分胁迫的加剧,甘薯叶片的相对电导率逐渐升高,ABA处理的甘薯叶片相对电导率均比PEG+清水处理低。胁迫12 d后,耐旱品种济薯21和不耐旱品种济紫薯1号的150μmol/L ABA处理的叶片相对电导率均高于CK,但都低于其它处理。说明叶片喷施ABA可有效缓解水分胁迫对甘薯细胞膜系统的损伤,降低细胞膜的破裂,减少胞质的胞液外渗,150μmol/L是最有效浓度(图1)。
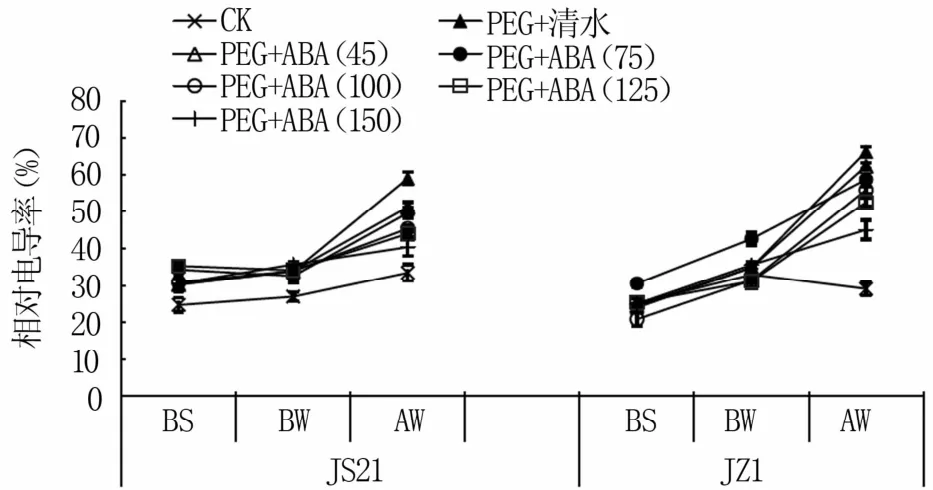
图1 水分胁迫下外源ABA对叶片相对电导率的影响
2.1.2 功能叶MDA含量 图2可见,水分胁迫使叶片MDA含量上升,喷施ABA处理的MDA含量随着ABA浓度的增加呈现下降趋势,其中以150μmol/L处理的MDA值最低。抗旱品种JS21和不抗旱品种JZ1均表现出同样趋势,JZ1喷施不同浓度ABA处理的变化幅度要高于JS21。说明叶片喷施外源ABA可以有效降低水分胁迫导致的MDA升高,降低膜脂过氧化作用,以150 μmol/L ABA处理最有效。
2.1.3 功能叶相对含水量 图3可见,随着水分胁迫的加剧,甘薯叶片的相对含水量逐渐降低。ABA各浓度处理中以150μmol/L处理的叶片相对含水量最高。胁迫12 d后,耐旱品种济薯21、不耐旱品种济紫薯1号的150μmol/L ABA处理的叶片相对含水量均低于CK,但都高于其它处理。说明叶片喷施ABA可有效缓解水分胁迫对甘薯幼苗生长的抑制作用,150μmol/L浓度效果最好。
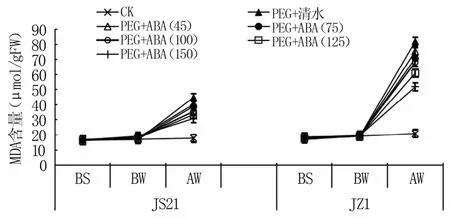
图2 水分胁迫下外源ABA对叶片MDA含量的影响

图3 水分胁迫下外源ABA对叶片相对含水量的影响
2.1.4 功能叶片叶绿素含量 随着水分胁迫的加剧,甘薯叶片叶绿素含量下降,ABA处理后的叶绿素含量高于胁迫后喷施清水处理。各浓度处理中,耐旱品种济薯21和不耐旱品种济紫薯1号存在差异,但均以150μmol/L ABA处理的叶片叶绿素含量最高(图4)。说明叶片喷施ABA可有效缓解水分胁迫条件下叶绿素的降解,150 μmol/L是最有效浓度。

图4 水分胁迫下外源ABA对叶绿素含量的影响
2.2 外源ABA对水分胁迫条件下甘薯根系生理特性的影响
2.2.1 对根系活力的影响 图5可见,水分胁迫12 d后甘薯根系活力低于CK,而喷施ABA可有效缓解水分胁迫对根系的损伤,表现为ABA处理的根系活力均高于PEG+清水处理,说明水分胁迫下喷施外源ABA能够提高甘薯幼苗的根系活力且ABA浓度为150μmol/L效果最佳。
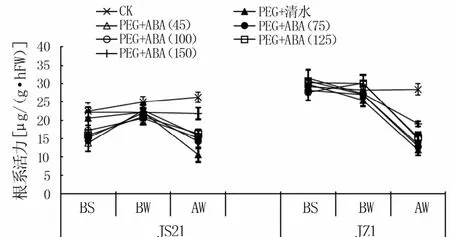
图5 水分胁迫下外源ABA对根系活力的影响
2.2.2 对根MDA含量的影响 由图6可以看出,水分胁迫使根的MDA含量上升,喷施ABA处理的MDA含量随浓度增加呈现下降趋势,其中以150μmol/L处理的MDA值最低。抗旱品种JS21和不抗旱品种JZ1均表现出相同趋势,JZ1不同浓度ABA处理的变化幅度要高于JS21。说明喷施外源ABA可以有效降低水分胁迫导致的MDA升高,降低膜脂过氧化作用,以150μmol/L ABA处理效果最好。

图6 水分胁迫下外源ABA对根MDA含量的影响
3 讨论与结论
ABA是一种重要的植物激素,受到生物胁迫和非生物胁迫的调控,在植物对胁迫耐受性和抗性中发挥着重要作用[19]。ABA的重要生理功能就是促进离子流出保卫细胞和降低保卫细胞膨压,诱导气孔关闭,从而降低水分损耗,增加植株在干旱条件下的保水能力[20]。植物在遭遇干旱胁迫时,叶绿体膨胀,排列紊乱,基质片层模糊,基粒间连接松弛,类囊体层肿胀或解体,叶绿素含量下降[21]。干旱胁迫下根系吸收的水分不足,根系生长缓慢继而改变植株生长发育进程,并且随着生育进程的推进,根系活力呈下降趋势[22-24]。干旱胁迫下活性氧的动态平衡遭到破坏,质膜发生过氧化,导致丙二醛(MDA)含量和相对电导率升高[25];膜质的过氧化会导致膜系统的破坏,对细胞组分和结构造成氧化损伤[26];细胞膜容易破裂,膜蛋白受伤害因而使胞质的胞液外渗而使相对电导率增大[27]。
郭贵华等[28]研究发现,干旱胁迫可以诱导叶片中ABA含量升高,这使叶片气孔开度受抑、蒸腾作用下降,从而减少水分消耗,提高植物的保水能力。孙哲等[14]研究发现,外施ABA能使可溶性糖和脯氨酸等渗透调节物质含量上升,活性氧代谢能力和根系吸水能力增强,从而提高净光合效率;外施ABA能增强甘薯的抗氧化防护系统,提高甘薯抗旱性。解备涛等[29]发现,干旱胁迫下喷施外源激素还能提高甘薯移栽成活率、须根数目、生物量和抗氧化酶活性。本研究认为,施加外源ABA对增强甘薯幼苗抗旱性有明显作用。抗旱品种济薯21和不抗旱品种济紫薯1号在水分胁迫条件下施加外源ABA均表现为:叶绿素含量和叶片相对含水量增加,根系活力增强,MDA和叶片相对电导率降低,二者表现趋势一致,且JZ1表现更敏感,这说明外源ABA对提高植物抗旱性作用明显。
阮英慧等[30]在大豆研究中发现,不同浓度ABA在不同方面的作用效果不同,可能由于大豆花期对不同浓度的激素较敏感。杨波等[31]研究发现,叶片喷施外源激素2,4-D、6-BA、IBA可减轻干旱胁迫对烟草幼苗的伤害,并且不同浓度的同种激素对提高烟草幼苗的抗逆性有差异,说明可能存在某一最适浓度使烟草幼苗的抗逆性达到最强。种培芳等[32]发现,不同浓度ABA处理红砂幼苗能提高其抗旱性,但是ABA对红砂干旱胁迫下的调节作用有一定的限制值,即10μmol/L,超过此浓度作用会降低。本试验中随着胁迫程度增加甘薯幼苗对不同浓度的外源ABA表现出,随着ABA浓度升高幼苗的抗旱能力随之增强,这说明ABA对缓解甘薯幼苗的干旱胁迫存在浓度效应,其中以150μmol/L处理效果最好。
李长宁等[33]在甘蔗抗旱方面的研究发现,外源ABA处理通过增加内源ABA含量,加强甘蔗植株对逆境信号的感受,从而更快地调节植株内的各种抗氧化酶活性,以显著增强对逆境的适应能力。王金强[34]的研究也发现,干旱胁迫下,前期喷施外源植物激素对甘薯内源激素含量的下降能起到缓解作用,外源ABA导致甘薯叶片中ZR、IAA和ABA含量均显著升高。杨东清等[35]研究发现,小麦幼苗在不同氮素处理下喷施外源细胞分裂素可以通过调节内源Zt、IAA、ABA含量,进而调控GS和NR活性,从而提高叶片氮素同化能力和光能捕获、传递转化能力,改善叶片光合性能。本试验中,在水分胁迫前喷施ABA,胁迫后ABA处理甘薯幼苗的根系活力、叶片叶绿素含量、叶片相对电导率有较为明显的增加,这可能是因为喷施外源ABA诱导内源ABA的产生,使得在下一阶段水分胁迫出现时甘薯幼苗对干旱的反应能力加快,显著增强了甘薯幼苗对水分胁迫的适应能力。
综上所述,植物对水分胁迫的适应程度变化是一个复杂的生理生化过程。本试验中,在施加外源ABA后,甘薯幼苗的叶片相对电导率、MDA含量、叶绿素含量、叶片相对含水量、根系活力等指标在水分胁迫下都不同程度增强抗旱性。外源ABA促进水分胁迫下甘薯幼苗的生长发育,幼苗抗旱性增强,其中以150μmol/L处理的效果最佳。脱落酸(ABA)作为一种植物生长调节剂,在植物抗旱方面具有广阔的应用前景,但ABA在强光下易分解,若田间施用时遇强光会导致药性降低,这也是下一步生产实际中要解决的问题。
