副猪嗜血杆菌血清4型和13型的分子血清分型研究
2021-02-06郭芳芳崔一芳曹晓亚徐福洲
李 忍,郭芳芳,郭 杰,崔一芳,曹晓亚,徐福洲
(北京市农林科学院畜牧兽医研究所/畜禽疫病防控技术北京市重点实验室,北京 100097)
副猪嗜血杆菌(Haemophilusparasuis,HPS)引起猪格拉泽氏病(Glässer's disease),感染后主要表现为多发性浆膜炎、关节炎和脑膜炎,在全球范围内广泛流行,给养猪业带来严重的经济损失[1-2]。目前HPS有15个血清型,不同血清型菌株之间存在高毒力、中等毒力和无毒力等显著差异,因而鉴定HPS血清型对该病的诊断和防治具有重要意义[3]。HPS血清4型、5型和13型是我国目前流行最多、分布范围最广且毒力较强的血清型[4-7],因而快速准确鉴定HPS优势流行血清型对该病原的流行病学调查和防控具有重要意义。
目前HPS常规血清型鉴定方法为在细菌分离培养和鉴定的基础上,通过琼脂扩散试验(GID)或间接血凝试验(IHA)与HPS所有单一血清型的阳性血清进行反应来判定血清型,通常需要3 d~5 d,费时费力,而且约有30%的HPS分离菌株不能被准确鉴定血清型[3,8-9],严重影响该病的临床诊断。为提高血清分型效率和准确性,近年来分子血清分型方法越来越多地应用于HPS血清分型,通过对HPS所有15个血清型荚膜多糖合成编码基因座进行结构分析和血清型特异性基因鉴定[10],建立和应用了更加准确高效的多重PCR分子血清分型方法[11-13],大大降低了不能分型的HPS临床分离株数量。
为提高临床上HPS的快速鉴定,近年来环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术用于检测HPS菌株[14-15],但尚未见LAMP用于HPS血清分型的报道,因而利用LAMP技术简便、快速、敏感、特异且易于临床应用的优点,建立HPS流行优势血清型的血清分型方法,对HPS流行病学调查和疫苗防控具有重要意义。
在本试验中,参照HPS血清4型和13型特异性基因序列设计引物,分别建立了简便快速鉴定HPS血清4型和13型的LAMP检测方法,并对方法的敏感性和特异性进行鉴定,最后利用已知血清型的HPS临床分离株对建立的LAMP方法进行验证,研究结果将有助于临床上HPS血清4型和13型分离株的快速鉴定。
1 材料与方法
1.1 材料
1.1.1 细菌菌株 HPS所有15个血清型参考菌株由澳大利亚昆士兰大学Pat Blackall博士惠赠;HPS临床分离菌株由华中农业大学蔡旭旺博士惠赠;特异性检测中使用的其他菌株或DNA由本实验室保存。
1.1.2 主要试剂和仪器 胰酶大豆肉汤(TSB)、胰酶大豆琼脂(TSA)和烟酰胺腺嘌呤二核苷酸(NAD),BD Difco公司产品;细菌基因组DNA提取试剂盒,Promega公司产品;BstDNA polymerase,NEB公司产品。PCR仪(5331),Eppendorf公司产品;Nanodrop 2000超微量分光光度计,ThermoFisher Scientific公司产品。
1.2 方法
1.2.1 细菌基因组DNA的提取 冻存菌株划线接种于TSA平板上,挑取单菌落接种TSB中,于37 ℃培养过夜,取1 mL培养物用于抽提基因组DNA,提取方法参照试剂盒说明书进行,利用Nanodrop 2000超微量分光光度计测定细菌基因组DNA的浓度和纯度。
1.2.2 LAMP引物设计 参考GenBank中HPS血清4型脂多糖合成蛋白基因wcip4序列(KC795356.1)和血清13型糖脂转移蛋白基因gltP序列(KC795500.1),利用引物设计软件Primer Explorer 4.0设计LAMP引物。引物名称及序列如表1所示。
1.2.3 LAMP反应体系 在25 μL反应体系中,含有10×BstDNA polymerase buffer 2.5 μL,10 mmol/L dNTPs 3.0 μL,0.25 mol/L MgSO40.2 μL,5 mol/L Betaine 0.5 μL,10 μmol/L FIP和BIP各2.0 μL,10 μmol/L F3和B3各0.5 μL,8 U/μLBstDNA polymerase 0.7 μL,模板DNA 1.0 μL,加ddH2O补至25 μL。所有组分混合后95 ℃ 5 min,然后62 ℃ 60 min,反应产物通过8 g/L琼脂糖凝胶电泳鉴定。

表1 LAMP所用引物
1.2.4 LAMP反应体系优化 对LAMP反应体系中主要影响因子如dNTPs浓度(0.4、0.8、1.2、1.6、2.0、2.4、2.8 mmol/L)、BstDNA polymerase用量(0.5、0.7、0.9、1.1、1.3、1.5 μL)、Mg2+浓度(0、0.5、1.0、1.5、2.0、2.5、3.0、4.0 mmol/L)、Betaine浓度(0、0.1、0.2、0.4、0.8、1.6 mol/L)、反应温度(60、61、62、63、64、65 ℃)、反应时间(30、35、40、45、50、55、60、65 min)等分别筛选优化,确定较好的LAMP反应体系。
1.2.5 特异性鉴定 HPS所有15个血清型的17株参考菌株基因组DNA作为模板用于评价LAMP方法血清型特异性;同时利用其他14个不同种属的19株细菌(胸膜肺炎放线杆菌5个血清型菌株、多杀性巴氏杆菌、豚放线杆菌、小放线杆菌、波氏杆菌、支原体、溶血性曼氏杆菌、猪丹毒杆菌、铜绿假单胞菌、猪霍乱沙门氏菌、兽疫链球菌、猪链球菌、金黄色葡萄球菌、大肠埃希氏菌)基因组DNA作为模板评价LAMP方法对其他种属细菌特异性。取每种细菌基因组DNA 100 ng作为模板进行测定。
1.2.6 敏感性鉴定 分别利用HPS血清4型和13型参考菌株基因组DNA评价方法的敏感性,反应体系中基因组DNA添加量分别为100 ng、10 ng、1 ng、100 pg、10 pg、5 pg、2.5 pg、1 pg、0.5 pg、100 fg、10 fg、1 fg。
1.2.7 HPS临床分离株的检测 取22株HPS临床分离株,经GID和IHA鉴定包括14株血清4型、1株血清5型、1株血清11型、1株血清12型、5株血清13型,过夜培养后取菌液1 mL,离心后取菌沉淀重悬于50 μL ddH2O中,煮沸5 min后离心取上清液1.0 μL作为模板,进行LAMP检测。
2 结果
2.1 LAMP反应体系优化结果
LAMP反应体系中主要影响因子筛选结果显示,dNTPs浓度在0.8 mmol/L~2.8 mmol/L时反应呈阳性,其中2.4 mmol/L~2.8 mmol/L反应最佳;BstDNA polymerase加入量在0.5 μL~1.5 μL时反应呈阳性,其中0.7 μL~1.3 μL反应最佳;Mg2+浓度为0~4.0 mmol/L时均呈阳性,其中1.5 mmol/L~3.0 mmol/L反应最佳;Betaine浓度为0.1 mol/L~0.8 mol/L 时均呈阳性,其中0.4 mol/L~0.8 mol/L反应最佳;反应温度61.0 ℃~65.0 ℃均呈阳性,其中62 ℃反应最佳;反应时间35 min~65 min范围内均呈阳性,其中60 min~65 min反应最佳。
2.2 LAMP特异性检测结果
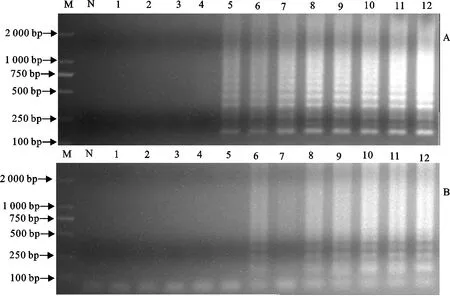
HPS血清型特异性检测结果显示,LAMP反应产物出现的典型阶梯状阳性条带可见于血清4型参考菌株(图1A)和血清13型参考菌株(图1B),而其他血清型无阳性条带出现;细菌种特异性检测结果显示,代表14种不同种属细菌的19个菌株反应结果均呈阴性(图略)。结果表明,建立的HPS血清4型和13型LAMP检测方法具有较好的特异性。

A.血清4型;B.血清13型;M.DNA 标准DL 2 000;N,ddH2O;1.血清 1-Ⅰ;2.Serovar 1-Ⅱ;3.血清2;4.血清3;5.Serovar 4;6.血清5;7.血清6;8.血清7-Ⅰ;9.血清7-Ⅱ;10.血清8;11.血清9;12.血清10;13.血清11;14.血清12;15.血清13;16.血清14;17.血清15
2.3 LAMP敏感性检测结果
敏感性检测结果显示,在25 μL反应体系中,HPS血清4型和13型的基因组DNA最小检测量分别为1 pg(图2A)和2.5 pg(图2B)。
2.4 HPS临床分离株血清分型结果
对22株HPS临床分离株检测结果显示,在HPS血清4型检测体系中14株HPS血清4型分离株检测结果均为阳性,而其他血清型菌株为阴性(图3A);在HPS血清13型检测体系中5株HPS血清13型分离株检测结果均为阳性,而其他血清型菌株为阴性(图3B)。结果提示建立的LAMP检测方法可用于临床HPS分离株血清4型和13型的鉴定。
A.血清4型; B.血清13型;M.DNA 标准DL 2 000;N.ddH2O;1.1 fg;2.10 fg;3.100 fg;4.0.5 pg;5.1 pg;6.2.5 pg;7.5 pg;8.10 pg;9.100 pg;10.1 ng;11.10 ng;12.100 ng
3 讨论
由于HPS培养条件相对要求较高,体外分离培养经常失败,而且非致病性血清型菌株在猪上呼吸道等部位的定植,给临床疫病诊断和防控带来困难[16]。为快速鉴定HPS流行血清型,分子血清分型方法如多重PCR虽有优势[11-12],但多重PCR由于不易判定,难以在临床中简便快速的应用。本试验建立的鉴定HPS血清4型和13型LAMP方法,具有简单、快速、易于临床应用等特点,对临床上HPS优势流行血清型的流行病学调查和疫苗应用提供一种替代方法。为进一步优化该方法,便于现场使用,我们拟优化该检测方法,如使用临床采集样品直接进行反应鉴定、使用显色方法替代电泳判定方法等。
虽然HPS目前已鉴定出15个血清型,但国内外研究均显示,HPS血清4型、5型和13型是世界范围内目前流行最多、分布范围最广且为毒力较强的血清型[1,5-7],因而检测这些优势血清型将提高临床上HPS诊断和防控效率。本试验建立了检测血清4型和13型的LAMP方法,但对于血清5型,我们根据文献报道[11-12]选择了wcwK和funK基因分别设计LAMP引物进行检测,虽然设计了多组引物,但始终无法将血清5型与其他血清型完全区分,特别是血清5型与12型的交叉反应。Howell K J等[11]报道的多重PCR同样无法区分这两种血清型。Jia A等[12]将多重PCR方法进行了改进,分别选用funK基因和一个假定基因(hypothetical gene)用于检测血清5型和12型,本试验改用funK基因设计引物也没有取得特异性检测结果,针对血清5型的检测需要更多的基因组序列分析。
在设计LAMP引物进行HPS单一血清型鉴定时,血清型特异性基因的选择至关重要。最初的KRG血清分型方案基于表面抗原之间的差异,将HPS分为15个血清型[3],表明15个血清型中存在表面抗原编码基因序列的差异,在对HPS荚膜多糖合成编码基因座进行多样性和血清型差异性比对后,获得了不同血清型的特异性基因序列[10]。本试验选用wcip4基因和gltP基因分别进行HPS血清4型和13型特异性引物设计,虽然Blast结果显示所选的基因具有较好的血清型特异性,但我们设计的多组引物进行试验的结果显示,多数引物组对不同血清型出现非特异性扩增,通过大量筛选后选择目前试验中的这组引物进行后续试验并取得较好的结果。

A:血清4型;B:血清13型;M.DNA 标准DL 2 000;N.ddH2O;1-14.血清4型分离株;15.血清5型分离株;16.血清11型分离株;17.血清12型分离株;18-22.血清13型分离株
LAMP检测方法虽然具有简便、快速、易于临床应用的显著优点,但由于其容易出现气溶胶污染导致出现非特异性扩增,给该方法的推广应用带来极大限制。近年来报道了一些同时多通道的检测方法如微流控蝶式芯片[17]和一步实时PCR[18]等,这些方法即可避免LAMP检测中的污染问题,且可同时检测多种病原种属,极大地提高了检测效率,有助于临床上多重感染的鉴别诊断。目前我们正在研制检测HPS不种血清型的微流控蝶式芯片检测方法,对HPS感染的分子血清分型和疫苗防控将具有重要意义。
