胆盐水解酶基因的克隆及其在干酪乳杆菌CECT5276中的分泌表达
2021-02-06余祖玲王镨蒂余祖华李元晓何万领曹平华张春杰
丁 轲 余祖玲 王镨蒂 余祖华 李 旺 李元晓 何万领 曹平华 张春杰 刘 宁
(1.河南科技大学宏翔生物饲料实验室,洛阳471003;2.洛阳市活载体生物材料与动物疫病防控重点实验室,洛阳471003)
胆固醇是一种甾体化合物,广泛存在于动物性食品内,在肝脏、脑、胆汁、蛋等中含量较高。随着人们生活水平的提高,动物性食品在饮食结构中的比例逐渐上升,导致胆固醇摄入过量,引起血清胆固醇含量增高,从而会引发冠心病、高血压、高血脂、动脉粥样硬化等一系列心脑血管疾病,在中老年群体中尤其普遍[1-3]。据调查,当前因疾病死亡的人数中有约40%的疾病是由直接或间接高胆固醇所引起,是人类疾病的第一大杀手[4-5]。降低血清胆固醇含量可有效防止心血管疾病的发生,提高人们的健康指数[6-7],其有效途径:一是从源头控制,即降低食品源中胆固醇的含量,以减少人们对胆固醇的摄入量和摄入机会,二是降低体内的胆固醇含量,即通过干预手段降低血液中胆固醇的含量。降低体内胆固醇含量最有效的方法是使用胆盐水解酶(BSH),BSH是微生物生长过程中产生的一种蛋白质代谢产物,具有较强的降解胆固醇的能力[8]。据报道,产生BSH的菌株主要来自于乳酸菌,如植物乳杆菌(L.plantarum)[9-10]、干酪乳杆菌(L.casei)[11]、布氏乳杆菌(L.buchneri)[12]、双歧杆菌(Bifidobacterium)等[13]。另外,在拟杆菌属(Bacteroides)和肠球菌属(Enterococcus)的细菌中也发现有BSH[14-15]。但一般情况下,野生型菌株降解胆固醇的能力均有限,不能完全满足临床需要。因此,很有必要利用现代基因工程技术将BSH基因在高效表达系统中进行表达,后期无论其纯化酶或基因工程菌均具有极好的应用前景。
本实验室前期已分离鉴定了1株L.plantarum——L.plantarumDPP8,GenBank登录号为KR824936,菌种保藏号为CCTCC M2016136,试验证明其基因组上含有1个975 bp的BSH基因,并可降解培养基中35.93%的胆固醇,降解率有限[16]。为了提高BSH基因的表达量,本试验拟利用PCR技术克隆BSH基因,将其重组于表达载体pMJ67-sp中,电转入L.caseiCECT5276中进行表达研究,以期获得能够高效表达BSH的重组L.caseiCECT5276,将其开发成为功能性活菌饲料添加剂应用于动物生产,能够高效降低动物性产品中胆固醇含量,从而为人类提供更为健康的动物性食品。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
L.plantarumDPP8,本实验室分离保存;pMD18-T,购自大连宝生物工程有限公司;表达质粒pMJ67、L.caseiCECT5276由荷兰Gasper教授赠送;pMJ67-sp,本实验室构建。
1.1.2 培养基
MRS液体培养基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,磷酸氢二钾2 g,乙酸钠5 g,柠檬酸二铵2 g,葡萄糖20 g,吐温-80 1 mL,七水硫酸镁0.58 g,四水硫酸锰0.25 g,琼脂粉 15 g,水1 000 mL,调pH至6.2~6.4,115 ℃、0.105 MPa灭菌15 min。
降胆固醇培养基:含2%胆固醇的MRS液体培养基。
BSH诱导培养基:含2%牛磺胆酸钠的MRS液体培养基。
LB液体培养基:胰化蛋白胨10 g,酵母提取物5 g,氯化钠5 g,调pH至7.0,121 ℃、0.12 MPa灭菌20 min。
1.1.3 生化试剂及工具酶
聚合酶PyrobestTMDNA Polymerase、DL2000 Marker、λDNA/HindⅢ、限制性切酶NdeⅠ、EcoRⅠ,PCR回收试剂盒、T4 DNA Ligase,IPTG、X-gal、Goldview购自大连宝生物工程有限公司;细菌基因组提取试剂盒、质粒纯化试剂盒、琼脂糖凝胶回收试剂盒等均购自天根生化科技(北京)有限公司。
1.2 主要仪器

1.3 方法
1.3.1 引物设计
根据GenBank中已登录的L.plantarumBSH基因(登录号:MBUL90)序列,利用Primer Premier 6.0设计1对引物,bsh1:5’-CGCATATGATGTGTACTGCCATAACT-3’(划线部分为NdeⅠ位点)和bsh2:5’-CGGAATTCGTTAACTGCATAGTATTG-3’(划线部分为EcoRⅠ位点),送至上海生物工程股份有限公司合成。
1.3.2L.plantarumDPP8基因组DNA的提取
将培养的L.plantarumDPP8按照天根生化科技(北京)有限公司的细菌基因组DNA提取试剂盒的方法提取其基因组DNA。
1.3.3BSH基因的克隆
以L.plantarumDPP8基因组DNA为模板,利用引物bsh1和bsh2进行扩增,PCR反应体系为:上游引物1.5 μL(20 pmol/L)、下游引物1.5 μL(20 pmol/L、10×PCR Buffer 5μL、dNTPs 1 μL (10 pmol/L)、Pyrobest DNA Polymerase 0.5 μL(5 U/μL)、模板DNA 4 μL,加灭菌超纯水至50 μL。反应条件:模板DNA 95 ℃预变性10 min;95 ℃ 40 s、62 ℃ 1 min、72 ℃ 90 s,进行30个循环;72 ℃延伸10 min,4 ℃保存。利用天根生化科技(北京)有限公司的琼脂糖凝胶DNA回收试剂盒进行PCR产物的回收,然后将扩增产物连接于pMD18-T,得到克隆质粒pMD18-BSH。将验证正确的质粒送至生工生物工程(上海)股份有限公司进行测序,并进行同源性比较,确定是否是BSH基因。
1.3.4 重组表达载体的构建
利用限制性内切酶NdeⅠ和EcoRⅠ分别对鉴定正确的克隆质粒pMD18-BSH与表达载体pMJ67-sp进行双酶切,分别回收目的条带,16 ℃条件下经T4连接酶连接过夜,转化大肠杆菌(E.coli)109,在含有氨苄青霉素的LB固体培养基上筛选阳性菌株。用质粒提取试剂盒提取质粒,采用PCR法、双酶切及测序进行鉴定,将鉴定正确的质粒命名为pMJ67-sp-BSH。
将100 μL感受态乳酸杆菌与5 μL(300~500 ng) pMJ67-sp-BSH在冰浴下混匀,然后加入到冰浴预冷的0.1 cm的电转化杯中,冰上放置10 min。在电压600~1 200 V、电容25 μF、电阻100 Ω条件下进行电击,电击后立即加入0.9 mL预冷的含10%蔗糖的MRS,转入1.5 mL离心管中,37 ℃孵育2 h后,取200 μL涂于含5 μg/mL的红霉素抗性的MRS平板上,37 ℃厌氧培养40 h。在平板上挑取阳性克隆,采用细菌基因组提取试剂盒提取乳酸杆菌基因组,利用引物bsh1和bsh2参照步骤1.3.3进行PCR鉴定和酶切鉴定,并将扩增后的序列进行测序,鉴定正确的即为重组L.caseiCECT5276——L.caseiCECT5276(pMJ67-sp-BSH)。
1.3.5 重组L.caseiCECT5276 BSH的表达与纯化
1)表达产物浓缩:将阳性重组L.caseiCECT5276接种于加有2%牛磺胆酸钠的MRS液体培养基中,37 ℃厌氧静置培养至600 nm处吸光度值(OD600 nm)=0.5时加入0.5%的乳糖,诱导培养36 h,将菌液5 000 r/min离心8 min,取上清液。向100 mL上清液中加入150 mL聚乙二醇6000(PEG6000),搅拌至完全沉淀,5 000 r/min离心10 min,弃上清液,用0.01 mol/L(pH 7.4)的磷酸盐缓冲液(PBS)悬浮沉淀,4 ℃透析48 h,重复5~6次,4 ℃、10 000 r/min离心20 min,弃沉淀,上清液透析48 h,重复5~6次,于-20 ℃保存备用。

3)鉴定:将浓缩液和纯化液于15%的垂直板凝胶中进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),以未诱导的L.caseiCECT5276(pMJ67-sp-BSH)、L.caseiCECT5276(pMJ67-sp)和诱导的L.caseiCECT5276(pMJ67-sp)为对照。
1.3.6L.caseiCECT5276(pMJ67-sp-BSH) BSH活力测定
将L.caseiCECT5276(pMJ67-sp-BSH)于37 ℃用0.5%的乳糖厌氧诱导培养36 h,离心分离上清和沉淀。后者用PBS(pH 6.0)洗2次后,加冰预冷的PBS,混匀,于冰上用超声破碎仪破碎细胞后,于4 ℃、5 000 r/min离心10 min,取上清液。分别以上述培养上清液和菌体裂解上清液为粗酶液进行BSH活力测定,同时以野生型菌株L.plantarumDPP8为对照。样品管和空白对照管分别加入55 mmol/L乙二胺四乙酸(EDTA)溶液0.3 mL,0.01 mmol/L巯基乙醇溶液0.3 mL,0.5 mmol/L pH 6.0 PBS 0.3 mL,0.12 mmol/L牛磺胆酸钠0.1 mL,双蒸水0.3 mL。将上述溶液用移液枪反复吹打混匀后,置37 ℃恒温水浴锅中孵育10 min,向样品管和空白对照管中分别加入1.5和1.2 mL 15%的三氯乙酸,同时吸取0.2 mL的粗酶液加入样品管中,彻底混匀后,于4 ℃、1 000 r/min离心10 min,分别吸取0.8 mL样品管和空白对照管上清液,各加入1.8 mL显色液(0.3 mL 2%茚三酮-柠檬酸盐溶液、1.5 mL 30%甘油),当样品管和空白对照管与显色液彻底混匀后,塞上棉塞于水浴锅中沸水浴15 min,冷却至常温,在570 nm处测定吸光度值(OD570 nm)。BSH活力定义为:每分钟每毫升粗酶液反应产生牛磺酸的微摩尔数。
BSH活力(U/mL)=A×4 000/30。
式中:A表示牛磺酸的微摩尔数。
取0.5 mmol/L的牛磺酸标准液,配制成5个不同浓度的工作液(0.083、0.167、0.250、0.333、0.417 mmol/L),绘制牛磺酸标准曲线。
1.3.7L.caseiCECT5276(pMJ67-sp-BSH)降胆固醇能力测定
标准曲线的制定:取1.0 mg/mL的胆固醇标准液,配制成5个不同浓度的工作液(20、40、60、80、100 μg/mL),然后各取1.0 mL参照文献[17]采用邻苯二甲醛(OPA)法对胆固醇含量进行测定。以1.0 mL无水乙醇作为空白对照,每个浓度重复测定3次,取平均值。
将L.caseiCECT5276(pMJ67-sp-BSH)接种到MRS培养基中活化后,按2%(体积分数)的接种量接种于10 mL降胆固醇培养基中,37 ℃厌氧静止培养,每隔12 h摇匀1次,培养48 h后,吸取混匀的菌液1.0 mL,5 000 r/min离心10 min,检测培养液中胆固醇的残余量。分别以L.caseiCECT5276 (pMJ67-sp)和L.plantarumDPP8为对照。胆固醇降解率计算公式为:
D(%)=[(A-B)/A]×100。
式中:D为胆固醇降解率;A为未接种菌株培养上清液中胆固醇含量;B为重组干酪乳杆菌发酵后培养上清液中胆固醇含量。
1.4 统计分析
试验数据采用Excel 2017软件进行处理,试验结果以平均值+标准误表示,并采用Excel 2017软件进行图形绘制。
2 结果与分析
2.1 BSH基因PCR克隆结果
以L.plantarumDPP8基因组DNA为模板,经PCR扩增后,扩增产物在1%的琼脂糖凝胶上电泳,结果如图1所示,在约975 bp处有1条特异性条带,与预期大小相符。将克隆质粒pMD18-BSH测序,结果表明该基因全长为975 bp。同源性比较显示该基因与L.plantarumMBUL69的BSH基因同源性高达99.6%。进化树分析显示该基因与L.plantarumMBUL69的BSH基因在同一分支。上述结果表明本试验克隆获得了L.plantarumDPP8源的BSH基因(GenBank登录号为:KT343778)。
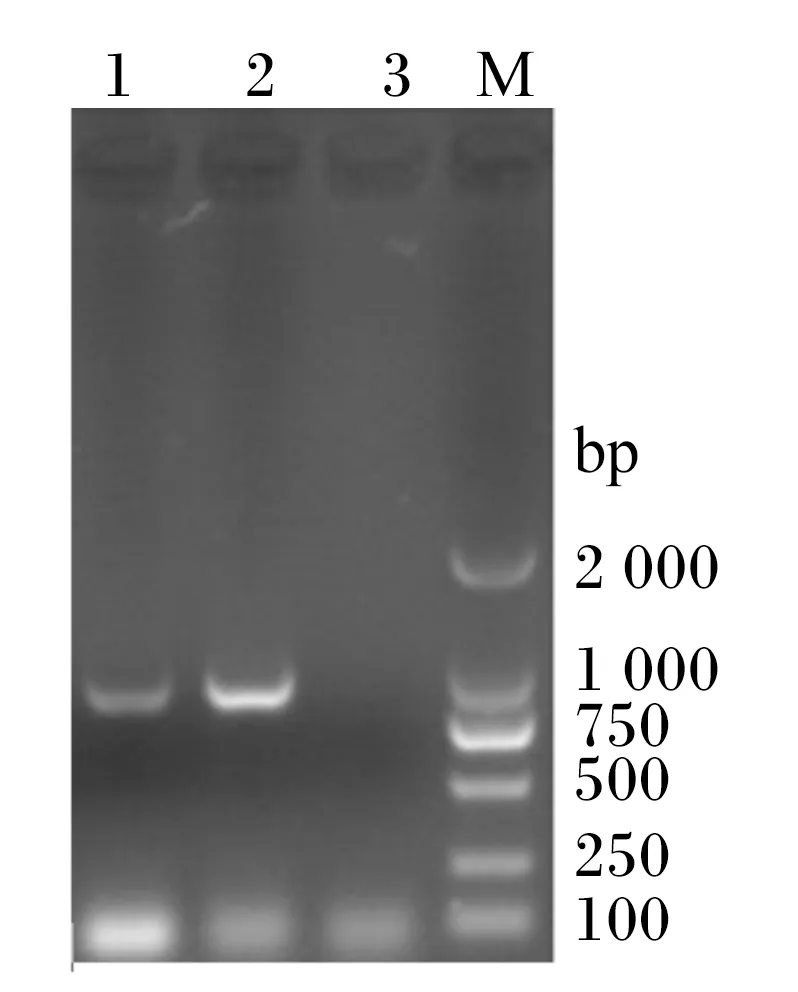
1和2:PCR扩增产物;3:阴性对照;M:DL2000 Marker。
2.2 表达载体pMJ67-sp-BSH的鉴定及重组L. casei CECT5276的PCR鉴定
将表达载体pMJ67-sp与pMD18-BSH同时用NdeⅠ和EcoRⅠ酶切后进行连接,得到重组表达载体pMJ67-sp-BSH。质粒pMJ67-sp-BSH PCR扩增产物和酶切鉴定结果见图2,NdeⅠ/EcoRⅠ双酶切后得到2条分别约为5 000和975 bp的条带,EcoRⅠ单酶切得到1条约为6 000 bp的条带,采用引物bsh1/bsh2进行PCR扩增得到1条约为975 bp的条带,均与预期大小相符,说明重组表达载体pMJ67-sp-BSH构建成功。
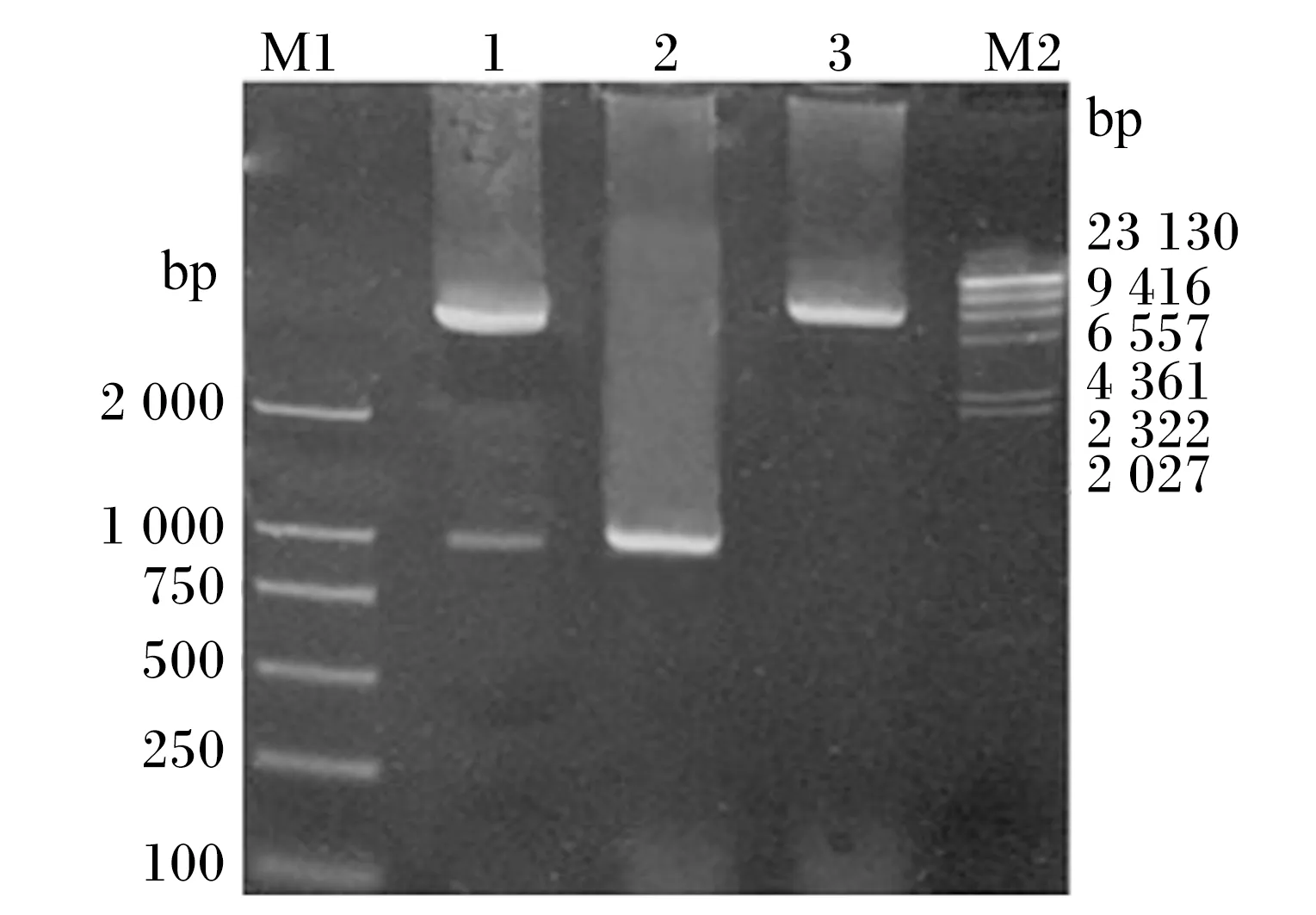
M1:DL2000 Marker;1:NdeⅠ/EcoRⅠ双酶切pMJ67-sp-BSH:2:PCR扩增产物;3:EcoRⅠ单酶切pMJ67-sp-BSH;M2:λDNA/HindⅢ Marker。
表达载体pMJ67-sp-BSH电转化L.caseiCECT5276,通过红霉素抗性平板筛选阳性菌株后,利用引物bsh1/bsh2对阳性菌株基因组进行PCR扩增。由图3可知,L.caseiCECT5276(pMJ67-sp-BSH)能够扩增出约975 bp的条带,证明BSH基因已成功整合到了L.caseiCECT5276基因组上。
2.3 BSH表达产物的SDS-PAGE结果
经乳糖诱导后的重组L.caseiCECT5276用15%凝胶进行SDS-PAGE,其结果见图4。由图4可知,在泳道1约37 ku处有1条清晰的蛋白条带,与推测的BSH蛋白分子质量大小相符,说明BSH在L.caseiCECT5276(pMJ67-sp-BSH)中得到了表达。而未诱导的重组L.caseiCECT5276(pMJ67-sp-BSH)和诱导的原始菌株L.caseiCECT5276(pMJ67-sp)在约37 ku处也有浅淡的条带,说明原始菌株L.caseiCECT5276(pMJ67-sp)和未诱导重组菌株L.caseiCECT5276(pMJ67-sp-BSH)基因组上也能分泌产生类似大小的蛋白,但该蛋白的表达不受乳糖诱导的影响。
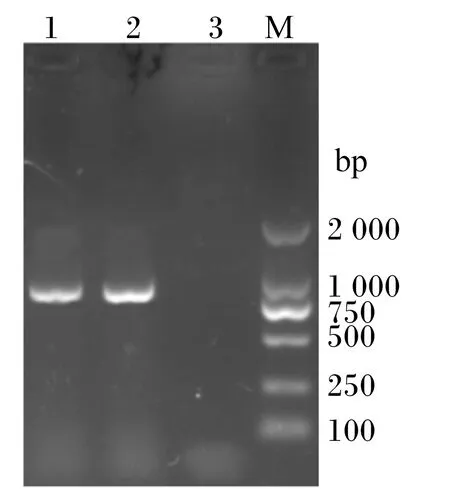
1和2:L. casei CECT5276(pMJ67-sp-BSH)PCR扩增产物;3: L.casei CECT5276(pMJ67-sp)PCR扩增产物;M: DL2000 Marker。
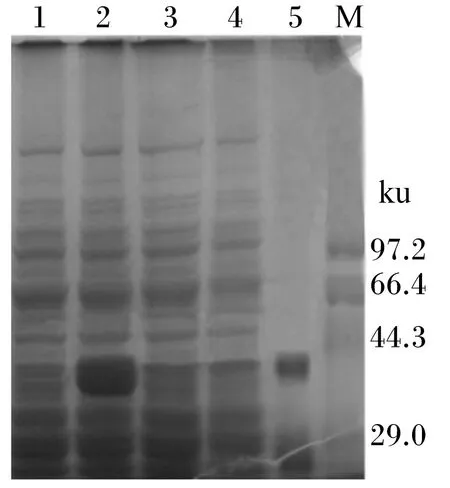
1:L. casei CECT5276(pMJ67-sp-BSH)未诱导产物;2:L. casei CECT5276(pMJ67-sp-BSH)诱导产物;3:L. casei CECT5276(pMJ67-sp)未诱导产物;4:L. casei CECT5276(pMJ67-sp)诱导产物;5:纯化蛋白;M:标准Marker。
2.4 L. casei CECT5276(pMJ67-sp-BSH)表达产物BSH活力测定结果
L.caseiCECT5276(pMJ67-sp-BSH)经乳糖诱导发酵,采用牛磺酸标准液标定法测定BSH的活力,结果见图5。由图5可知,L.caseiCECT5276(pMJ67-sp-BSH)的培养上清液中BSH活力为42.57 U/mL,其细胞裂解液中的BSH活力为4.34 U/mL,说明L.caseiCECT5276(pMJ67-sp-BSH)代谢产生的BSH有90.7%的量全部分泌到了胞外。而野生型菌株L.plantarumDPP8的培养上清液中BSH活力为5.71 U/mL,L.caseiCECT5276(pMJ67-sp-BSH)的培养上清液中BSH活力是野生型菌株L.plantarumDPP8的7.46倍。
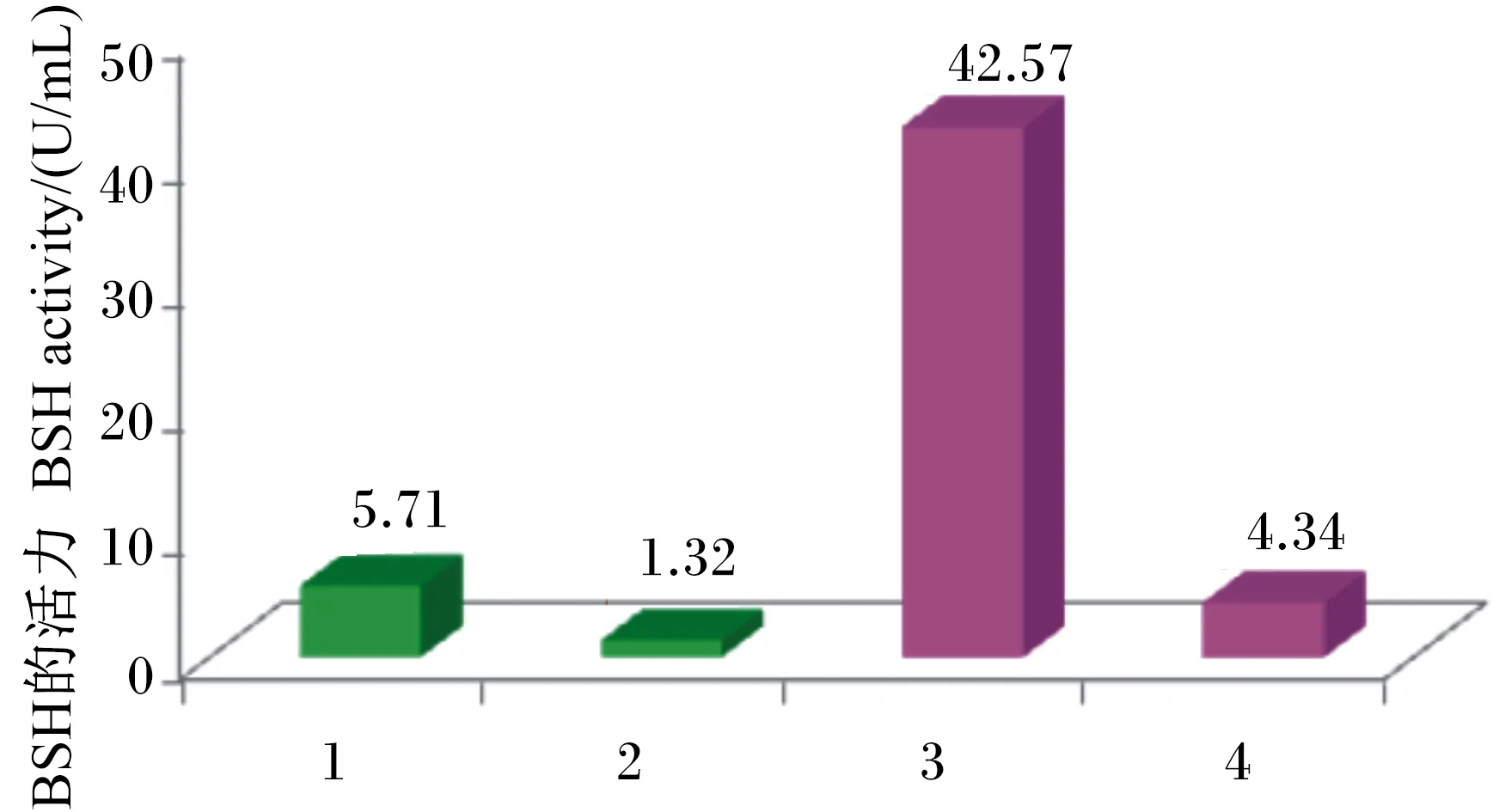
1:L. plantarum DPP8培养上清液;2:L. plantarum DPP8细胞裂解液;3:L. casei CECT5276(pMJ67-sp-BSH)培养上清液;4:L. casei CECT5276(pMJ67-sp-BSH)细胞裂解液。
2.5 L. casei CECT5276(pMJ67-sp-BSH)降胆固醇能力测定结果
采用OPA法对发酵的含胆固醇MRS培养基中的胆固醇含量进行测定,结果见表1。由表1可知,野生型菌株L.plantarumDPP8的胆固醇降解率为35.77%,重组菌株L.caseiCECT5276(pMJ67-sp-BSH)的胆固醇降解率为94.43%,说明重组菌株的降胆固醇能力得到了提升。
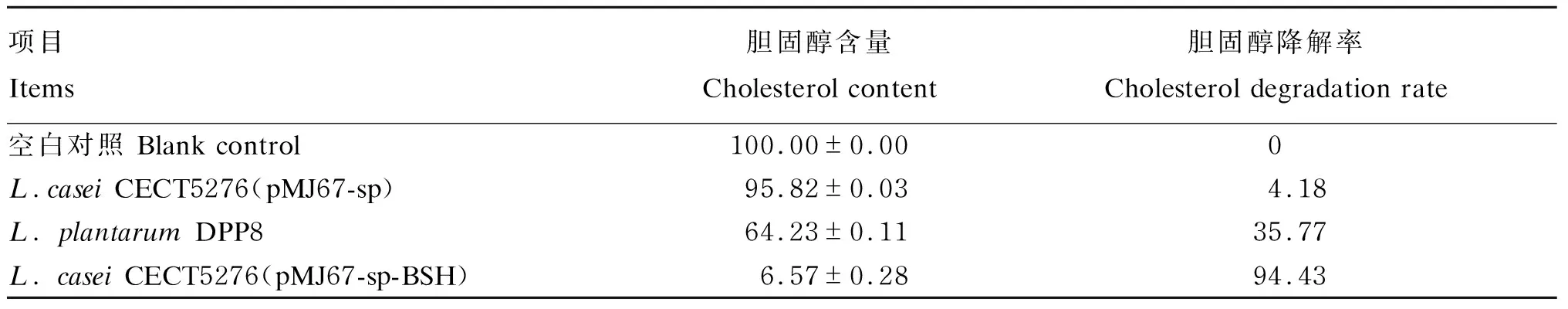
表1 L. casei CECT5276(pMJ67-sp-BSH)降胆固醇解能力测定结果
3 讨 论
BSH是一种能够专一水解胆酸盐和甘氨酸盐等类物质生成氨基酸和非结合态胆酸的蛋白酶,其降低胆固醇的机理是代谢产生的非结合态胆酸能与胆固醇结合形成沉淀,随粪便排出体外,从而降低介质中的胆固醇含量[18-19]。它常常存在于微生物体内,是由微生物代谢产生的一种酶,尤其是在乳酸杆菌类中最为常见,经常服用乳酸杆菌制剂或酸奶能够改善血脂调节血流变,这可能就是因为这类产品具有降胆固醇功效的原因[20-21]。本团队在前期研究中分离获得了1株产BSH的L.plantarumDPP8[16],本试验又成功克隆了其BSH基因。从GenBank中提交的BSH基因的信息分析,BSH基因绝大部分来自于L.plantarum、格氏乳杆菌(L.gasseri)、棒状乳杆菌(L.coryniformis)、发酵乳杆菌(L.fermentum)、唾液乳杆菌(L.salivarius)等[22],但这些不同菌株来源的BSH基因差异较大,同源性最低35.7%,最高可达99.6%,所以BSH存在基因多样性,说明这些不同来源的BSH在关键酶活性位点的空间结构是相同或相近的。因此,L.plantarumDPP8BSH基因的克隆丰富了BSH基因库,对于进一步研究其降胆固醇机制具有重要意义。
目前,关于产BSH的乳酸菌的报道很多,但BSH的体外活力一般均较低[22-23]。本团队所分离筛选的1株降胆固醇乳酸菌L.plantarumDPP8,其所产BSH的活力仅为5.78 U/mL,对培养基中胆固醇的降解率为35.93%[16],说明野生型乳酸菌产BSH以及降胆固醇能力均有限。通过基因工程技术利用高效表达系统是实现高产BSH的最有效途径之一。Yu等[10]将来源于L.plantarumM1-UVS29的BSH基因重组于乳酸乳球菌(L.lactis)NZ9000表达系统,表达的BSH活力为0.77 μmol/min。唐雅茹等[24]将4种BSH基因(BSH1、BSH2、BSH3、BSH4)在L.plantarumKLDS1.0386中进行表达,并证明了不同浓度的不同胆盐底物均可上调BSH的表达。黄艳娜等[25]同样也是将4种BSH基因(BSH1、BSH2、BSH3、BSH4)在L. case LC2w中进行表达研究,表达产物中BSH活力分别为85.06、77.75、45.75、46.50 U/mL。本研究所利用的L.case表达系统L.caseiCECT5276(pMJ67-sp),前期对表达载体pMJ67进行了改造,将短小乳杆菌(L.brevis)1.2028的信号肽基因插入到了pMJ67的启动子之后,从而能够实现目的蛋白的分泌表达。试验结果也验证了这个载体分泌的有效性,约90.7%的BSH被分泌到了胞外,其活力是野生型菌株L.plantarumDPP8的7.46倍,而且能降解培养基中94.43%的胆固醇,远远超出了野生型菌株L.plantarumDPP8 35.77%的胆固醇降解率,说明重组菌株L.caseiCECT5276(pMJ67-sp-BSH)不仅实现了BSH的高效表达,而且所分泌的BSH具有天然的蛋白活性。L.casei本身就是一种益生菌,国际上公认许可用作食品或饲料添加剂,因此重组菌株L.caseiCECT5276(pMJ67-sp-BSH)更具有重要的现实意义,如可用于酸奶发酵可制作功能奶,用于秸秆青贮制作高质量的饲料,或直接将其作为活菌饲料添加剂,这些产品用于人或动物均会使重组菌株L.caseiCECT5276(pMJ67-sp-BSH)及其代谢产生的BSH进入机体内,从而可以降低体内胆固醇的含量,间接达到预防或改善体内脂类的代谢的目的。
4 结 论
本试验成功克隆了L.plantarumDPP8的BSH基因,并将其重组入了L.casei表达系统L.caseiCECT5276(pMJ67-sp)中,实现了BSH在L.caseiCECT5276中的高效分泌表达,其活力可达42.57 U/mL,并可使培养基中胆固醇的降解率达94.43%。
