黄化变异茶树石门黄叶理化分析及茶氨酸相关基因表达研究
2021-02-06金可黄建安熊立瑰刘硕谦覃小洪彭靖李银花李娟
金可,黄建安,2,3,熊立瑰,2,3,刘硕谦,2,3,覃小洪,彭靖,李银花,2,3*,李娟,2,3*
黄化变异茶树石门黄叶理化分析及茶氨酸相关基因表达研究
金可1,黄建安1,2,3,熊立瑰1,2,3,刘硕谦1,2,3,覃小洪4,彭靖1,李银花1,2,3*,李娟1,2,3*
1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2. 湖南农业大学国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3. 湖南省植物功能成分利用省部共建协同创新中心,湖南 长沙 410128; 4. 湖南石门渫峰名茶有限公司,湖南 石门 415300
黄化变异是茶树较为常见的叶色变异现象,黄化茶树的特征性化学成分含量会发生较大变化,其中氨基酸含量显著增加,研究此现象形成的原因有助于揭示叶色与氨基酸代谢的相关性。本研究以石门地区自然黄化变异茶树为材料,对其全黄、全绿和黄绿叶片进行叶绿体超微结构分析和主要生化成分检测,采用实时荧光定量PCR方法检测茶氨酸生物合成相关基因(,,)在不同叶色间的表达水平并分析它们与茶氨酸含量的相关性。结果表明:(1)与绿叶相比,黄化叶的叶绿体结构存在异常,主要表现为类囊体膜结构不清晰;(2)生物碱含量由高到低分别为黄叶、绿叶、黄绿叶,组间差异显著;(3)没食子酸、总儿茶素含量在绿叶中最高,在其他两组间无显著差异,多种儿茶素组分含量随叶片转绿而提高,但EC与叶片黄化程度呈正相关;(4)氨基酸和茶氨酸含量变化趋势与叶片黄化趋势相同;(5)基因和基因在绿叶中表达量最高,在黄绿色叶片中表达量最低,基因在全黄叶片中表达量最高;(6)茶氨酸含量与、、基因表达量均无显著相关性。可见,黄化茶树叶片的叶绿体结构异常,其物质代谢会受到影响,氨基酸分解被抑制,并富集在黄化叶中。
黄化茶树;茶氨酸;茶氨酸合成酶;谷氨酰胺合成酶

植物叶片颜色由其所含色素的共同作用决定[3],在黄化叶中,与叶绿体发育和叶绿素合成相关的基因表达量下降[9-10],而参与类胡萝卜素合成的基因表达量升高[11],使叶绿素与类胡萝卜素的比值降低,叶片呈黄色。强光刺激黄化茶树调控多种基因的表达,调节代谢产物的含量,如下调多酚类物质合成基因表达,使多酚类含量下降[12]。茶氨酸是茶树体内特有的游离氨基酸,在黄化叶中含量较高。茶氨酸的合成需要茶氨酸合成酶(TS)、谷氨酰胺合成酶(GS)、谷氨酰胺酶(GLS)等多种酶的共同作用[13-14],其中,GS是氮同化的限速酶[15],编码基因序列与有高度同源性[16]。虽然目前关于白化、黄化茶树中高氨基酸含量与、表达量之间联系的研究较多[8,10,17-18],但所得结论不同,也未探明氨基酸富集的机理。
黄化变异茶树的研究是茶树资源研究的热点,本研究材料为湖南省石门县雁池乡茶园中发现的1株发生稳定黄化变异的茶树,树龄20年,为本地中小叶群体种,其叶片根据光照强度由强到弱而呈现由黄到绿的叶色。经过连续4年的观察,发现此茶树变异现象稳定,长势较好,为方便后续研究工作,暂时将此茶树命名为石门黄叶。本研究对石门黄叶3种不同颜色叶片(绿、黄绿、黄)进行叶绿体超微结构分析、主要生化成分检测、茶氨酸合成相关基因(、、)相对表达量分析,旨在研究茶树黄化变异现象形成的原因以及同株茶树中不同叶片(黄化叶与绿叶)的茶氨酸积累量与叶色变异的关系。
1 材料与方法
1.1 试验材料
本研究的材料采自石门县雁池乡20年生茶园中1株黄化变异茶树(石门黄叶,本地中小叶群体种)。从不同生长部位剪取枝条插入水中保存带回实验室,取一芽二叶按颜色分为A、B、C 3组,鲜叶分组情况如图1所示。鲜叶从枝条上摘下后用液氮迅速冷冻并存于–80℃冰箱中备用。
1.2 叶绿体超微结构测定
叶绿体超微结构的测定参照Li等[19]的检测方法。
1.3 生化成分检测
茶叶中茶多酚、儿茶素组分的检测均参照GB/T 8313—2018;氨基酸总量的检测参照GB/T 8314—2013;茶氨酸的检测参照龚雨顺等[20]的方法。
1.4 荧光定量PCR(qRT-PCR)检测
采用RNAprep Pure植物总RNA提取试剂盒(TIANGEN)提取茶树叶片样品总RNA。用NanoDrop 2000/2000c检测所提取RNA样品的浓度,并通过1%的琼脂糖凝胶电泳检测所提取总RNA的完整性。采用PrimeScriptTM1st strand cDNA Synthesis Kit(Takara)完成对所提取RNA的反转录,得到模板cDNA。
在GenBank(GB)数据库中搜索得到3段基因序列:(JN226569)、(JQ925872)和(JQ925873)。以18 s RNA为内参基因,使用在线引物设计软件(Primer3Plus)设计引物(表1),并委托生工生物工程(上海)股份有限公司合成。qRT-PCR采用SYBR®Premix Ex Taq™Ⅱ(Takara)试剂盒,按照试剂盒说明书进行操作。
1.5 数据分析
2 结果与分析
2.1 叶绿体超微结构
由图2可知,石门黄叶不同叶片中的叶绿体超微结构存在较大差异。绿叶中,叶绿体紧贴细胞壁,呈椭圆形,体积相近,结构完整,类囊体膜系统清晰有序,淀粉粒数量较多且清晰可见(图2-A)。黄化叶细胞中,中央液泡明显萎缩,含有较多解体组织;叶绿体体积差别较大,少量离壁;片层结构模糊,基粒类囊体数量较少,基质类囊体数量较多;未见明显淀粉粒;基质中存在较多的囊状小泡及较大的嗜锇颗粒(图2-B,图2-C)。
2.2 生物碱含量
由表2可知,可可碱、茶碱和咖啡碱在不同叶片中的变化趋势相同,均在黄叶中含量最高,其次为绿叶、黄绿叶,组间均存在显著性差异。在主要的生物碱成分中,咖啡碱含量明显高于其他成分。生物碱总量在黄叶中最高,达(4.606±0.023)%。
2.3 没食子酸及儿茶素组分含量
不同叶片儿茶素各组分的含量变化如图3所示,表没食子儿茶素(EGC)含量的变化趋势为黄绿叶>绿叶>黄叶(<0.05);D、L型儿茶素(,-C)的含量在黄叶中最高,在其他两组间无显著差异;表儿茶素(EC)在黄叶中含量最高,在绿叶中含量最低(<0.05);表没食子儿茶素没食子酸酯(EGCG)的变化趋势为绿叶>黄绿叶>黄叶(<0.05),与叶片黄化趋势相反;没食子儿茶素没食子酸酯(GCG)在绿叶中含量最高,其次为黄叶、黄绿叶(<0.05);表儿茶素没食子酸酯(ECG)在黄绿叶中的含量显著低于黄叶和绿叶(<0.05),而在黄、绿叶两组间无显著差异。由表3可知,没食子酸和总儿茶素含量的变化趋势相同,均在绿叶中最高,在黄叶和黄绿叶中无显著差异。
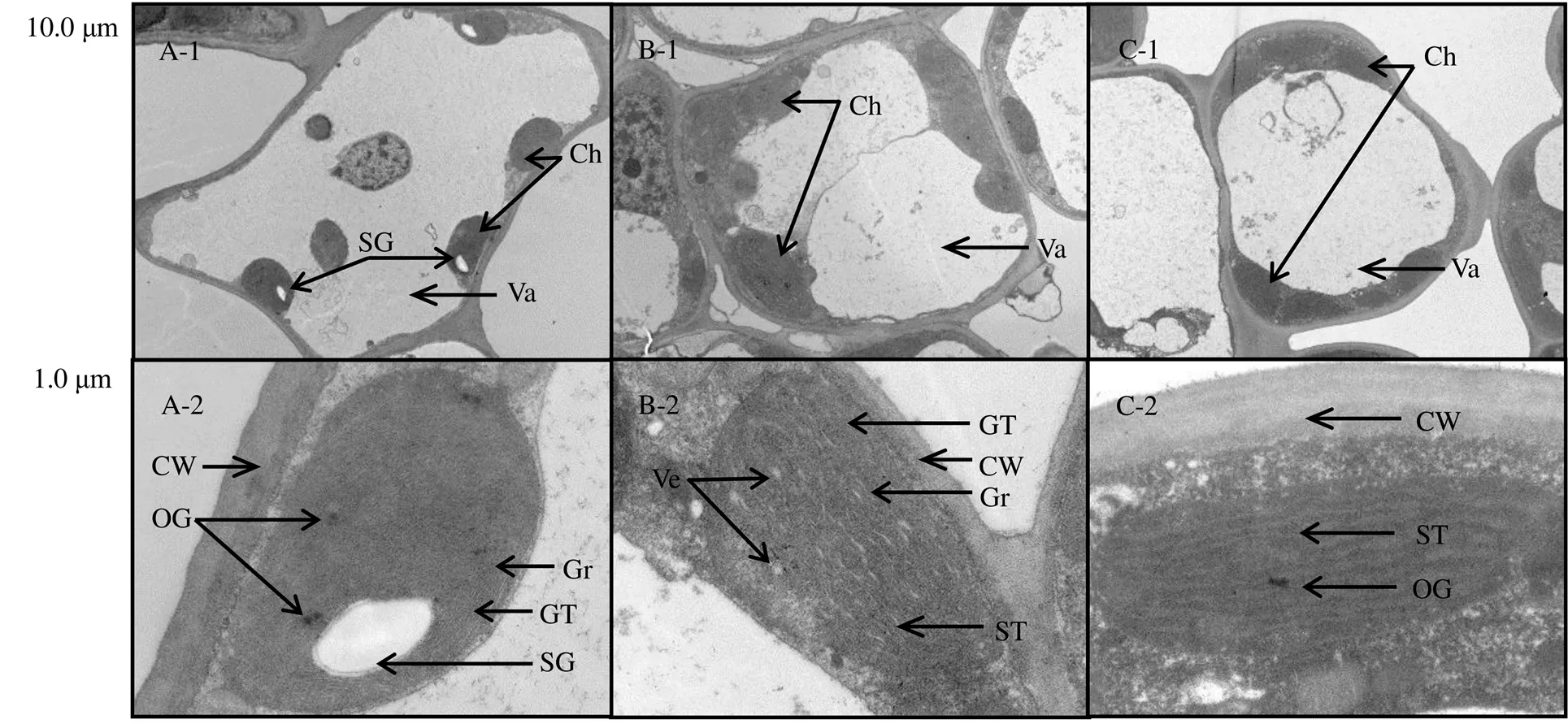
注:A-1和A-2:绿色叶片;B-1和B-2:黄绿色叶片;C-1和C-2:黄色叶片;Ch:叶绿体;CW:细胞壁;GT:基粒类囊体;Gr:基粒;OG:嗜锇颗粒;SG:淀粉粒;ST:基质类囊体;Va:液泡;Ve:囊状小泡
2.4 氨基酸总量与茶氨酸含量
表3显示,茶氨酸含量的变化趋势为黄叶>黄绿叶>绿叶(<0.05),与叶片黄化程度呈正相关,最高达到(2.597±0.008)%。氨基酸总量在黄叶中含量最高,为(5.479±0.039)%,在黄绿叶和绿叶间无显著差异。
2.5 基因相对表达量及其与茶氨酸含量的关系
以全绿叶片作为对照组(图4),和基因在绿叶中表达量最高,其次为黄叶、黄绿叶,各组间均存在显著差异;基因在黄叶中表达量最高,在黄绿叶中表达量最低(<0.05)。Pearson相关性分析显示,叶片中、、相对表达量与茶氨酸含量的相关系数分别为–0.408、–0.462和0.190,均无显著相关性(>0.05)。
3 讨论
植物生长发育所需的物质基础来自于在叶绿体中进行的光合作用。研究发现,黄化叶片中叶绿体的类囊体膜系统异常[9-10,21]。类囊体根据形态不同分为基粒类囊体和基质类囊体,基粒类囊体是光系统Ⅱ和捕光天线复合体Ⅱ的主要分布区[22]。叶绿体中嗜锇颗粒的存在代表了类囊体膜结构和光合色素的降解[23]。本研究观察对比了黄化叶片与绿色叶片的超微结构,发现黄化叶中,叶绿体的类囊体膜系统结构模糊,基粒类囊体较少,淀粉粒体积较小,中央液泡中含有较多解体组织,出现较大的嗜锇颗粒和多个囊状小泡,与Li等[19]、张晨禹等[23]的结果一致。表明黄化叶在受到强光胁迫时,叶绿体功能失常,叶绿素的合成效率下降,而类胡萝卜素的合成增加[16],使叶片褪绿显黄。
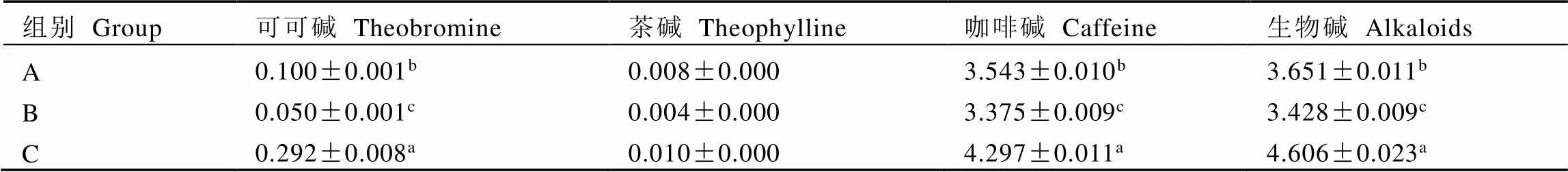
表2 不同叶片中生物碱及其主要组分的含量
注:A:绿色叶片;B:黄绿色叶片;C:黄色叶片;不同小写字母表示组间差异达到显著水平(<0.05)。下同
Note: A: green leaves. B: yellow-green leaves. C: yellow leaves. Different lower case letters mean significant difference between groups (<0.05). The same below

表3 不同叶片中主要品质成分的含量
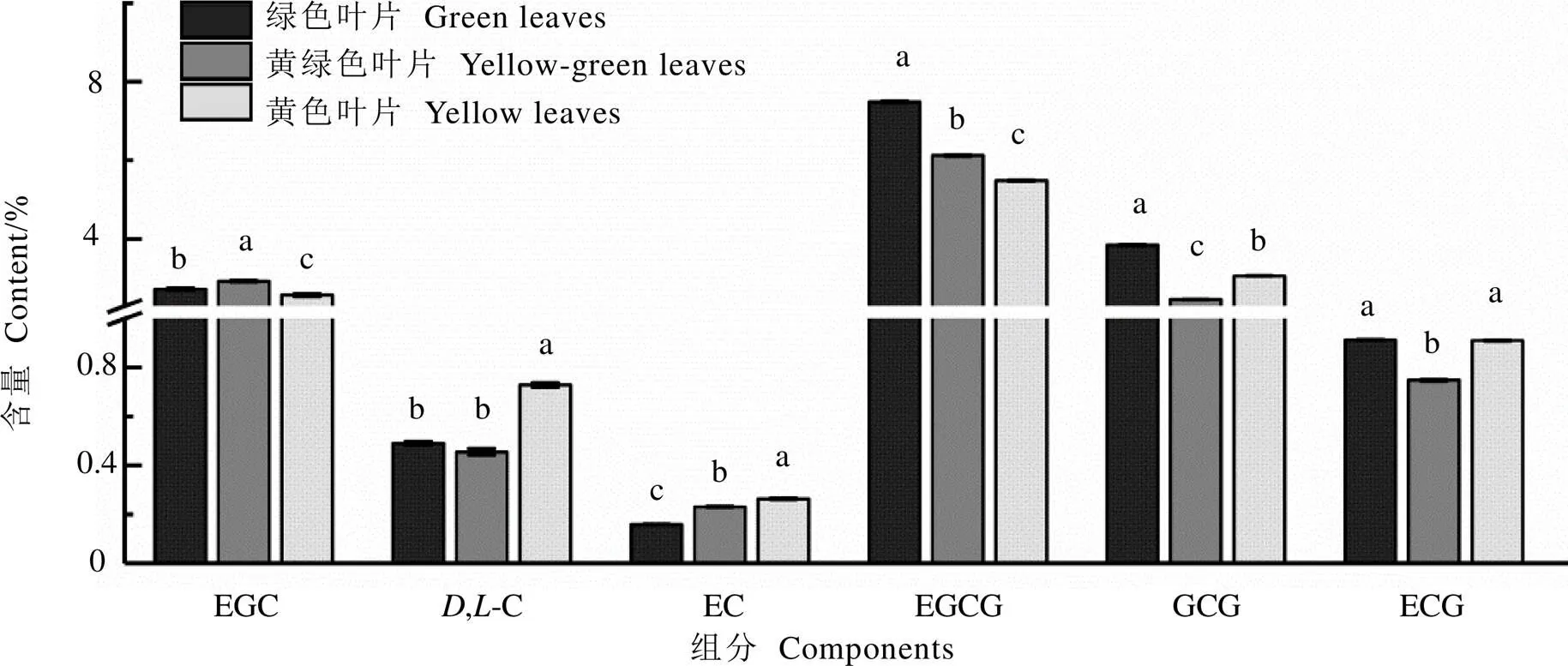
注:不同小写字母表示组间差异达到显著水平(P<0.05),下同
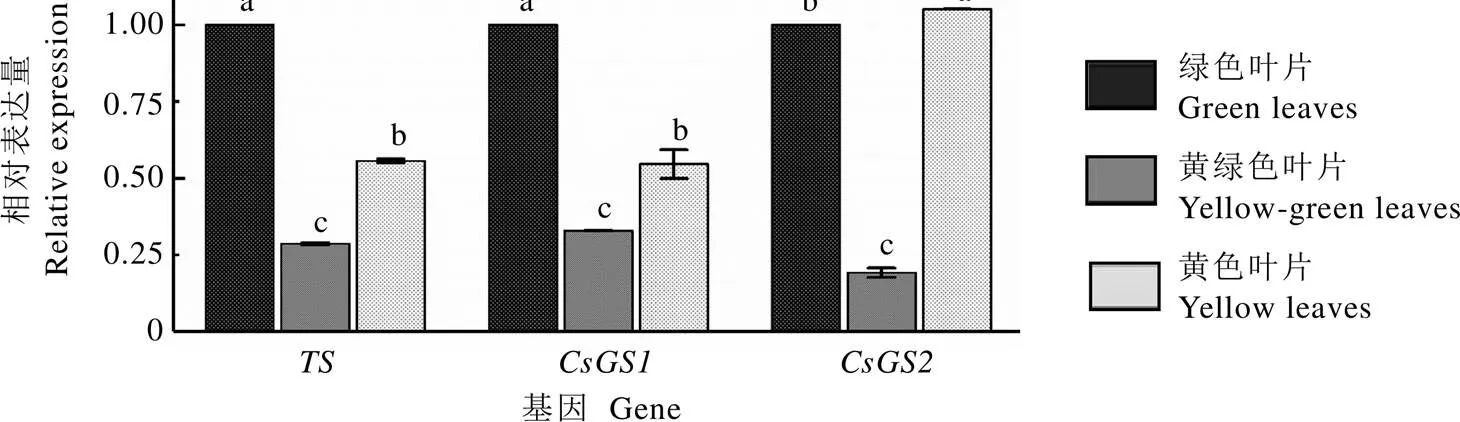
图4 TS、CsGS1、CsGS2基因的相对表达量
多项研究表明,类黄酮合成基因在黄化叶片中表达量下降[11,24],与本研究结果相符,说明强光会刺激黄化叶下调多酚类物质合成基因的表达,使叶片中多酚类物质含量降低。而本研究中EC含量在黄叶中最高,可能是因为其还原能力强,可还原叶片在强光胁迫下产生的过氧化物质,促进EC合成能够起到保护叶片的作用[25-26]。生物碱和氨基酸是茶树鲜叶中主要的含氮化合物[27]。研究发现,与绿叶相比,黄化叶中的蛋白水解酶活性较强[28],可溶性蛋白含量降低,茶氨酸、谷氨酸、谷氨酰胺含量较高[8]。由此推测,在本研究的黄化叶中,蛋白质的降解是氨基酸和茶氨酸含量升高的原因之一。作为氮代谢次生产物,生物碱含量在黄化叶片中含量较高,可能是多种蛋白质被降解为游离氨基酸,生物碱的嘌呤环供体增加,促进了生物碱的合成。
许多研究人员分析了、表达水平与叶色变异茶叶中茶氨酸含量的关系,得出了不同的结果[10,17-18],而本研究发现、、基因的表达量与茶氨酸含量均无显著相关性,与Cheng等[8]的研究结果相似。因此推测,黄化叶片中茶氨酸含量高的原因,不是因为其合成相关基因表达上调所致,而是由于茶氨酸分解路径受阻。
本研究推测氨基酸在黄化叶中富集的机理是:茶树叶片在一定光照条件下,下调叶绿体发育、叶绿素合成相关基因的表达,使叶片呈黄色,从而抑制光合作用,影响茶树物质代谢,同时调控与氮代谢相关基因,促进蛋白质分解,抑制茶氨酸等氨基酸的分解,积累氨基酸。但是目前对茶树中茶氨酸分解路径的研究较少,因此不能明确黄化茶树中茶氨酸分解能力变弱的机制,而且茶树体内的茶氨酸代谢路径极为复杂,易受茶树的品种、栽培环境及氮源等多种因素的影响,明确黄化变异茶树的黄化机理较困难。而石门黄叶可为茶树黄化机理研究排除遗传背景、环境条件等部分因素的影响,是较优的茶树叶色变异研究材料。黄化茶树因叶片在一年中长时间呈黄色,光合能力弱,在移栽或扦插前期成活率较低[29],长势较普通茶树品种差[7]。而石门黄叶的黄化变异较为稳定,酚氨比低,可在光强较弱的季节返绿,且长势较好,具有选育成为新品种的潜力。
[1] 冯琳. 茶树黄化品种的品质化学及黄化机理的分析[D]. 合肥: 安徽农业大学, 2014. Feng L. Quality constituents and albinism analysis in the young leaves of albino tea cultivars [D]. Hefei: Anhui Agricultural University, 2014.
[2] 张向娜, 熊立瑰, 温贝贝, 等. 茶树叶色变异研究进展[J]. 植物生理学报, 2020, 56(4): 643-653. Zhang X N, Xiong L G, Wen B B, et al. Advances in leaf color variation of tea plant () [J]. Plant Physiology Journal, 2020, 56(4): 643-653.
[3] 刘丁丁, 梅菊芬, 王君雅, 等. 茶树白化突变研究进展[J]. 中国茶叶, 2020, 42(4): 24-35. Liu D D, Mei J F, Wang J Y, et al. Research progress on albino trait of tea plant [J]. China Tea, 2020, 42(4): 24-35.
[4] 金孝芳, 马林龙, 刘艳丽, 等. 6个高氨基酸茶树品种(系)主要生化成分分析[J]. 茶叶学报, 2017, 58(2): 58-62. Jin X F, Ma L L, Liu Y L, et al. Biochemical compositions of teas high in amino acids [J]. Acta Tea Sinica, 2017, 58(2): 58-62.
[5] 王开荣. 白茶种质资源利用刍议[J]. 茶叶, 2003(4): 217-219. Wang K R. On the utilization of white tea germplasm resources [J]. Journal of Tea, 2003(4): 217-219.
[6] 李勤, 程晓梅, 李永迪, 等. 安吉白茶阶段性白化过程中光合特性的变化[J]. 分子植物育种, 2019, 17(10): 3391-3398. Li Q, Cheng X M, Li Y D, et al. Changes in photosynthetic characteristics of Anji white tea ((L.) O. Kuntze) during periodic albinism [J]. Molecular Plant Breeding, 2019, 17(10): 3391-3398.
[7] 杨亚军, 胡惜丽, 王新超, 等. 特异优质茶树新品种“中黄2号”选育报告[J]. 中国茶叶, 2017, 39(9): 25-26. Yang Y J, Hu X L, Wang X C, et al. Breeding report of new high-quality tea variety ‘Zhonghuang 2’ [J]. China Tea, 2017, 39(9): 25-26.
[8] Cheng S H, Fu X M, Liao Y Y, et al. Differential accumulation of specialized metabolite L-theanine in green and albino-induced yellow tea () leaves [J]. Food Chemistry, 2019, 276: 93-100.
[9] Reinbothe S, Reinbothe C, Holtorf H, et al. Two NADPH: protochlorophyllide oxidoreductases in barley: evidence for the selective disappearance of PORA during the light-induced greening of etiolated seedlings [J]. The Plant Cell, 1995, 7(11): 1933-1940.
[10] Liu G F, Han Z X, Feng L, et al. Metabolic flux redirection and transcriptomic reprogramming in the albino tea cultivar 'Yu Jin Xiang' with an emphasis on catechin production [J]. Scientific Reports, 2017, 7: 45062. doi: 10.1038/srep45062.
[11] Shin Y H, Yang R, Shi Y L, et al. Light-sensitive albino tea plants and their characterization [J]. HortScience, 2018, 53(2): 144-147.
[12] Wang L, Cao H, Chen C, et al. Complementary transcriptomic and proteomic analyses of a chlorophyll-deficient tea plant cultivar reveal multiple metabolic pathway changes [J]. Journal of Proteomics, 2016, 130: 160-169.
[13] Li C F, Zhu Y, Yu Y, et al. Global transcriptome and gene regulation network for secondary metabolite biosynthesis of tea plant () [J]. BMC Genomics, 2015, 16: 560. doi: 10.1186/s12864-015-1773-0.
[14] Xu Q, Zhu J, Zhao S, et al. Transcriptome profiling using single-molecule direct RNA sequencing approach for in-depth understanding of genes in secondary metabolism pathways of[J]. Frontiers in Plant Science, 2017, 8: 1025. doi: 10.3389/fpls.2017.01205.
[15] Lea P, Miflin B J. Alternative route for nitrogen assimilation in higher plants [J]. Nature, 1974, 251: 614-616.
[16] 史成颖, 李正国, 徐乾, 等. 茶树谷氨酰胺合成酶同源基因的克隆及表达分析[J]. 西北植物学报, 2017, 37(1): 40-47. Shi C Y, Li Z G, Xu Q, et al. Clone and expression ofhomologue of tea plant () [J]. Acta Botanica Boreali-Occidentalia Sinica, 2017, 37(1): 40-47.
[17] 李娟. 安吉白茶高氨基酸性状相关基因的全长cDNA克隆及功能的初步研究[D]. 长沙: 湖南农业大学, 2011. Li J. Full-length cDNA cloning & preliminary function study of genes related to the high amino acid level in Anji white tea ((L.) O. Kuntze) [D]. Changsha: Hunan Agricultural University, 2011.
[18] 林郑和, 钟秋生, 陈常颂. 茶树叶片、、基因的克隆及荧光定量PCR分析[J]. 茶叶科学, 2012, 32(6): 523-529. Lin Z H, Zhong Q S, Chen C S. Molecular cloning and quantitative analysis of,andgenes from leave of tea plant [J]. Journal of Tea Science, 2012, 32(6): 523-529.
[19] Li Q, Huang J A, Liu S Q, et al. Proteomic analysis of young leaves at three developmental stages in an albino tea cultivar [J]. Proteome Science, 2011, 9: 44. doi: 10.1186/1477-5956- 9-44.
[20] 龚雨顺, 黄建安, 崔湘兴, 等. 离子对色谱法测定茶叶中的茶氨酸[J]. 茶叶科学, 2008, 28(2): 89-92. Gong Y S, Huang J A, Cui X X, et al. Determination of theanine in tea by paired ion chromatography [J]. Journal of Tea Science, 2008, 28(2): 89-92.
[21] Wu Q, Chen Z, Sun W, et al. De novo sequencing of the leaf transcriptome reveals complex light-responsive regulatory networks incv.[J]. Frontiers in Plant Science, 2016, 7: 332. doi: 10.3389/fpls.2016.00332.
[22] Albertsson P. A quantitative model of the domain structure of the photosynthetic membrane [J]. Trends in Plant Science, 2001, 6(8): 349-354.
[23] 张晨禹, 王铭涵, 高羲之, 等. 茶树‘湘妃翠’黄化枝光合生理与组织学[J]. 分子植物育种, 2019, 17(23): 7892-7900. Zhang C Y, Wang M H, Gao X Z, et al. Photosynthetic physiological and histology in novel etiolated branch of the 'Xiangfeicui' tea plant () [J]. Molecular Plant Breeding, 2019, 17(23): 7892-7900.
[24] Song L, Ma Q, Zou Z, et al. Molecular link between leaf coloration and gene expression of flavonoid and carotenoid biosynthesis incultivar ‘Huangjinya’ [J]. Frontiers in Plant Science, 2017, 8: 803. doi: 10.3389/fpls.2017.00803.
[25] Ma C L, Chen L, Wang X C, et al. Differential expression analysis of different albescent stages of ‘Anji Baicha’ ((L.) O. Kuntze) using cDNA microarray [J]. Scientia Horticulturae, 2012, 148: 246-254.
[26] Zhang C Y, Wang M H, Gao X Z, et al. Multi-omics research in albino tea plants: past, present, and future [J]. Scientia Horticulturae, 2020, 261: 108943. doi: 10.1016/j.scienta. 2019. 108943.
[27] 李治鑫. CO2浓度升高和高温胁迫对茶树生长发育的影响[D]. 北京: 中国农业科学院, 2016. Li Z X. Effects of elevated CO2and heat stress on growth and development of tea plant [D]. Beijing: Chinese Academy of Agricultural Sciences, 2016.
[28] 李素芳. 安吉白茶返白机理的研究[J]. 中国计量学院学报, 2002, 13(3): 51-54. Li S F. Studies on the mechanism of the leaf color change in ‘Anjibaicha’ () [J]. Journal of China Institute of Metrology, 2002, 13(3): 51-54.
[29] 李荣林, 孔云龙. 白化茶的研究与开发[J]. 江苏农业科学, 2010(6): 12-15. Li R L, Kong Y L. The research and development of albino tea cultivars [J]. Jiangsu Agricultural Sciences, 2010(6): 12-15.
Research of Theanine-related Genes Expressed in Etiolated Tea Plant()
JIN Ke1, HUANG Jian'an1,2,3, XIONG Ligui1,2,3, LIU Shuoqian1,2,3, QIN Xiaohong4, PENG Jing1, LI Yinhua1,2,3*, LI Juan1,2,3*
1. Key Laboratory of Tea Science of Ministry of Education, Changsha 410128, China; 2. National Research Center of Engineering and Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 3. Co-Innovation Center of Education Ministry for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 4. Xie Feng Famous Tea, Shimen 415300, China
Etiolation is a common morphological variation in tea plants. In those mutants, the contents of the characteristic metabolites change greatly and amino acids are highly accumulated. Studying the reasons of these changes can help to reveal the relationship between leaf color variation and amino acid metabolism. In this study, an etiolated tea plant, which was found accidentally in Shimen area, was used as the research material. As a leaf-color mutant, it has three different colored leaves: yellow, green and yellow-green.The ultrastructure of the chloroplasts, the contents of characteristic metabolites, the expression levels of theanine-related genes (,,) andthe correlation between the expression levels and theanine in different leaveswere studied. The results show: (1) the chloroplast structure of the yellow leaves was abnormal, which mainly presented as the blurry structure of the thylakoid membrane. (2) the alkaloid contents reduced from yellow, green to yellow-green leaves with significant differences. (3) gallic acid and total catechin contents were the highest in green leaves, and there was no significant difference between the other two groups. The contents of multiple catechins increased as the leaves turned green, but the contents of EC were positively related to the etiolation. (4) the contents of amino acids and theanine increased as the leaves turned yellow. (5)andshowed the highest expressions in green leaves but the lowest expressions in yellow-green leaves.Whileexhibited the highest expression in yellow leaves. (6) high theanine content was not related to the expressions of,and. In summary, the chloroplast structure of etiolated tea plant is abnormal, the metabolism is affected, the amino acid decomposition is inhibited in the etiolated leaves, which result in the enrichment of amino acids.
etiolated tea plant, theanine, theanine synthetase, glutamine synthetase
S571.1
A
1000-369X(2021)01-040-08
2020-06-22
2020-08-24
国家自然科学基金(U19A2030、31500567)、中央引导地方科技发展专项(2019XF5041)
金可,女,硕士研究生,主要从事茶树分子生物学研究。*通信作者:liyinhua1012@126.com,xixi_lj@126.com
(责任编辑:黄晨)
