驱动蛋白Kif5b对人脐静脉内皮细胞血管形成的作用*
2021-02-05罗语思肖美兰陈妍张科
罗语思,肖美兰,陈妍,张科
(1.贵州医科大学附属医院 急诊科,贵州 贵阳 550004;2.贵州医科大学 药学院 贵州省高等学校天然药物药理与成药性评价重点实验室,贵州 贵阳 550025;3.贵州医科大学 基础医学院 现代病原生物学特色重点实验室 & 基础医学院寄生虫学教研室 & 药学院天然药物资源优效利用重点实验室,贵州 贵阳 550025)
多数细胞内新合成的蛋白需要由胞内各马达蛋白经细胞骨架微丝或微管定向运输到胞内各处,以履行其功能[1];神经细胞、上皮细胞及大部分血管内皮细胞作为具有极性的细胞,均由马达蛋白调控胞内新合成蛋白的运输[1]。马达蛋白主要由驱动蛋白超家族(kinesins,Kifs)、动力蛋白超家族(dyneins)和肌球蛋白超家族(myosins)组成,其中Kifs由4个结构域组成,分别是马达结构域、超螺旋部分的二聚化结构域、连接马达结构域和二聚化结构域的颈部及两条重链(kinesin heavy chain,KHC)和轻链(kinesin light chain,KLC)共同构成的尾部[1-2]。运输蛋白时主要通过水解三磷酸腺苷获能供马达结构域在细胞微管上做定向运动,其运输的蛋白包括线粒体蛋白[3]、溶酶体蛋白(lysosome-associated membrane protein 2,LAMP2)[4]、神经细胞突触素(synaptophysin)[5]、神经细胞突触膜前体蛋白1(syntaxin 1)[6]以及载脂蛋白E受体2(apolipoprotein E receptor 2,ApoEr2)[7]等,上述蛋白通过与Kifs尾部结构域直接结合或通过与Kifs颈部和轻链间接作用而结合后以细胞微管为轨道做定向运动。目前已在哺乳动物基因组中发现45个Kifs基因,依据马达结构域的位置不同而划分为N-Kifs,M-Kifs和C-Kifs。Kinesin1基因家族属于N-Kifs,Kif5b是Kinesin1基因家族重要成员,其蛋白广泛表达在各组织细胞[1,8]。研究表明Kif5b参与了肿瘤细胞的侵袭与转移等生物学过程[9],如在1例非小细胞肺癌患者的转移灶中首次发现Kif5b-Ret融合基因[10]。Ret表达产物Ret蛋白为酪氨酸激酶受体,Kif5b-Ret融合基因表达的融合蛋白由Kif5b的马达结构域和超螺旋结构域和Ret编码的酪氨酸蛋白激酶结构域组成,该融合蛋白通过超螺旋结构域形成同源二聚体,激活细胞内酪氨酸激酶蛋白,透过数条信号通路导致细胞癌变,因此被认为是非小细胞肺癌的下一个重要酪氨酸激酶抑制剂作用靶点[8]。同时,Kif5b亦被发现通过调控溶酶体、线粒体和金属基质蛋白酶-1等的运输参与乳腺肿瘤发生[11-12]。肿瘤发生发展的一个重要环节是新生血管生成,在肿瘤生长、侵袭、转移和预后中发挥重要作用[13-14]。Kif5b是否参与调控新生血管生成尚未见报道,本研究以驱动蛋白Kif5b为研究对象,通过慢病毒系统感染HUVECs下调其表达,获取驱动蛋白Kif5b影响HUVECs血管形成的实验依据,为进一步开展细胞驱动蛋白通过影响血管内皮细胞形成从而参与肿瘤细胞侵袭与转移等生物学过程的科学研究提供基础资料。
1 材料与方法
1.1 材料
1.1.1细胞和质粒 HUVECs为Angiogenesis Starter试剂盒内容物之一,HEK293T和慢病毒载体pLL3.7及其助手质粒(pVSVG、pGag和pRev)均由本校基础医学院现代病原生物学特色重点实验室保存。
1.1.2主要试剂及仪器 Angiogenesis Starter试剂盒、细胞染料Calcein AM、转染试剂Lipofectamine 3000、Geltrex® LDEV-无低生长因子的基底膜基质(Geltrex® Matrix)及Pierce BCA Protein Assay Kit均购自美国Thermo Fisher公司(批号A14609-01、C3099、L3000-015、A14132-02和23225),嘌呤霉素和Tubulin单抗购自美国Sigma-Aldrich公司(批号61-385-RA和T6199),QIAquick Gel Extraction Kit和Qiagen Plasmid Maxi Kit购自德国Qiagen公司(批号28706和12163),Lenti-XTMp24 Rapid Titer Kit购自Takara公司(批号632200),HEK293T细胞培养所需培养基及HUVECs培养所需左旋谷氨酰胺和青链双抗购自美国Gibco公司;Gene Pulser Xcell电转仪购自美国Bio-Rad公司,Nikon Eclipse TE2000-s倒置荧光显微镜购自日本尼康公司,MME-250金属卤化物光源购自日本Moritex公司,Neo sCMOS照相机购自英国牛津仪器公司。
1.2 方法
1.2.1细胞培养 HUVECs培养于含2 mmol/L左旋谷氨酰胺、1%青链双抗和血管内皮细胞生长因子的M200培养基;HEK293T培养于含2 mmol/L左旋谷氨酰胺、100 μmol/L MEM非必须氨基酸、10%胎牛血清、500 mg/L G418和1%青链双抗的DMEM培养基。
1.2.2质粒构建及鉴定 实验分为Kif5b实验组和Kif5b对照组2组,Kif5b实验组是基于pLL3.7质粒和靶向降解Kif5b基因mRNA的小发夹RNA(small hairpin RNA,shRNA)为基础构建的Kif5b敲减HUVECs组,Kif5b对照组是基于pLL3.7质粒和阴性对照shRNA为基础构建的HUVECs阴性对照组。Kif5b实验组质粒构建,首先以人Kif5b编码区基因序列(GenBank序列号为NM_004521.2)为模板设计shRNA以及阴性对照shRNA(表1,斜体示shRNA序列)。分别以pLL3.7空质粒为模板,表1序列为引物进行聚合酶链式反应(polymerase chain reaction,PCR)反应,纯化PCR产物和pLL3.7空质粒进行酶切连接,电转E.coliDH5α感受态细胞后37 ℃过夜培养,获得的阳性克隆经PCR验证后分别命名为Kif5b实验组质粒和Kif5b对照组质粒分别用于Kif5b敲减和对照。随后分别提取Kif5b实验组质粒、Kif5b对照组质粒和pLL3.7载体慢病毒系统助手质粒(pVSVG、pGag和pRev)。

表1 Kif5b实验组和Kif5b对照组质粒构建引物(5′-3′)
1.2.3质粒重组慢病毒包装及滴度测定 分别取Kif5b实验组质粒或Kif5b对照组质粒 6 μg、pVSVG 2 μg、pGag 6 μg和pRev 6 μg,按转染试剂Lipofectamine 3000操作手册操作后加入HEK293T细胞中,培养8 h吸弃上清,加含2%胎牛血清的Opti-MEM继续培养至48 h,收集上清并过滤,-80 ℃保存备用。Kif5b实验组重组慢病毒和Kif5b对照组重组慢病毒滴度按照Lenti-XTMp24 Rapid Titer Kit手册操作测定。
1.2.4重组慢病毒感染HUVECs及筛选 将等量Kif5b实验组和Kif5b对照组重组慢病毒与M200培养基等体积混合加入HUVECs中,于37 ℃和5%CO2无菌细胞培养箱中感染48 h,以2 g/L嘌呤霉素筛选被慢病毒感染的细胞,经筛选获得的Kif5b实验组HUVECs即代表Kif5b实验组,Kif5b对照组HUVECs即代表Kif5b对照组。
1.2.5Kif5b表达 首先裂解Kif5b实验组和Kif5b对照组细胞,随后按照Pierce BCA Protein Assay Kit操作手册定量细胞总蛋白;取等量蛋白变性后进行Western blot实验检测Kif5b表达,同时以Tubulin单抗检测内参Tubulin,按照Image J软件操作手册比较Kif5b实验组和Kif5b对照组的Kif5b表达情况,实验独立重复3次。
1.2.6HUVECs细胞成管实验 参考文献[15]方法将Geltrex® Matrix按0.1 mL/孔加入预冷24孔板,37 ℃静置30 min,将培养好的Kif5b实验组和Kif5b对照组HUVECs按1×105细胞/250 μL培养基/孔接种入Geltrex®Matrix涂层的24孔板中,培养10 h;DPBS清洗细胞,含2 g/L Calcein AM的DPBS缓冲液于黑暗条件下继续培养30 min,485 nm波长激发光Nikon Eclipse TE2000-s倒置荧光显微镜观察记录,每组细胞选取3孔计算细胞成管率,实验独立重复3次。
1.2.7HUVECs细胞划痕实验 参考文献[16]方法将100 mg/L多聚赖氨酸过夜包被细胞培养皿,次日2 g/L牛血清白蛋白封闭,加M200培养基浸泡培养皿,将培养好的Kif5b实验组和Kif5b对照组HUVECs消化后接种于培养皿,6 h后以无菌p200吸管尖将单层细胞轻柔划开,吸弃原培养基和细胞碎片,加新培养基继续培养。使用软件(http://rsb.info.nih.gov/ij/)通过比较划痕实验后0 h和9 h的图像,计算HUVECs细胞迁移速度,实验独立重复3次。
1.3 统计学分析

2 结果
2.1 Kif5b表达
Western blot实验结果显示,在蛋白上样量相当的情况下,Kif5b实验组HUVECs的Kif5b表达较Kif5b对照组下降,差异有统计学意义(P<0.05),说明Kif5b实验组重组慢病毒构建成功,能够为后续实验结果可靠性提供保证。见图1。

注:A为Western blot实验结果,B为Kif5b的定量表达结果;(1)与Kif5b对照组比较,P<0.05。
2.2 细胞成管率
细胞成管实验结果显示,Kif5b实验组HUVECs几乎不能形成毛细管状结构,但Kif5b对照组细胞能够形成该结构;Kif5b实验组HUVECs细胞成管率明显低于对照组,差异有高度统计学意义(P<0.000 1),说明敲降Kif5b的HUVECs细胞成管能力明显下降。见图2。
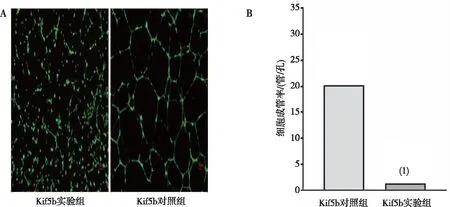
注:A为细胞成管实验荧光图(100×),B为细胞成管率的定量表达;(1)与Kif5b对照组比较,P<0.000 1。
2.3 细胞迁移速度
细胞划痕实验结果显示,与0 h比较,9 h时Kif5b实验组和对照组细胞HUVECs均能向划痕中心迁移,且Kif5b实验组HUVECs细胞迁移速度明显低于Kif5b对照组,差异有高度统计学意义(P<0.000 1)。见图3。
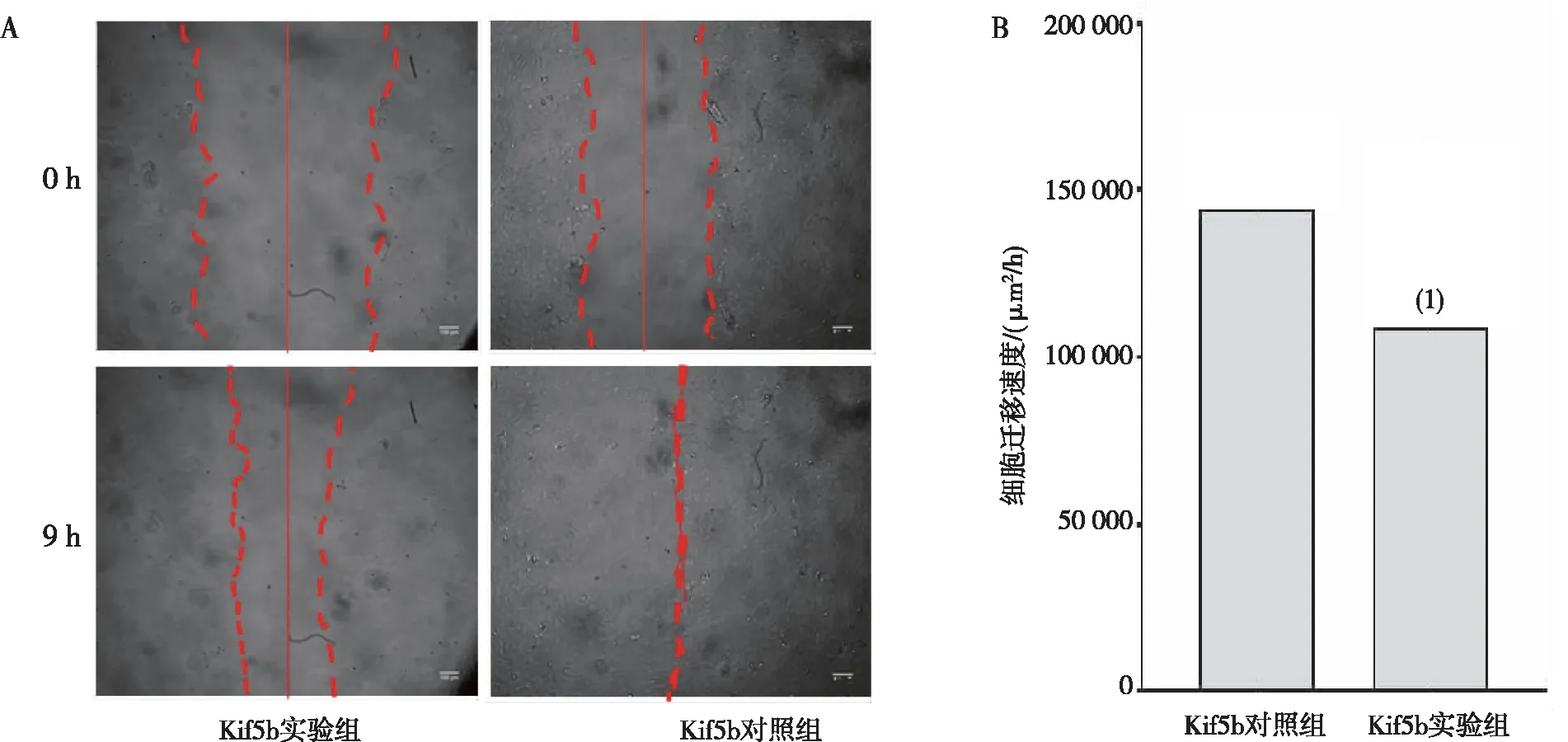
注:A为细胞划痕实验白光图(100×),红色直线示划痕中心位置,两侧红色虚线示划痕边缘位置;B为细胞迁移速度的定量结果;(1)与Kif5b对照组比较,P<0.000 1。
3 讨论
本研究以了解驱动蛋白Kif5b对HUVECs血管形成的作用为目的,探讨Kif5b可能通过影响HUVECs血管形成从而参与瘤细胞侵袭与转移等生物学过程,以pLL3.7慢病毒系统将Kif5b为目的蛋白的shRNA导入HUVECs中,下调Kif5b表达,随后通过细胞成管实验和细胞划痕实验观察发现Kif5b对HUVECs细胞形成管状结构和促进细胞迁移具有重要作用。
内皮细胞高表达的CD151和内皮细胞特异性分子-1(Endocan)等蛋白已被报道与血管生成密切相关,Endocan还被特别指出与肿瘤血管生成密切相关[17-18]。肿瘤血管生成是肿瘤生长、侵袭及转移等生物学行为的基石,近年来已有一系列关于Kif5b参与肺肿瘤和乳腺肿瘤的报道[8-12],但有研究发现Kif5b可通过对线粒体的运输参与Myc癌基因在转录阶段对线粒体转运的一系列基因网络调控[19],这提示Kif5b可能通过Myc对于肿瘤转移发挥重要作用,应考虑Kif5b在肿瘤中的作用,可能不只局限于肺肿瘤和乳腺肿瘤,在多数实体肿瘤的发生和进展中也可能具有重要作用。本研究中,通过下调Kif5b表达分析出该驱动蛋白对HUVECs细胞管状结构形成和细胞迁移能力的影响,发现下调Kif5b的表达能够明显抑制细胞形成管状结构和促进细胞迁移的能力,这些证据提示驱动蛋白Kif5b很可能参与了以HUVECs为代表的人血管内皮细胞形成新生血管,进而对Kif5b在实体肿瘤侵袭和转移过程中的作用提供了实验依据。同时在胃部肿瘤相关研究中发现Hippo信号通路关键效应因子含有WW 结构域转录调节因子1(WW domain-containing transcription regulator protein 1,WWTR1)与Wnt 通路效应分子β-catenin高度正相关,且WWTR1与β-catenin的表达水平与HUVECs增殖和管道形成能力呈正相关[20];已有报道显示与WWTR1介导胞核转运的14-3-3γ蛋白与Kif5b-KLC1高度关联[21]。此外,还有研究使用了和本课题类似的技术下调Kif5b表达,分析了该驱动蛋白对MDCK细胞的影响,结果发现Kif5b沉默后诱导MDCK细胞经历了上皮细胞-间充质转化过程,去分化为间充质干细胞样细胞[22]。上述报道为进一步拓展本研究的结论提供了方向。
综上,本研究下调了HUVECs细胞中Kif5b的表达后,通过细胞成管实验和细胞划痕实验发现Kif5b对人血管内皮细胞形成管状结构和细胞迁移均具有正向调节作用。下一步还需通过构建Kif5b过表达系统,开展类似实验,以及一系列如WWTR1、14-3-3γ与Kif5b互作的机制研究,同时也展开动物实验,为进一步揭示肌动蛋白Kif5b参与血管形成的作用机制,以及其在肿瘤生长、侵袭、转移和预后中参与新生血管形成的机制奠定更加坚实基础。
