成人糖尿病患者血压管理专家共识
2021-02-05上海市医学会糖尿病专科分会上海市医学会内分泌专科分会
上海市医学会糖尿病专科分会 上海市医学会内分泌专科分会
糖尿病和高血压是两种高发的严重危害人民健康的疾病,两者常共存。管理好糖尿病患者的血压是预防和延缓糖尿病并发症的重要措施,对降低糖尿病和高血压的疾病负担具有重要意义,但目前我国糖尿病患者的血压控制状况并不理想。中国2型糖尿病患者心血管疾病危险因素——血压、血脂、血糖的全国性评估研究(Nationwide assessment of cardiovascular risk factors: Blood glucose, Blood pressure, and Blood lipid in Chinese patients with type 2 diabetes, 3B STUDY)[1]显示,合并高血压的糖尿病患者中只有76.9%接受抗高血压药治疗,其中仅有17.5%血压达标。因此,需要重视糖尿病患者的血压管理。
2012年,中华医学会内分泌学分会曾组织专家讨论制订《中国糖尿病患者血压管理的专家共识》[2],对我国糖尿病患者血压管理起到了积极的作用。近年来,糖尿病和高血压领域新的循证医学证据不断涌现,国内外糖尿病和高血压指南时有更新,尤其是新型降糖药钠-葡萄糖协同转运蛋白2(sodium-dependent glucose transporters 2,SGLT2)抑制剂具有良好的降压作用,对糖尿病患者的血压管理产生有益的影响。鉴于此,上海市医学会糖尿病专科分会和上海市医学会内分泌专科分会组织专家对相关临床证据进行了分析和梳理,就成人糖尿病患者血压管理形成本共识。本共识参考美国心脏病学院(American College of Cardiology, ACC)与美国心脏学会(American Heart Association, AHA)联合制订的心血管疾病一级预防指南[3]的推荐级别(COR)和证据水平(LOE)分类表示推荐意见的强度和质量,主要推荐意见详见表1。

表1 本共识的主要推荐意见
1 流行病学与危害
2015—2017年甲状腺疾病、碘状态和糖尿病流行病学调查(Thyroid disorders, Iodine status and Diabetes Epidemiological survey, TIDE)[4]研究结果显示,按照WHO诊断标准,我国18岁及以上人群糖尿病患病率为11.2%,按照美国糖尿病学会(American Diabetes Association, ADA)诊断标准糖尿病患病率为12.8%。2012—2015年中国高血压调查(China Hypertension Survey)研究[5]显示, 按照中国高血压管理指南(2010版) 诊断标准,我国18岁及以上人群高血压患病率为23.2%,按照ACC或AHA指南诊断标准高血压患病率为46.4%。
糖尿病常与高血压共存。国外资料显示,高血压患者中约20%伴2型糖尿病,2型糖尿病患者中约50%伴高血压[6]。TIDE研究[4]结果表明,我国成人糖尿病患者中高血压患病率为45.2%,显著高于非糖尿病患者的29.8%;高血压患者中糖尿病患病率为17.4%,显著高于非高血压患者的10.1%。国内另一项包含21 435名18岁以上成人的研究[7]显示,正常糖代谢者高血压患病率为31.2%;糖尿病前期患者高血压患病率为44.5%,较正常糖代谢者高42.6%;糖尿病患者高血压患病率为60.3%,较正常糖代谢者高93.3%。前瞻性研究结果也表明,糖尿病和高血压互为危险因素,均使对方的患病风险增加1.5~2.0倍[6]。Framingham子代研究(Framingham Offspring Study)[8]对3 754人随访了7年,结果显示:基线血压正常者(2 461人)中,患有糖尿病者将来发生高血压的风险显著高于未患糖尿病者(OR=3.14, 95%CI: 2.17~4.54);在基线未患糖尿病的人群(3 361人)中,患有高血压者将来发生糖尿病的风险显著高于基线未患高血压者(OR=3.33,95%CI: 2.50~4.44)。Rancho Bernardo研究[9]结果显示,收缩压(systolic blood pressure, SBP)每增加10 mmHg可使糖尿病发生风险增加13%,舒张压(diastolic blood pressure, DBP)每增加5 mmHg可使糖尿病发生风险增加15%。
既往对糖尿病和高血压的因果关系认识不深。近年,基于英国生物样本库的大样本前瞻性队列,Sun等[10]采用孟德尔随机化分析(Mendelian randomization analysis)研究了2型糖尿病和高血压、SBP值、DBP值的双向因果关系,结果显示2型糖尿病可能引起高血压,而高血压不太可能导致2型糖尿病。
高血压还可诱发并加重糖尿病并发症[11-13],从而影响糖尿病患者的预后。日本观察性队列心血管预防证据(Evidence for Cardiovascular Prevention from Observational Cohorts in Japan, EPOCH-JAPAN)研究[14]结果显示,糖尿病合并高血压者无论男女,心血管死亡风险都高于糖尿病不合并高血压或高血压不合并糖尿病者。最近Böhm等[15]分析了替米沙坦单独及其联合雷米普利疗效的全球性试验(Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial, ONTARGET)和ACEI不耐受的心血管病患者应用替米沙坦的随机评价研究(Telmisartan Randomised AssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease, TRANSCEND)。这两项降压治疗领域著名研究的数据结果显示,治疗后糖尿病患者达到的血压值较非糖尿病患者约高10 mmHg;在任意SBP或DBP水平,糖尿病患者出现终点事件或终末期器官损害的比例都高于非糖尿病患者。这说明糖尿病合并高血压患者较非糖尿病高血压患者不仅血压更难控制,而且高血压的危害更大。
2 病理生理学
糖尿病易合并高血压的机制较为复杂,概括为以下几方面。
2.1 水钠潴留 人们很早就认识到糖尿病可诱发水钠潴留。近年,Kannenkeril等[16]采用23Na磁共振成像技术测定了2型糖尿病患者组织中钠含量,结果显示2型糖尿病患者肌肉和皮肤钠含量甚至超过没有糖尿病的高血压患者。水钠潴留的原因是多方面的,其中高血糖起着重要的作用。高血糖使细胞外液渗透压升高,从而引起细胞外液容量扩张。高糖还使肾近端小管SGLT2表达增加,并刺激胰岛素分泌,而胰岛素可提高肾近端小管的SGLT2水平,以上均使肾近端小管重吸收葡萄糖增加[17-18]。因为SGLT2对葡萄糖的重吸收和对钠的重吸收是偶联的,所以在葡萄糖重吸收增加的同时,钠的重吸收也增加。此外,RAAS过度激活、交感神经张力增加等也是引起肾脏重吸收钠增加的重要因素[18]。
2.2 RAS激活 研究结果显示,高血糖可引起肾素、血管紧张素转换酶(angiotensin converting enzyme, ACE)和血管紧张素Ⅱ的Ⅰ型受体(AT1)表达增加,从而使RAAS激活。RAAS激活引起的醛固酮增加可使容量扩张,血管紧张素Ⅱ生成增加和AT1受体表达增加使血管收缩,这些均使血压升高[18]。
2.3 胰岛素抵抗和高胰岛素血症 胰岛素抵抗是2型糖尿病的重要特点。胰岛素抵抗可使内皮细胞NO合成减少,还可使RAS系统和交感神经活性增加,从而使血压升高[18-20]。
糖尿病患者常存在高胰岛素血症,这可能是由胰岛素抵抗所诱发,也可能是使用胰岛素促泌剂或外源性胰岛素治疗所引起。高胰岛素血症可导致交感神经活性增加并刺激肾素分泌,还会引起肾小管对钠的重吸收增加,这些均可使血压升高[18-20]。
2.4 自主神经紊乱 糖尿病可引起交感神经活性增加,使血管收缩、血压升高。交感神经活性增加还能刺激肾素分泌,间接使血压升高[18-21]。
2.5 其他因素 糖尿病还可引起血管内皮细胞功能紊乱,使得内皮源性缩血管物质(如内皮素)产生增加,而内皮源性舒血管物质(如NO)产生减少,从而使血压升高[18-20]。此外,动脉粥样硬化、低度炎症、氧化应激等因素也与糖尿病易使血压升高有关[18-20]。有肾功能不全的患者,肾损伤亦是血压升高的重要因素。
3 糖尿病合并高血压的诊断标准与分级、分层
目前高血压的诊断标准尚不统一。中国高血压防治指南( 2018年修订版)[22]的诊断标准:在未使用抗高血压药物的情况下,非同日3次测量诊室血压,SBP≥140 mmHg和(或) DBP≥90 mmHg。目前,国际高血压学会(International Society of Hypertension,ISH)[23]、欧洲心脏病学学会/欧洲高血压学会(European Society of Cardiology/European Society of Hypertension, ESC/ESH)[24]和ADA[25]也采用这一标准,而ACC和AHA联合制订的成人高血压指南[26]则以血压≥130/80 mmHg作为高血压的诊断标准。
本共识采用中国高血压防治指南( 2018年修订版)[22]的诊断标准,即诊室测量SBP≥140 mmHg和(或)DBP≥90 mmHg。高血压诊断确定后应根据患者的血压水平,以及有无并发症进行分级和危险分层,其标准见表2。

表2 糖尿病患者高血压分级和危险分层
4 评 估
糖尿病患者每次就诊均应测量血压,建议血压升高的患者自测血压并记录。合并高血压的糖尿病患者应进行充分评估,以确定是否存在继发性高血压,有无靶器官损伤和并发症,并识别其他心血管危险因素。评估内容包括详细的病史询问、体格检查、实验室检查和辅助检查。实验室检查除糖代谢以外还应包括血常规、血脂、血电解质、肝功能、肾功能、血尿酸、尿常规、尿白蛋白/肌酐比值;辅助检查应包括心电图、腹部超声、颈动脉超声、四肢血管超声、眼底检查、踝肱比,有条件的还可行动态血压监测、动态心电图、超声心动图、脉搏波传导速度等检查。对于有胸闷等症状者建议行冠心病筛查,如冠状动脉CT造影等。疑有脑血管疾病者应及时行脑部CT或MRI检查。
24 h动态血压监测(ambulatory blood pressure monitoring, ABPM)不仅有助于全面评估血压的控制状况和短期血压变异(blood pressure variability),而且对识别隐匿性高血压(masked hypertension)和白大衣高血压(white coat hypertension)有重要意义。糖尿病患者的血压昼夜节律异于正常人,因此ABPM对糖尿病患者具有更重要的意义。ABPM的实施须规范化,有条件的情况下可在血压管理平台指导下实施并进行相应的数据分析。
正常人24 h血压谱表现为双峰一谷,双峰分别出现于早上6~10时和下午4~8时,一谷出现于夜间。早上的血压高峰也称为血压晨峰(morning blood pressure surge, MBPS),与心血管疾病风险相关[27]。亚洲家庭血压研究(Asia BP@Home Study)[28]显示,糖尿病患者的早晨血压高于非糖尿病患者,而早晨血压的达标率低于非糖尿病患者,提示糖尿病患者的MBPS可能较非糖尿病患者显著。Najafi等[29]的研究结果显示,MBPS与糖尿病神经病变相关。
ABPM可提供患者昼夜血压节律的信息,可用于评估患者的血压变异和并发症风险,并有助于指导临床用药。正常人夜间血压一般较日间血压低10%~20%,这种血压类型称为杓型(dipping)血压。如果夜间血压较日间血压下降不足10%,称为非杓型(non-dipping)血压。如果夜间血压较日间血压下降超过20%,称为超杓型(extreme dipping)血压。如果夜间血压超过日间血压,称为反杓型(reverse dipping)血压。Gunawan等[30]的研究结果显示,35.7%的糖尿病患者表现为杓型血压,46.4%表现为非杓型血压,8.9%表现为反杓型血压,8.9%表现为超杓型血压,57.0%存在夜间高血压(nocturnal hypertension)。Najafi等[29]的研究结果显示,只有17.2%的2型糖尿病患者呈杓型血压,54.2%呈非杓型血压,28.6%呈超杓型血压,且非杓型血压与心血管疾病、糖尿病视网膜病变和糖尿病神经病变相关。国内的研究[31]结果显示,2型糖尿病合并高血压的患者约半数表现为非杓型血压,显著高于非糖尿病患者(51.32% 比 24.33%),且非杓型血压的糖尿病患者较杓型血压的患者更易出现左心室肥厚和颈动脉斑块。
5 血压控制目标
目前对合并高血压的糖尿病患者的血压控制目标尚有争议。大量的随机对照临床研究结果显示,将伴高血压的糖尿病患者血压控制在140/90 mmHg以下不仅可降低大血管并发症发生风险,也能降低微血管并发症发生风险。将血压进一步控制<130/80 mmHg甚至<120/80 mmHg能否进一步获益,目前对此尚不清楚。
英国前瞻性糖尿病研究(United Kingdom Prospective Diabetes Study, UKPDS)探讨了血压对糖尿病患者预后的影响。UKPDS 36研究[32]显示,2型糖尿病患者并发症风险随SBP的上升而增加,且无阈值(即使SBP<120 mmHg),两者呈线性关系而非J型或U型曲线。与该研究同时期进行的高血压最佳治疗(hypertension optimal treatment, HOT)研究[33]的糖尿病亚组分析显示,DBP≤85 mmHg组心血管死亡风险为DBP≤80 mmHg组的3倍。大样本流行病学研究[34]结果显示,血压在115/75 mmHg以上时血压水平与死亡风险呈正相关。糖尿病和心血管病行动:培哚普利吲达帕胺(百普乐)与格列齐特(达美康)评价(action in diabetes and vascular disease:preterax and diamicron modified release controlled evaluation, ADVANCE)研究[35]发现,强化降压组和常规降压组最终血压相差5.6/2.2 mmHg,强化降压使大血管和微血管复合终点风险下降9%(P=0.04),心血管死亡风险降低18%(P=0.03),全因死亡风险降低14%(P=0.03)。基于这些研究结果,2013年以前ADA推荐糖尿病患者的血压控制目标为<130/80 mmHg。
2010年,糖尿病心血管风险控制行动的降压分支(action to control cardiovascular risk in diabets blood pressure trial, ACCORD-BP)研究[36]结果显示,强化降压组(平均SBP 119.3 mmHg)相比常规降压组(平均SBP 133.5 mmHg)虽卒中风险下降41%(年发生率0.32% 比0.53%,P=0.01),但主要心血管不良事件(major adverse cardiovascular events, MACE)风险没有降低(年发生率1.87%比2.09%,P=0.20),且严重不良反应发生率显著增加(3.3%比1.3%,P<0.001)。ACCORD-BP的结果使得ADA在2013年及以后放宽了对血压的控制要求:2013年和2014年推荐的目标为<140/80 mmHg,2015—2018年推荐的目标为<140/90 mmHg,2019年和2020年推荐低危患者的目标为<140/90 mmHg。
2015年,收缩压干预试验(systolic blood pressure intervention trial, SPRINT)的结果发布。SPRINT研究[37]结果显示,强化降压组(平均SBP 121.4 mmHg)较常规降压组(平均SBP 136.2 mmHg)MACE风险下降25%(P<0.001),全因死亡风险下降27%(P=0.003)。SPRINT研究虽没有入选糖尿病患者,但其结果对糖尿病患者的血压管理有借鉴意义,使得ACC和AHA制订的2017版高血压指南[26]将包括糖尿病患者在内的成人高血压患者血压控制目标定为<130/80 mmHg。最近ISH制订的2020版全球高血压实践指南[23]也推荐糖尿病患者血压控制目标为<130/80 mmHg。ESC和欧洲糖尿病研究会(European Association for the Study of Diabetes, EASD)联合制订的2019版糖尿病、糖尿病前期和心血管疾病指南[38]建议,在患者能耐受的情况下合并高血压的成人糖尿病患者血压应控制至<130/80 mmHg;≥65岁的患者在能耐受的情况下SBP控制为130~140 mmHg。
目前公认,严格的血压控制(SBP<130 mmHg甚至<120 mmHg)可以降低卒中发生风险,但能否带来MACE风险的降低尚有争议,而且过于严格的血压控制会增加不良反应的发生风险并产生更高的治疗费用。因此,需要权衡降压治疗的获益、风险和费效比。由于我国糖尿病患者卒中的危害超过缺血性心脏病,因此从理论上说我国糖尿病患者的血压目标值较欧美国家略低一些。目前国内正在进行的中国成人2型糖尿病降压治疗目标(blood pressure control target in diabetes, BPROAD)研究将为确立中国成人2型糖尿病患者血压控制目标提供循证医学证据。本共识认为,在BPROAD研究结果问世之前,将中国成人糖尿病患者血压控制目标定为<130/80 mmHg是合理的,兼顾了降压治疗的获益、风险和费效比。当然,血压控制目标应个体化。老年患者或血压不易控制的患者,可将控制目标放宽到<140/90 mmHg。
Böhm等[15]对ONTARGET研究和TRANSCEND研究数据的再分析显示SBP<120 mmHg的糖尿病患者出现心血管不良结局的风险高于SBP为120~140 mmHg的糖尿病患者,DBP<70 mmHg的糖尿病患者出现心血管不良结局的风险高于DBP为70~80 mmHg的糖尿病患者,原因可能是过低的血压影响了心脏和脑的血供,这提示对于有心血管危险因素的糖尿病患者来说血压不宜<120/70 mmHg,但以上研究仅为随机对照研究的事后分析结果,尚待进一步验证。
最近Ilkun等[39]对ACCORD-BP的数据进行了再分析,结果显示常规降糖组强化血压控制可降低复合心血管终点事件的发生风险,但强化降糖组强化血压控制则不能降低复合心血管终点事件的发生风险,提示降糖和降压之间存在相互作用,强化血糖控制的患者可能不适合过于严格的血压控制。不过,这一结果有待进一步的研究予以证实。
6 达标策略
6.1 生活方式干预 生活方式干预不仅有降压的作用,还能改善血糖、体重和血脂等心血管危险因素,并降低心血管事件的发生风险。糖尿病患者的血压>120/80 mmHg即应开始生活方式干预,以预防高血压的发生,已有高血压的患者生活方式干预应贯穿于治疗的始终。生活方式干预措施如下。
6.1.1 合理膳食 在控制总热量的基础上,建议适当增加水果、蔬菜、低脂奶制品、全谷类、植物来源蛋白质的摄入,减少饱和脂肪酸和胆固醇摄入。条件许可的情况下可采用阻止高血压膳食模式(dietary approaches to stop hypertension,DASH),此种膳食模式富含新鲜水果、蔬菜、低脂或脱脂乳制品,包含适量的全谷类、鱼肉、禽肉、豆制品和坚果,少糖、少盐、少饱和脂肪、少红肉,其饱和脂肪酸、胆固醇和糖的含量低,但富含优质蛋白质、纤维素和钾、镁、钙等微量元素。健康膳食约可使SBP降低11 mmHg[40]。
6.1.2 控制钠的摄入 限钠可降低血压,每日钠摄入量减少1.0 g可使SBP下降6 mmHg[40]。建议患者食盐摄入量应<6.0 g/d(或每日钠摄入量<2.4 g)。主要措施:减少烹饪用盐(在烹调时尽可能使用定量盐勺),少用高钠调味品(如味精、酱油等),少食高钠加工食品(如咸菜、腌制品等)。
6.1.3 增加钾、钙、镁的摄入 每日钾摄入量达到3 700 mg可使SBP下降3~13 mmHg,DBP下降0~9 mmHg[40]。因此,鼓励患者多食富钾食物,如新鲜蔬菜、水果和豆类,肾功能良好者可以低钠富钾食盐代替普通食盐。肾功能不全者不宜使用低钠富钾食盐,以免诱发高钾血症。
建议有条件的患者可适当补充钙和镁。每日补钙1 000~1 500 mg可使SBP下降3.0 mmHg,DBP下降2.5 mmHg[40];每日补镁240~1 000 mg可使SBP下降1.0~5.6 mmHg,DBP下降1.0~2.8 mmHg[40]。
6.1.4 增加膳食纤维的摄入 WHO建议成人每日摄入膳食纤维25~35 g,但目前我国成人的每日摄入量仅为13 g左右。研究结果显示,补充膳食纤维有助于降低血压,减少心血管疾病发生风险。
6.1.5 控制体重 建议所有超重和肥胖的患者减重,措施包括控制能量摄入、优化膳食结构(少食高脂、高糖食物或饮料)、增加体力活动、减少静坐时间、优先使用有减重作用的降糖药物,体重难以控制的重度肥胖患者可考虑接受代谢手术。
6.1.6 增加运动 运动不仅有一定的降压作用,还有助于控制血糖、减肥,并降低心血管疾病发生风险。建议患者除日常生活的活动外,每周参加5次以上中等强度运动,每次时间不短于30 min。每周150 min的有氧运动可使SBP降低8 mmHg[40]。运动时要注意防范运动损伤和低血糖。
6.1.7 戒烟 吸烟是心血管病和癌症的重要危险因素,合并高血压的糖尿病患者如果吸烟则应戒烟,并避免被动吸烟。
6.1.8 限酒 限酒有助于控制血压。ACCORD研究[41]显示,糖尿病患者轻度饮酒与高血压无相关性,但中度和重度饮酒与高血压相关。建议患者戒酒,如不能戒酒则应控制饮酒量并选择低度酒。男性每日乙醇摄入量不超过25 g,每周不超过140 g;女性每日乙醇摄入量不超过15 g,每周不超过80 g。
6.1.9 保持心理平衡,避免精神紧张、焦虑 精神紧张可通过激活交感神经系统而升高血压。精神紧张的主要原因包括生活、学习和工作压力。病态心理(如抑郁、焦虑等)亦可引起精神紧张。临床医师应与患者充分交流,如患者精神紧张,可对其进行心理疏导,必要时可建议患者至心理门诊进行心理治疗。
6.2 抗高血压药物的使用 研究[42]结果显示,当糖尿病患者的SBP>140 mmHg时,抗高血压药治疗可以降低全因死亡、心血管死亡、心肌梗死、心力衰竭(简称心衰)和卒中风险;当SBP<140 mmHg时,给予抗高血压药治疗反而使心血管死亡风险增加。因此,本共识建议当糖尿病患者的血压≥140/90 mmHg时给予抗高血压药治疗。如果患者的血压<160/100 mmHg,可从单药起始治疗;如果血压≥160/100 mmHg,建议予两种药物联合(二联)起始治疗以尽快控制血压。老年患者起始药物治疗的血压阈值可适当放宽,65~79岁老人血压≥150/90 mmHg时启动抗高血压药物治疗,80岁以上老人血压≥160/90 mmHg时启动抗高血压药物治疗。
目前临床常用的口服抗高血压药有以下几类:ACEI,ARB,二氢吡啶类CCB,非二氢吡啶类CCB,噻嗪类利尿剂,袢利尿剂,醛固酮受体拮抗剂,其他保钾利尿剂,α受体阻滞剂,β受体阻滞剂,α、β受体阻滞剂,中枢抗高血压药,直接血管扩张药,肾素抑制剂,神经节阻断药,去甲肾上腺素耗竭药。神经节阻断药(如美加明)和去甲肾上腺素耗竭药(如利血平、胍乙啶)因不良反应较大,已较少使用。目前临床上使用较多的是ACEI、ARB、二氢吡啶类CCB、噻嗪类利尿剂和β受体阻滞剂这5类抗高血压药。临床医师应熟悉抗高血压药物的使用方法及其不良反应。见表3。

表3 常用口服抗高血压药物的不良反应
抗高血压药物的选择应综合考虑患者临床特点、药物疗效、药物的药代动力学特点、不良反应、靶器官保护、对代谢的影响、依从性、药物经济学、药物可及性等因素。研究[42]结果显示,ACEI、ARB、二氢吡啶类CCB、噻嗪类利尿剂和β受体阻滞剂这5大类药物均可改善高血压患者的预后,其在降低全因死亡与心血管事件方面的作用并无差异。
但是,β受体阻滞剂对代谢有不利影响,且其可掩盖低血糖症状并削弱机体对低血糖的应答能力。因此,本共识建议ACEI、 ARB、 二氢吡啶类CCB和噻嗪类利尿剂为合并高血压的糖尿病患者的一线抗高血压药。考虑到ACEI和ARB对糖代谢有一定的益处(利尿剂对糖代谢有不良影响,二氢吡啶类CCB对糖代谢的影响是中性的),本共识建议合并高血压的糖尿病患者在单药治疗时优先选择ACEI或ARB,其次选择二氢吡啶类CCB或噻嗪类利尿剂。ACEI和ARB除降血压外还有肾保护作用,本共识建议伴白蛋白尿的糖尿病合并高血压患者应选择ACEI或ARB作为抗高血压药,不能耐受ACEI或ARB,或有ACEI或ARB禁忌证者可选择二氢吡啶类CCB或噻嗪类利尿剂。
合并症是选择抗高血压药的重要因素。合并慢性心衰的患者特别适合使用利尿剂治疗。ACEI、ARB和β受体阻滞剂对慢性心衰也有一定的治疗作用。噻嗪类利尿剂有使血尿酸升高的作用,合并高尿酸血症的患者不建议以噻嗪类利尿剂单药起始治疗(除非合并心衰)。合并房室传导阻滞、心动过缓、严重气道疾病和低血糖高危患者均不建议予β受体阻滞剂治疗。
一般来说,长效制剂对血压的控制更平稳,因此目前多选用长效抗高血压药。ABPM有助于指导临床给药。如ABPM显示存在夜间高血压,可考虑睡前给药。
如经单药治疗,患者血压不达标,应及时启动二联治疗。如果患者起始血压≥160/100 mmHg,可以直接启动二联治疗。二联治疗的药物选用原则是两种抗高血压药物的作用机制具有互补性,两者具有叠加的降压作用,并可互相抵消或减轻不良反应。如果选择ACEI或ARB起始,可考虑联合二氢吡啶类CCB或噻嗪类利尿剂。常见的二联治疗方案有ACEI或ARB +二氢吡啶类CCB、ACEI或ARB+噻嗪类利尿剂、二氢吡啶类CCB +噻嗪类利尿剂,不建议ACEI和ARB联合治疗。二联治疗可以是两个单药联合,也可以是单片复方制剂。目前有多种单片复方制剂,如ACEI+噻嗪类利尿剂、ARB+噻嗪类利尿剂、ACEI+二氢吡啶类CCB、ARB+二氢吡啶类CCB等。单片复方制剂可提高患者的依从性,在疗效和安全性方面优于两个单药的非复方联合。
糖尿病患者的血压不易控制,尤其是在合并肾功能不全时。如经二联治疗血压不达标可考虑增加一种机制不同的抗高血压药,形成三联治疗。最常见的三联治疗方案为ACEI或ARB+二氢吡啶类CCB+噻嗪类利尿剂。部分患者使用3种或3种以上包括噻嗪类利尿剂在内,且剂量足够(达到最大剂量或最大耐受剂量)的抗高血压药治疗至少4周血压仍未达标,称为药物抵抗性高血压(resistant hypertension)[43],应分析其原因(如是否存在继发性高血压、是否未规范用药等)。经三联治疗血压未达标的患者可联合其他抗高血压药(包括α受体阻滞剂,α、β受体阻滞剂,醛固酮受体拮抗剂,中枢抗高血压药,直接血管扩张药),形成四联治疗。常用的α受体阻滞剂有多沙唑嗪、特拉唑嗪等,尤其适用于伴前列腺增生的患者,对药物抵抗性高血压也有较好的效果。曾有研究结果显示,多沙唑嗪增加心血管事件风险,但随后的大样本研究[44]结果显示多沙唑嗪只在中、重度心肌缺血的患者中增加心血管事件,轻度和无心肌缺血者使用并无增加心血管事件之虞。α受体阻滞剂可引起体位性低血压、阴茎异常勃起,使用中应注意测量坐、立位血压,睡前给药可降低体位性低血压的发生。控释剂型的α受体阻滞剂较普通剂型不良反应少,且血压控制更平稳,如使用α受体阻滞剂建议选择控释剂型[22]。醛固酮受体拮抗剂对药物抵抗性高血压也有较好疗效,但有引起高钾血症(尤其是肾功能减退的患者)和男性乳房发育的不良反应。
无论是单药、二联、三联还是四联治疗,均需密切观察药物的不良反应。如果出现药物不良反应,应停药并换用其他抗高血压药。不良反应较严重的患者,应给予相应处理。血压达到目标值且未出现药物不良反应者,应维持原治疗方案。
经四联治疗仍未达标者应及时转诊给血压管理专家。少数患者使用5种或5种以上包括噻嗪类利尿剂和醛固酮受体拮抗剂在内,且剂量足够(达到最大剂量或最大耐受剂量)的抗高血压药治疗至少4周血压仍未达标,称为难治性高血压(refractory hypertension)[43],可能与交感神经系统过度激活、体液潴留等因素有关,必要时可行肾去神经术(renal denervation)。
值得注意的是,近年问世的一些降糖药物如SGLT2抑制剂具有良好的降压作用,尤其是对盐敏感的高血压患者。对于血压控制不佳的糖尿病合并高血压患者,在没有禁忌证的情况下可考虑使用。
兹将成人糖尿病患者血压管理路径总结于图1。
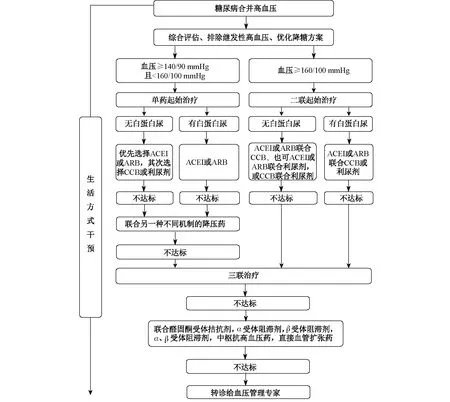
CCB特指二氢吡啶类CCB,利尿剂特指噻嗪类利尿剂。无论是单药、二联、三联还是四联治疗,血压达到目标值且未出现药物不良反应者, 应维持原治疗方案。图1 成人糖尿病患者血压管理路径
7 其他心血管危险因素的管理
7.1 血糖的管理 高血糖可诱发水钠潴留,不利于血压的控制。因此,合并高血压的糖尿病患者应重视血糖的管理。优化降糖方案有助于血压管理。一些传统的降糖药(如噻唑烷二酮类、胰岛素等)有不同程度的致水钠潴留效应。对于血压较难控制的糖尿病患者,在不影响血糖控制的情况下可考虑将这些降糖药替换为不引起水钠潴留的降糖药。
近年研究[45]结果显示,新型降糖药物SGLT2抑制剂有良好的促进水钠排泄的作用,在降糖的同时兼有降压的作用。目前在国内上市的SGLT2抑制剂有达格列净、恩格列净和卡格列净。恩格列净可使血压下降3.94/1.56 mmHg;卡格列净可使血压下降3.93/1.39 mmHg;达格列净可使血压下降2.70/0.70 mmHg[45]。
另一类降糖药GLP-1RA也具有降压作用[45]。GLP-1RA的降压作用弱于SGLT2抑制剂且只能降低SBP,艾塞那肽、利司那肽、利拉鲁肽、度拉糖肽和思美格鲁肽分别可使SBP降低1.57、0.80、1.20、1.70和2.60 mmHg[45]。
本共识推荐,合并高血压的糖尿病患者在无禁忌证的情况下降糖方案中宜包含SGLT2抑制剂,尤其在血压控制不佳时。如不能使用SGLT2抑制剂,在有适应证的情况下可考虑使用GLP-1RA。
低血糖可引起交感神经兴奋,不利于血压的控制,且有诱发心血管事件之虞。合并高血压的糖尿病患者应加强低血糖的预防,如发生低血糖应立即处理。
7.2 调脂治疗 血脂管理具有重要意义。合并心血管疾病的糖尿病患者建议予他汀类药物,使LDL-C<1.8 mmol/L,不合并心血管疾病的糖尿病患者LDL-C目标值为<2.6 mmol/L。在他汀类药物治疗前若TG>5.6 mmol/L,可给予降TG药物(如苯氧酸类降脂药或高纯度鱼油),以降低急性胰腺炎的发生风险。
7.3 抗血小板 小剂量阿司匹林(75~150 mg/d)可用于合并心血管疾病的糖尿病患者的二级预防。对于心血管风险为高危或极高危的糖尿病患者,应充分权衡阿司匹林治疗的心血管获益与出血风险。良好的血压控制有助于减少阿司匹林诱发的脑出血。
8 小 结
糖尿病合并高血压患者的血压控制目标与达标策略应个体化,在对患者全面评估的基础上根据患者靶器官损害、合并疾病等因素确定控制目标与治疗方案。本共识建议一般成人糖尿病患者血压控制目标为<130/80 mmHg,老年患者或血压不易控制的患者可放宽至<140/90 mmHg。生活方式干预是糖尿病患者血压管理的基础,应贯穿于治疗的始终。糖尿病患者的血压≥140/90 mmHg,且<160/100 mmHg时可单药起始治疗;如果血压≥160/100 mmHg可二联起始治疗。ACEI、ARB、二氢吡啶类CCB和噻嗪类利尿剂为糖尿病患者的一线抗高血压药;伴白蛋白尿者的降压治疗应选择ACEI或ARB,有ACEI或ARB禁忌证,或不能耐受ACEI或ARB者可选择二氢吡啶类CCB或噻嗪类利尿剂;不伴白蛋白尿者降压治疗首选ACEI或ARB,次选二氢吡啶类CCB和噻嗪类利尿剂。单药治疗不达标的患者应及时启动联合治疗。合并高血压的糖尿病患者应管理好高血糖、高血脂等心血管疾病危险因素。良好的血糖控制有益于血压的管理,应优化降糖治疗方案,在无禁忌证的情况下降糖方案中宜包含SGLT2抑制剂,不能使用SGLT2抑制剂者在有适应证的情况下可考虑使用GLP-1RA。
参与讨论专家名单(按姓氏笔画排序):王卫庆(上海交通大学医学院附属瑞金医院内分泌代谢科)、王继光(上海交通大学医学院附属瑞金医院高血压科)、王遂军(上海市杨浦区市东医院内分泌科)、石勇铨(上海长征医院内分泌科)、包玉倩(上海交通大学附属第六人民医院内分泌代谢科)、曲伸(同济大学附属第十人民医院内分泌科)、刘伟(上海交通大学医学院附属仁济医院内分泌科)、刘志文(上海市徐汇区中心医院内分泌科)、刘连勇(上海市浦东新区浦南医院内分泌科)、刘建民(上海交通大学医学院附属瑞金医院内分泌代谢科)、孙皎(复旦大学附属华东医院内分泌科)、苏青(上海交通大学医学院附属新华医院内分泌科)、李小英(复旦大学附属中山医院内分泌科)、李晓永(上海交通大学医学院附属新华医院内分泌科)、李晓华(上海市第七人民医院内分泌科)、李益明(复旦大学附属华山医院内分泌科)、杨架林(上海市闵行区中心医院内分泌科)、张进安(上海健康医学院附属周浦医院内分泌科)、张克勤(同济大学附属同济医院内分泌科)、陆颖理(上海交通大学医学院附属第九人民医院内分泌代谢科)、陈月(上海市宝山区中西医结合医院内分泌与代谢中心)、季黎明(上海市静安区市北医院内分泌代谢科)、周健(上海交通大学附属第六人民医院内分泌代谢科)、周尊海(同济大学附属杨浦医院内分泌科)、钮忆欣(上海交通大学医学院附属新华医院内分泌科)、洪洁(上海交通大学医学院附属瑞金医院内分泌代谢科)、秦利(上海交通大学医学院附属新华医院内分泌科)、顾明君(上海市浦东新区公利医院内分泌科)、徐瑜(上海交通大学医学院附属瑞金医院内分泌代谢科)、高秀芳(复旦大学附属华山医院心内科)、黄珊(上海交通大学医学院附属同仁医院内分泌科)、彭永德(上海交通大学附属第一人民医院内分泌代谢科)、鲁瑾(上海长海医院内分泌科)、雷涛(上海中医药大学附属普陀医院内分泌科)
