茶皂素杀螺活性及对3 种水生生物的安全性
2021-02-05麻程军侯有明汤宝珍
麻程军, 王 瑞, 刘 彬, 黄 斌, 侯有明, 汤宝珍*,
(1. 福建农林大学 闽台作物有害生物生态防控国家重点实验室,福州 350002;2. 福建农林大学 植物保护学院,福建省昆虫生态重点实验室,福州 350002)
福寿螺 Pomacea canaliculata 原产于南美洲亚马逊河流域,是一种严重危害水稻和其他水生植物的软体动物,已被世界自然保护联盟(International Union for Conservation of Nature,IUCN) 列入全球100 种最具破坏性的外来入侵物种,自1980 年进入中国后逐渐为害成灾[1-2]。福寿螺取食可导致水稻幼苗死亡,显著降低水稻产量[3]。Nghiem 等 2013 年应用 Monte-Carlo 模型统计发现,全球每年因福寿螺为害水稻造成的经济损失高达14.7 亿美元[4]。此外,福寿螺还是广州管圆线虫 Angiostrongylus cantonensis 的中间寄主,该线虫可引发人体嗜酸性脑膜炎,而福寿螺的扩散速度和暴发范围直接影响该病的发病强度[5]。因此,有效防控福寿螺显得尤为重要。目前比较有效的手段主要有生物防治、物理防治和化学防治。生物防治主要利用放鸭捕食小螺、幼螺,但鸭群本身也会对水稻秧苗造成危害。物理防治常以人工采螺为主,效率低且效果差[6]。化学防治主要采用杀螺胺乙醇胺盐 (niclosamide ethanolamine)、四聚乙醛 (metaldehyde) 等药剂,虽然效果良好,但存在为害非靶标生物[7-8]、农药残留[9]及抗药性[10]等问题。因此,寻找合适的、对环境友好的杀螺剂迫在眉睫。
植物源农药是利用植物次生代谢产生的化学物质作为杀虫、杀菌及除草等用途的农用化学品,具有生物活性高、选择性强以及对非靶标生物安全等优势[11],同时还具有低残留、易降解、不易引起抗药性等有机合成农药无法比拟的特点[12-13]。研究表明,植物源杀螺剂如昆诺阿藜 Chenopodium quinoa Willd 皂苷[14-15]、油茶 Camellia oleifera Abel籽饼[16]等因具备对环境友好等特性,具有开发成为绿色农药的潜力[17]。
茶皂素 (tea saponin) 是山茶科 (Theaceae) 山茶属 (Camellia L.) 植物中皂素的统称,广泛存在于各种茶类植物的根、茎、叶、花和果实中。日本学者青山新次郎于1931 年首次从茶树种子中分离出茶皂素,并发现其为一类齐墩果烷型三萜类皂苷混合物[18]。茶皂素含量高,且提取成本低,茶树根中的茶皂素含量可达14.83%,茶籽壳中为8.16%[19],茶籽饼中约为12%[20]。茶皂素是一种性能优良的天然非离子型表面活性剂,具有良好的抗氧化、镇痛、抗炎、降血压、保护心肌等药理功能[21],此外还可用于洗涤、去污、发泡和乳化等领域[22]。
早在1998 年,王小艺等[23]就测定了茶皂素对福寿螺的活性。结果表明,采用有效成分质量浓度为2.5 mg/L 的茶皂素处理福寿螺幼螺,3 d 后死亡率可达100%,同时其对成螺虽然也有一定的抑制作用,但防治效果较差,低浓度下对个体大的成螺基本无效。王志高等[24]分别在室内和大田环境下研究了生石灰、碳酸氢铵、茶麸和25%茶皂素4 种物质对福寿螺的防治效果,发现茶皂素、茶麸和生石灰对稻田福寿螺均有很好的防治作用。贤振华等[25]分别用LC25和LC50剂量的茶皂素进行处理,发现其对福寿螺螺苗 (个体质量约0.15 g)、仔螺 (约 1.0 g) 及中螺 (约 4.0 g) 的生长均有一定的抑制作用,其作用效果受茶皂素浓度及福寿螺发育阶段影响。
尽管已有相关研究表明茶皂素对福寿螺具有良好的毒杀效果,但尚缺乏利用茶皂素在田间防治福寿螺的较为系统的研究,也尚未见有关茶皂素环境安全性评价的研究报道。鉴于此,笔者全面测定了茶皂素对福寿螺的室内活性、评价了其对3 种水生生物的安全性,并在此基础上进行了田间药效试验,旨在为合理利用茶皂素防控福寿螺提供依据。
1 材料与方法
1.1 供试药剂及主要仪器
60%茶皂素 (tea saponin) 原粉,福建省南平市顺昌县老知青集团提供;6% 四聚乙醛颗粒剂(metaldehyde 60 GR),广东农密生物科技有限公司生产;50%杀螺胺乙醇胺盐可湿性粉剂 (niclosamide ethanolamine 500 WP),上海沪联生物药业股份有限公司生产。TU-1900 双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司。
1.2 供试生物
福寿螺 P. canaliculate,采自福建农林大学金山校区教学实习用水稻田。试验前在与试验相同环境下驯养7 d,驯养期间每天喂食甘蓝叶1 次,投喂量以2 h 内吃完为准。于试验开始前24 h 停止喂食,及时清除粪便及食物残渣。整个试验期间不喂食,控制室温为 27 ℃,每日光照12~16 h。试验用水为光照去氯处理 24 h 以上的自来水。
斑马鱼 Barchydonio rerio,购自福州市海洋之星水族馆,体长 (2.0 ± 1.0) cm、质量 (0.3 ± 0.1) g,健壮无病,大小一致。试验前在与试验相同环境下驯养7 d,驯养期间每天喂食鱼食1~2 次,投喂量以5 min 内吃完为准。于试验开始前24 h 停止喂食,及时清除粪便及食物残渣。整个试验期间不喂食,水温控制在21~25 ℃,每日光照12~16 h。试验用水为曝气处理24 h 以上的自来水,硬度60 mg/L (以 CaCO3计),pH 值在 6.0~8.5 之间,溶解氧高于空气饱和值的60%。
大型溞 Daphnia magna,购自中国科学院水生生物研究所,保持良好的培养条件,使其保持孤雌生殖状态。选用来源于同一母系、室内条件下培养3 代以上、出生24 h 内的健康非头胎溞供试。以室内培养的羊角月牙藻每天喂食1 次,水温控制在18~22 ℃,每日光照12~16 h。溞的培养、驯化及试验均采用国际标准化组织 (International Organization for Standardization,ISO) 标准稀释水、Elendt M4 培养液及Elendt M7 培养液,试验期间水质稳定,pH 值为6.0~9.0,溶解氧≥ 3.0 mg/L,水的硬度 (以 CaCO3计) 为 140~250 mg/L。
羊角月牙藻 Selenastrum capricornutum,购自中国科学院水生生物研究所。按无菌操作法将试验用藻接种到装有培养基的锥形瓶内,置于人工培养箱中培养,每天定时摇动3 次,每隔96 h 接种1 次,反复接种2~3 次使藻基本达到同步生长阶段后供试。每次接种时在显微镜下检查藻种的生长情况。试验环境温度为20~24 ℃,连续均匀光照,照度为4 440~8 880 lx。
1.3 茶皂素对福寿螺的室内活性测定
本研究中根据壳高 (H) 将福寿螺划分为3 个等级:幼螺 (8 mm≤H<15 mm)、中螺 (15 mm≤H<25 mm) 和成螺 (25 mm≤H<40 mm)。按 1.15 倍等比配制有效成分质量浓度分别为2.00、2.30、2.65、3.04 和3.50 mg/L,体积为4.5 L 的茶皂素溶液,置于6 L 的塑料储物箱中。挑选生长良好、螺壳完整的成螺分别置于各浓度储物箱中进行处理,每箱15 头。中螺及幼螺组按1.12 倍等比配制有效成分质量浓度分别为1.99、2.22、2.49、2.79、3.13 和3.50 mg/L 的茶皂素溶液,其余均同成螺组。每浓度设3 个重复,并设清水对照。储物箱上加盖透气的塑料盖,保证透气的同时防止福寿螺逃逸。分别记录处理后48、72 及96 h 各组福寿螺的死亡率。福寿螺死亡标准:厣甲打开,螺肉翻出,且触碰后螺肉不收缩;或厣甲紧闭,用枪头轻触即可使螺肉内陷。
1.4 茶皂素对3 种水生生物的安全性评价
1.4.1 茶皂素对斑马鱼的毒性测定 前期测定结果 (见附加材料) 表明,对斑马鱼毒性试验期间茶皂素浓度均始终高于初始浓度的80%,因而采用静态法在96 h 内进行斑马鱼安全性评价试验。按1.04 倍等比配制有效成分质量浓度 (以下同) 分别为 1.95、1.88、1.80、1.73、1.67 和 1.60 mg/L,体积为6 L 的茶皂素溶液,置于10 L 的玻璃缸中。每浓度设3 个重复,并设清水对照,每个重复15 条鱼。记录茶皂素处理后96 h 斑马鱼的死亡率。根据《化学农药环境安全评价试验准则》第12 部分的规定[26],农药对鱼类的毒性等级划分以96 h 的致死中浓度 (96 h-LC50,mg/L) 值为标准:LC50≤0.1 为剧毒,0.1<LC50≤1.0 为高毒,1.0<LC50≤10 为中毒,LC50>10 为低毒。
1.4.2 茶皂素对大型溞的毒性测定 按1.15 倍等比配制28.00、24.35、21.17、18.41、16.01、12.11 和10.53 mg/L,体积为50 mL 的茶皂素溶液,置于100 mL 的烧杯中。每浓度设6 个重复,并设清水对照,每个重复5 只溞。于试验开始后48 h 观察并记录每个烧杯中溞活动受抑制数。大型溞活动受抑制标准为:轻微晃动容器,溞在15 s内不能游动,但允许其附肢微弱活动。根据《化学农药环境安全评价试验准则》第13 部分[27],农药对溞类的毒性等级划分以48 h 的半数抑制浓度(48 h-EC50,mg/L) 值为标准:EC50≤0.1 为剧毒,0.1<EC50≤1.0 为高毒,1.0<EC50≤10 为中毒,EC50>10 为低毒。
1.4.3 茶皂素对羊角月牙藻的毒性测定 根据《化学农药环境安全评价试验准则》第14 部分[28],设置茶皂素上限试验终浓度为有效成分100 mg/L。配制50 mL、200 mg/L 的茶皂素溶液,置于250 mL锥形瓶中,加入50 mL 羊角月牙藻,轻摇混匀。共6 个重复,并设清水对照。于处理后72 h 通过分光光度计测定羊角月牙藻的吸光度值。根据该准则规定,农药对藻类的毒性等级划分以72 h-EC50值 (mg/L) 为标准:EC50≤0.3 为高毒,0.3<EC50≤3.0 为中毒,EC50>3.0 为低毒。
1.5 茶皂素对福寿螺的田间药效试验
试验田位于中国福建省南平市邵武市洪墩镇水口寨村,在单季稻田水稻苗移栽后10 d (2019年6 月3 日至7 日) 进行。共设6 个处理 (均为有效成分用量):茶皂素2.03、2.25 和 2.48 kg/hm2,50% 杀螺胺乙醇胺盐WP 0.57 kg/hm2,6% 四聚乙醛GR 0.45 kg/hm2以及清水对照。每个小区面积为666.7 m2,每处理设3 个重复小区,随机区组排列。用药前围修田埂,加高田埂高度,防止水串流。采用Z 字形取样方法,分别调查施药前福寿螺活螺数和施药后2 d 及4 d 的死螺数和活螺数。死亡标准同1.3 节室内活性试验。
1.6 数据处理
采用Polo Plus version 2.0 软件计算茶皂素对福寿螺和3 种水生生物的LC50值、致死中浓度比率 (LCR50)、EC50值、卡方值和斜率。茶皂素和两种对照药剂 (杀螺胺乙醇胺盐和四聚乙醛) 对福寿螺的田间药效采用虫口减退率和校正防效进行评价,计算公式分别见式 (1) 和式 (2)。校正防效不同处理间的差异显著性采用IBM SPSS Statistics 21.0 平方根反正弦转换后再进行分析:不同处理间相同天数的校正防效差异采用方差分析,同一处理2 d 与4 d 之间的校正防效差异则采用独立样本t 检验分析,差异显著水平为 p < 0.05。
式中,P 为虫口减退率 (%);Nck为药前活螺数;Nt为药后活螺数;EC 为校正防效 (%);Pt为处理组虫口减退率;Pck为对照组虫口减退率。
2 结果与分析
2.1 茶皂素对福寿螺的室内活性
试验结果 (表1) 表明:茶皂素对福寿螺具有良好的室内活性,处理48 h 后即可对福寿螺产生毒杀作用,至96 h 死亡率趋于稳定;且其杀螺活性除受茶皂素浓度影响外还受福寿螺个体大小影响,其中,中螺对茶皂素最敏感。
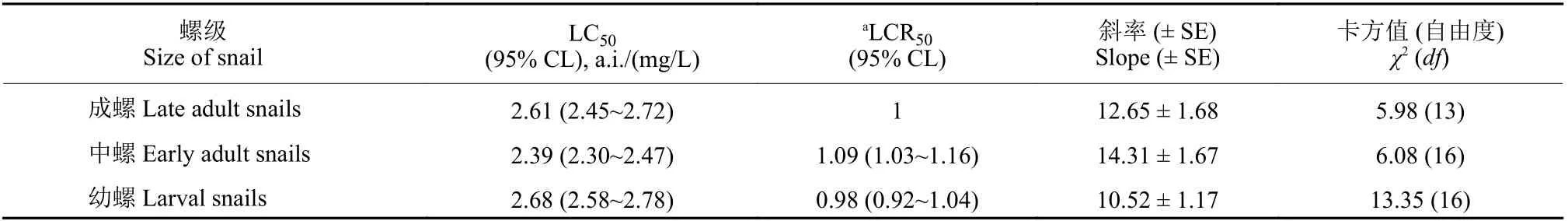
表1 茶皂素对福寿螺的96 h 室内活性Table 1 Molluscicidal activity of tea saponin after the treatment for 96 h against P. canaliculata in the lab
2.2 茶皂素对3 种水生生物的安全性
前期采用高效液相色谱法检测的结果证明,茶皂素在水中的实测浓度与理论浓度一致,故在评价茶皂素对3 种水生生物的安全性时皆用理论浓度替代 (附加材料中表3),并且整个试验期间茶皂素的最高及最低浓度均高于初始浓度的80% (附加材料中表4、表5 和表6)。同时在试验前还进行了仪器精密度及重复性等验证,结果表明仪器精密度和重复性均较好,符合要求 (附加材料中表 1 和表 2)。
根据农药对鱼类、溞类及藻类的毒性等级划分标准,茶皂素对斑马鱼为中等毒性、对大型溞为低毒 (表2),对羊角月牙藻为低毒 (表3)。并且有效成分质量浓度为100 mg/L 的茶皂素还可促进羊角月牙藻生长,与对照相比,茶皂素处理72 h后羊角月牙藻细胞密度增加了21%,且该结果具有良好的重复性 (表3)。

表2 茶皂素对斑马鱼和大型溞的急性毒性等级 (n = 3)Table 2 Toxicity of tea saponin against B. rerio and D. magna (n = 3)

表3 茶皂素对羊角月牙藻的72 h 急性毒性等级 (n = 6)Table 3 Toxicity of tea saponin to S. capricornutum after the treatment for 72 h (n = 6)
2.3 茶皂素对福寿螺的田间防效
由表4 可知,在有效成分 2.03~2.48 kg/hm2用量下,茶皂素施用后2 d 和4 d 对福寿螺的田间防效均在90% 以上,与 50% 杀螺胺乙醇胺盐WP 0.57 kg/hm2和 6% 四聚乙醛 GR 0.45 kg/hm2的防效相当,且3 种药剂处理后相同时间及同种药剂处理后不同时间的校正防效均无显著差异。

表4 不同药剂对福寿螺的田间防治效果Table 4 Field control efficacy of different pesticides against P. canaliculata
3 结论与讨论
茶皂素作为一种植物源农药,已被证明具有良好的杀螺效果。本研究室内杀螺活性试验也表明,茶皂素对福寿螺有良好的毒杀作用,且毒杀效果受福寿螺个体大小影响,其中对中螺杀螺活性最高。贤振华等发现,茶皂素的杀螺活性随着螺龄的增大而降低[25]。本研究结果与之有所不同。目前关于茶皂素对福寿螺作用方式的报道较少,现有文献表明,福寿螺体内含有大量消化酶,其中纤维素酶含量较为丰富,在离体条件下,低浓度茶皂素对内切β-1,4 葡聚糖酶具有激活作用,高浓度时则对其有一定的抑制作用,而对外切β-1,4 葡聚糖纤维二糖水解酶表现为激活作用[29]。据此推测,茶皂素对不同螺龄福寿螺的活性差异可能与福寿螺摄入水中茶皂素的量及其纤维素酶的活性有关。
对茶皂素进行安全性评价可为其合理使用提供科学指导。本研究结果表明,茶皂素对斑马鱼为中等毒性,这与朱全芬等[30]的研究结果一致。茶皂素对鱼的毒性作用主要是由于其对血红细胞的溶血作用所致,但是其对白细胞却无影响,所以茶皂素对鱼有毒,而对虾无毒。因此,在田间应用中,应严格控制稻田水的排放时间,待茶皂素彻底降解后再排水。相较于茶皂素,杀螺胺和杀螺胺乙醇胺盐对水生生物的安全性较差。修瑞琴等[31]的研究表明,杀螺胺对斑马鱼的96 h-LC50值为0.52 mg/L,对大型溞的48 h-EC50值为0.38 mg/L,其分别按照1996 年中国环保局关于鱼类毒性的分级标准对斑马鱼进行毒性等级划分,按照化学品毒性分级标准对大型溞进行毒性等级划分,认为杀螺胺对斑马鱼和大型溞均为剧毒。戴建荣等[32]的研究也表明,杀螺胺和杀螺胺乙醇胺盐对斑马鱼的毒性较高,96 h-LC50值分别为0.210 4 mg/L 和0.095 4 mg/L。四聚乙醛对水生生物则相对安全,俞丽玲等[33]研究发现,40%四聚乙醛悬浮剂高浓度 (125.5 mL/L) 处理下,鲫鱼、白鲢鱼、花鲢鱼和草鱼连续10 d 的死亡率均为0,但尚未见关于四聚乙醛对其他水生生物毒性的研究报道。本研究中,茶皂素虽然对羊角月牙藻和大型溞低毒,但对斑马鱼却表现为中等毒性。因此,后续应分析茶皂素的降解动态,明确其降解特性,全面评估其应用风险,以便进一步为田间应用茶皂素防控福寿螺提供依据。
田间试验结果表明,茶皂素对福寿螺的田间防效良好,在有效成分2.03、2.25 和2.48 kg/hm23 种剂量下,其防效无显著差异,因此,考虑到防治成本,推荐2.03 kg/hm2作为茶皂素防控福寿螺的田间使用剂量。Jia 等[34]研究发现,同样来源于油茶种子的4% 螺威 (皂素含量为4%) 在室内和田间条件下对钉螺 Oncomelania hupensis、亚历山大双脐螺 Biomphalaria alexandrina 和截形小泡螺Bulinus truncates 均有良好的毒杀效果,对日本鹌鹑 Coturnix japonica (7 d-LD50> 60 mg/kg) 和淡水虾 Macrobrachium nipponense (96 h-LC50= 6.28 mg/L)毒性较低,但对斑马鱼高毒 (96 h-LC50= 0.15 mg/L),这可能是由于4% 螺威的化学结构 (分子式为C50H82O24) 与茶皂素存在差异所致 (茶皂素为混合物,存在多种分子结构,分子式包括C58H90O26、C58H92O25、C59H92O26及 C60H94O27等[35])。
综上所述,茶皂素生物活性高,具有良好的杀螺效果,且选择性较强,对非靶标生物相对安全,因此具有较好的开发应用前景。有关其杀螺机理及对其他环境生物的安全性都还有待进一步深入研究。
