多学科综合诊疗在Erdheim-Chester病诊断中的实践:个案报道
2021-02-05钟定荣
王 蓓 杨 磊 钟定荣
(中日友好医院病理科, 北京 100029)
组织细胞增生性疾病包含了由单核巨噬细胞系统来源的一组复杂的疾病,其中Erdheim-Chester病(Erdheim-Chester disease, ECD)可以表现为多系统的受累,包括骨、皮肤、肺、垂体等[1]。近些年来发病率逐渐提高,这可能是对于ECD的认识逐渐提高的结果。当ECD首先表现在非骨组织的其他器官中,并具有与该部位更常见的其他疾病相类似的临床表现时,对于内科医生、影像医生和病理医生来说是一种诊断方面的挑战。
笔者现在报道1例以脑部和肺部病变为首发症状,在发病初期,患者临床表现、影像学和病理改变都不典型,而导致正确诊断延后的病例。随着多学科综合诊疗 (multiple disciplinary team, MDT)的推进,将所有临床资料充分整合之后,最终于发病近10个月后明确了ECD的诊断。
1 病例资料
女,42岁,因行走不稳,言语不清,2017年9月外院头颅磁共振成像(magnetic resonance imaging,MRI)示左侧枕叶软化灶;中脑、桥脑、延髓及双侧桥臂、小脑半球多发病灶;MRI增强扫描示中脑、桥脑及双侧小脑半球多发异常强化影(图1),同时胸部正侧位片示双肺纹理重,双肺多发斑片状密度增高影。外院行脑部肿瘤切除术,术后病理(图2A)提示未见正常小脑组织,代之以多量Rosenthal纤维形成,散在轻度增生的胶质细胞,血管周围可见淋巴细胞及少许泡沫样组织细胞血管浸润。病变不除外低级别胶质瘤或肿瘤旁取材。

图1 2017年9月 脑部MRIFig.1 MRI of the brain in September, 2017Softening lesion of the left occipital lobe; multiple lesions occurred in the midbrain, pons, medulla oblongata, bilateral pons and cerebellar hemispheres.MRI: magnetic resonance imaging.

图2 病理检查(HE染色)Fig.2 Results of pathology (HE Staining)A: Glial cells were mildly proliferous with lymphocytes and a few foamy histocytes infiltrating around the vessels (brain)(20×); B: Lung injury was mainly featured with destroyed alveoli, thickened alveoli septum and the deposition of fibers with the infiltration and aggregation of a large number of inflammatory cells and histocytes (lung) (20×); C: At high magnification, there were a large amount of clear foamy histocytes in the alveoli septum (lung) (40×); D: The skin mass showed a lot of foamy histocytes with scattered polynuclear Touton cells in the proliferating fibrous tissue (skin) (40×).
患者术后第2天开始出现发热,体温波动于37.5 ℃~39.0 ℃,伴有畏寒,发热无昼夜规律性。术后第5天出现气短,呼吸困难,伴咳嗽、少量白色黏痰,不易咳出。胸部电子计算机断层扫描(computed tomography, CT)示:双肺感染,双侧胸腔积液伴双下肺膨胀不全,心包少量积液。2017年10月复查胸部CT:双肺多发斑片状密度增高影,考虑肺炎;双肺肺气肿、肺大泡,以双肺上叶为著;心包积液双侧胸膜增厚,双侧胸腔少量积液。同时右侧颊面部出现一皮下包块,约1 cm×1 cm,活动性尚佳,质地中等。11月13日行气管镜检查,未发现支气管黏膜及管腔内明显异常。支气管黏膜肺活检病理切片见上皮样肉芽肿性炎,未见坏死。 PAS、抗酸染色、银染均未检及病原体。11月28日胸部CT(图3)提示双上肺肺癌,双肺癌性淋巴管炎。双侧胸膜转移。心脏略大,心包少许积液。T3骨质密度异常,肿瘤骨转移可能性大。11月29日CT引导下经皮肺穿刺,病理结果(图2B、C)提示肺泡结构消失,肺泡间隔明显增宽,纤维组织增生,较多具有丰富透明泡沫样胞质的组织细胞浸润、聚集,慢性炎细胞浸润,局灶肺泡上皮增生,特殊染色未见明确病原体。免疫组织化学结果:泡沫细胞KP-1(+)、CD163(+)、TTF-1(-)、CK7(-)、P40(-)、Ki67(MIB-1)(1%+)、CMV(-)、P53(-)、CEA(-)、CD138(-)、IgG(-)、IgG4(-)、CD14(-)、Fascin(+)、CD1a(-) 。 特殊染色结果:PAS(-)、抗酸染色(-)、银染(-)、D-PAS(-)、Masson三色(纤维组织增生)、黏液卡红(-)、AB-PAS(-)。12月11日胸部高分辨率CT(high resolution CT, HRCT):双肺弥漫性间质受累性疾病,考虑为①癌性淋巴管炎;②Rosai-Dorfman病。

图3 2017年11月28日 胸部CTFig.3 Chest CT on November 28, 2017The imaging showed bilateral upper lung carcinoma with carcinomatous lymphangitis, bilateral pleural metastasis, increased heart shadow and pericardial effusion.CT: computed tomography.
诊疗期间先后使用头孢哌酮舒巴坦钠、头孢曲松钠、亚莫西沙星、去甲万古霉素 、亚胺培南西司他丁、更昔洛韦、伏立康唑等抗感染、抗病毒治疗;间断使用甲泼尼龙 、泼尼松等治疗,疗效欠佳,患者病情持续进展。
在患者诊疗过程中,笔者进行了多次MDT,每次均将现有各学科资料和患者的病情进行讨论和分析。临床抗感染及激素治疗反应均不理想,患者体温不能稳定降至正常,患者一般状况持续转差;影像学肺部病变进展快速,具有沿淋巴道分布等特征;病理医生借阅了外院脑部手术病理切片,反复对比肺部活检病理切片;经过MDT团队综合分析与比较,考虑ECD应该成为需要重点鉴别诊断的疾病。
笔者尽快进行了骨核素扫描;右侧颊面部肿物穿刺活检;肿瘤组织分子检测(BRAFV600E;NRAS外显子2、3、4;KRAS外显子2、3、4;PIK3CA突变基因检测)分析。全身骨显像(图4)提示:双侧骶髂、双侧坐骨、双侧股骨上端、双侧股骨下段局部骨代谢增强,考虑ECD可能。局部骨断层示:双侧股骨下段骨松质密度增高,不均匀骨代谢增强, 考虑ECD。

图4 骨扫描Fig.4 Radionuclide bone scanningRadionuclide bone scanning indicated that local bone metabolism is enhanced in bilateral sacroiliac, ischium, upper femur and lower femur. Erdheim-Chester disease (ECD) is considered.

图5 免疫组织化学染色结果Fig.5 Results of immunohistochemistry (20×)Histocytes showed diffuse positive expression of Kp-1, while negative expression of S-100.
右侧颊面部肿物病理(图2D、5)切片中发现增生纤维组织内见大量泡沫组织细胞、少量淋巴细胞及散在杜顿巨细胞浸润,病变符合ECD累及皮肤。免疫组织化学结果:CK(AE1/AE3)(-)、S100单克隆(-)、CD1a(-)、Ki67(MIB-1)(1%+)、KP-1(+)、PGM-1(+)、CD34(-)、α-SMA(-)。肿瘤组织中检测到BRAFV600E基因突变,未见NRAS外显子2、3、4;KRAS外显子2、3、4;PI3KCA基因突变。同时对ECD其他常见累及部位,如腹膜后、肾脏、眶后、心血管等部位进行逐一排查均未发现其他病灶。所以患者确诊为累及脑、肺及皮肤的ECD。
笔者调整为干扰素-α(interferon-α,IFN-α)及对症治疗,患者病情明显缓解,体温正常,肺部症状及影像学均明显改善,一般状况明显改善。
2 讨论
Erdheim-Chester病是一种罕见的非朗格汉斯组织细胞增生症。1930年由Jacob Erdheim和William Chester首先描述,目前文献中[2]报道的病例数大约为600~700例。研究[1,3-4]显示57%~75%ECD病例可以检测到BRAF基因V600E突变,在野生型BRAFV600E病例中10.9%出现了PI3KCA突变及3.7%出现了NRAS突变[3]。RAS-RAF-MEK-ERK通路的活化在ECD的发生、发展中具有重要作用,提示ECD可能是不同于黄色肉芽肿的一种带有明显炎性特征的髓系克隆性疾病[5-6]。同时该通路系统也可以成为潜在的治疗靶点。2016年世界卫生组织血液及淋巴组织疾病分类中将其归于组织细胞和树突状细胞肿瘤下一个临时的疾病种类[7-8]。
2.1 临床特点
ECD好发于40~70岁,患者平均年龄为55岁[1,9],男女比例约为5∶4。常累及骨、软组织、内脏、中枢神经系统等,导致骨硬化、纤维化及相关器官的衰竭[10-12]。按临床表现可以分为全身性和局部性,全身性症状有发热、衰弱和体质量减轻,最显著的局部性表现为下肢骨痛。ECD也可分为无症状或轻微症状与有症状的两种类型,其中前者主要分为皮肤受累为主及轻微或无症状骨累及型;有症状ECD患者可进一步划分为中枢神经系统受累为主[13]、心血管受累为主、眼眶颅面受累为主[14]、神经内分泌表现为主、腹膜后受累为主、肺受累为主和多系统受累等。本病例以神经系统症状为首发,逐渐出现了全身性症状及体征,皮肤及肺部累及的临床表现,导致诊断中具有很多迷惑性,极易出现误诊。
2.2 临床和影像学表现
本病例中主要涉及脑、肺、皮肤、骨的累及[15],在脑、肺及皮肤部位表现出相应的临床症状,骨骼系统内并没有临床症状,仅仅在影像学检查中有所发现,并且其临床及影像表现均没有特异性。25%~50% ECD患者可累及中枢神经系统[13],病变主要位于脑实质、脑膜和垂体中,其中以小脑最常见,椎管内病变主要累及脊髓和脊膜[16]。神经系统受累的最常见表现为尿崩症和进行性加重的小脑功能障碍。脑部MRI可能被误诊为脑转移瘤、脱髓鞘病变或脑白质病变。约50%的ECD患者累及肺[11],大部分并不出现临床症状,只有少数患者可能出现气促、胸闷、咳嗽、咯血或呼吸困难。主要的CT表现为小叶间隔增厚,毛玻璃样改变及小叶中心浑浊[17],常有胸膜增厚及胸腔积液,易被误诊为间质性肺疾病或转移性肿瘤。1/3的ECD患者出现皮肤的黄斑瘤,主要表现在眼睑,也可见于脸、颈、腋窝、躯干和腹股沟等处,表现为黄色或红棕色丘疹并融合为肿块。ECD患者普遍存在长骨侵犯,但出现骨痛症状的病患仅占50%左右[18]。通过X线平片、核素骨扫描、CT检查都能发现长骨、中轴骨、四肢骨的损害和双侧对称性的骨质硬化和骨膜炎,干骺端浸润为最常见的表现。
2.3 病理学改变
病理学诊断是确诊ECD的必要依据,许多病例临床症状首发于不同的系统,可能被临床医生、影像科医生误诊为相应系统中更加常见的其他疾病,病理医生可能成为根据活检组织提出正确诊断的第一人选,具有更加重要的作用。ECD病变主要表现为片状或带状组织细胞弥漫浸润,常伴有不同程度的纤维化和淋巴细胞、浆细胞浸润,肉芽肿形成[19]。组织细胞可以表现为富含脂质的泡沫状胞质或胞质嗜酸性染色,也可以表现为胞核呈花蕾样排列的多核杜顿巨细胞。免疫组织化学染色中CD68(+)、CD1a(-)、S-100(-/弱+)[20],电镜下缺乏Birbeck颗粒。
本例脑部病理切片中泡沫样组织细胞量相对较少,而更多表现为增生的星形胶质细胞和Rosenthal纤维形成,这也是造成病理误诊、漏诊的原因。ECD累及肺实质时,肿瘤性组织细胞主要沿淋巴管分布,累及小叶间隔和支气管血管束,具有分布特征。但对于肺部活检的小标本来说,观察到这样的分布特征具有难度,同时其他一些肺部疾病也可以表现为大量的泡沫样组织细胞聚集,包括脂性肺炎、泛细支气管炎、感染性疾病(肺孢子菌肺炎、Whipple病[21]、非结核分枝杆菌等)等。只有通过仔细的病理学观察,应用免疫组织化学、组织化学染色技术,并与临床表现及影像学特征相结合,剥丝抽茧地排除大部分其他疾病,才能将鉴别诊断锁定于组织细胞增生性疾病。对于肺部常见组织细胞增生性疾病[22-23]包括朗格罕组织细胞增多症,Rosai-Dorfman病及幼年性黄色肉芽肿,其鉴别诊断详见表1。
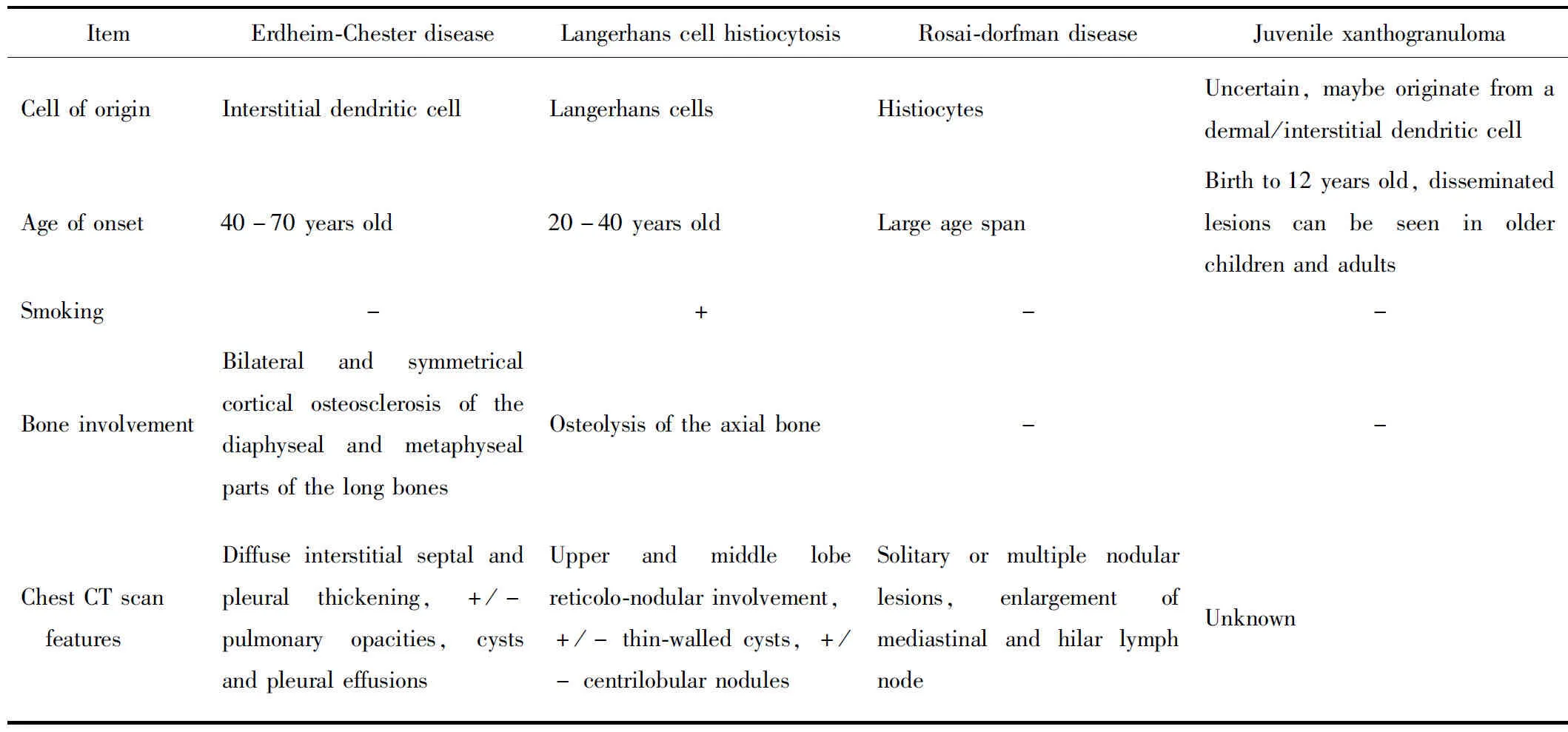
表1 常见组织细胞增生性疾病的鉴别诊断要点Tab.1 Key points for the differential diagnosis of histiocytic cell neoplasms
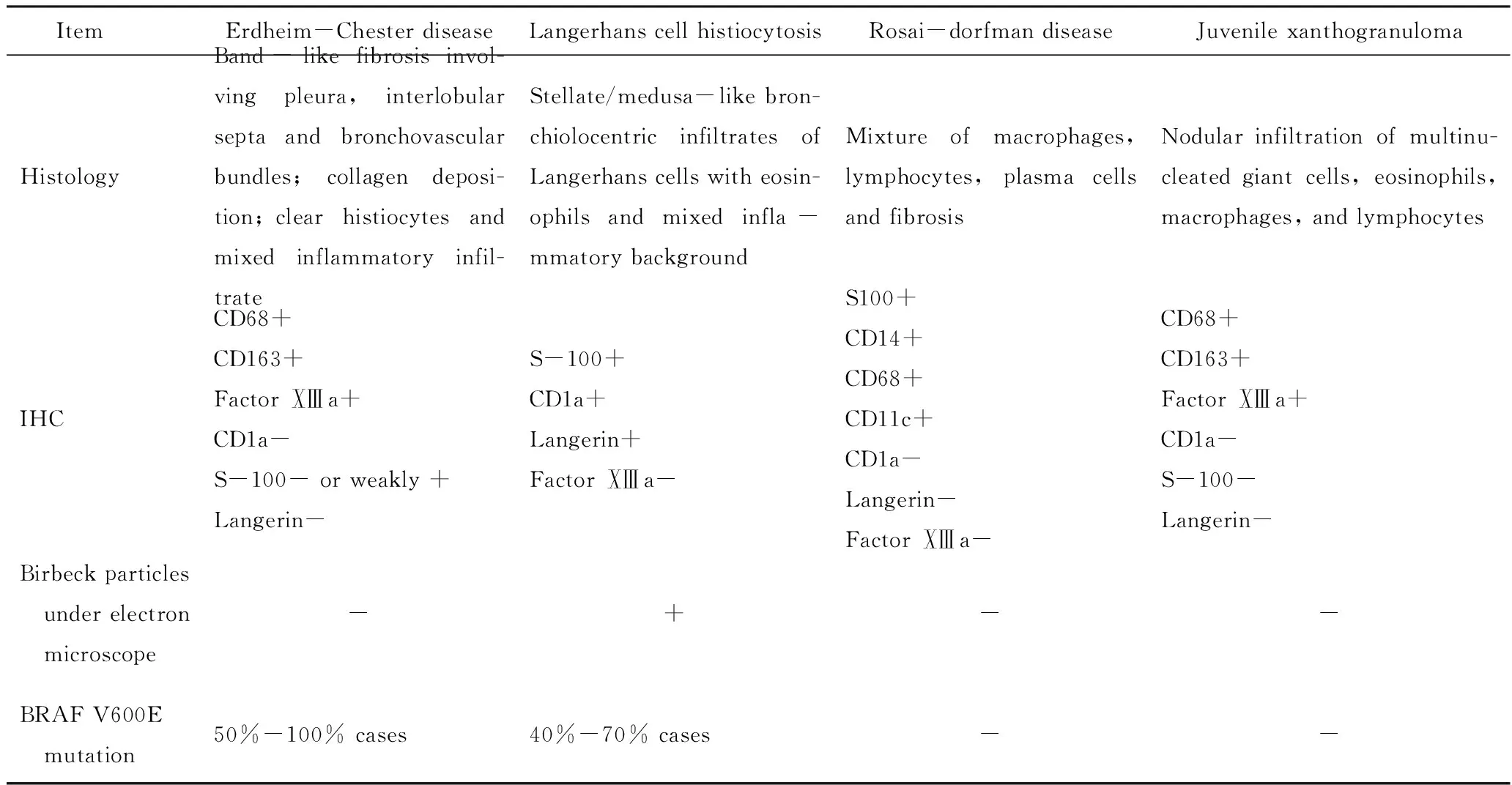
续表1
2.4 预后和治疗
ECD的预后欠佳,经过IFN-α长期治疗后,1年生存率为96%,5年生存率为68%[24]。脑实质的侵犯被认为是患者死亡的独立预后指标。靶向治疗药物的应用可能可以改善患者的生存预后。
由于ECD病例数有限,缺乏随机对照的临床研究,目前的治疗方法均来自于个案报道和经验总结。有效的治疗主要从炎性反应和肿瘤源性两个方面进行干预,包括了①干预细胞因子/化学因子网,首选IFN-α或PEG-IFN-α,或阿那白滞素和英夫利昔单抗等;②拮抗BRAFV600E突变,首选威罗菲尼;③应用糖皮质激素快速缓解症状;④放射治疗和手术治疗也可用于缓解症状的姑息治疗。最新研究[25]显示,BRAFV600E突变拮抗剂联合MAPK-ERK(MEK)抑制剂的靶向治疗取得较好的疗效。
本例中患者因为经济原因,未能进行更为有效靶向治疗,但短期内从干扰素治疗中也明显受益,避免了因诊断不明导致其他诊疗支出。
通过这个病例诊治过程的回顾,笔者发现ECD作为一种罕见的疾病,各系统受累后的表现形式多种多样,只有将临床表现、影像学资料、实验室检查结果和病理组织学特点相结合,同时在每个医生鉴别诊断意识中都应掌握ECD的相关信息,才能尽早地提出疑问,并最终获得正确的诊断。MDT在本病例的诊疗过程中具有重要作用,多个部位病理形态学检查结果相互对照,再综合患者临床症状的系统观察、治疗效果的评估及各系统影像学病变发展过程,才能最终确立ECD的诊断。所以病理、临床、影像的充分、及时沟通是本例患者能够明确诊断的重要原因,也是在诊疗过程中积累的宝贵经验。
