自噬基因预测肝癌患者长期生存及通路分析
2021-02-05林文雅陈金霞张友才
陈 懿 李 雪 林文雅 陈金霞 张友才
自噬是发生在所有真核细胞内的一种稳态过程,涉及双膜自噬体中细胞质成分的分离[1,2]。细胞或环境压力刺激自噬,通过形成自噬体清除受损的细胞器、蛋白聚集物和细胞内的病原体,然后将其作为溶酶体消化的目标[3]。自噬在肿瘤的促进和抑制中起着重要的作用。在肿瘤发生的早期阶段,自噬清除受损的细胞器和DNA,以维持正常的细胞结构和代谢稳定性,从而抑制肿瘤的发展[4]。在肿瘤的晚期,自噬被上调,并通过从降解的蛋白质和细胞器中吸收营养和能量来促进肿瘤细胞的增殖[5]。
肝细胞癌(hepatocellular carcinoma,HCC)是世界上最常见的恶性肿瘤之一,逐渐成为影响人类健康的公共卫生问题[6]。虽然制定了各种监测系统和治疗策略,包括手术切除、射频消融、经动脉化疗栓塞、系统治疗和肝移植等,但由于肝内和肝外复发和转移率高,肝癌的预后仍然很差[7]。临床上,TNM肿瘤分期、组织学分级等被用来评估肝癌患者的预后因素。然而,这些临床病理特征并不能准确地提供预测患者预后的信息。因此,需要开发可靠、准确的预后标志物,来帮助临床医生制定治疗策略。
自噬在肝癌中的研究得到了越来越多的重视,自噬相关基因(autophagy-related genes,ARGs)表达影响肝癌的进展[8,9]。有研究报道某些物质可通过PI3K-AKT通路,激活自噬,诱导细胞凋亡[10,11]。本研究旨在探究自噬相关基因在HCC患者中的潜在预后价值,探究自噬可能涉及的信号通路,并将ARGs表达与患者临床资料相结合,分析ARGs表达对肝细胞癌患者预后的影响。
材料与方法
1.自噬相关基因:从人类自噬基因数据库(HADb)中获得了人类232个人类自噬相关基因(http:∥autophagy.lu/clustering/index.html)。
2.肝癌相关数据集:从TCGA数据库下载377例肝细胞癌患者肝组织的转录组表达数据及相应的临床信息。总生存时间(overall survival, OS)被定义为从诊断到死亡或最后随访的间隔时间。
3.差异基因筛选及功能分析:采用Wilcoxon秩检验识别差异表达的自噬相关基因(DEARGs)。对得到的DEARGs进行GO富集及KEGG信号通路分析,并对结果进行可视化。
4.统计学方法:所有的统计分析均用R软件(R3.6.0)进行,以P<0.05为差异有统计学意义。采用单因素COX回归筛选预后相关基因,多因素COX分析构建预后模型。在将每个特定基因的表达值合并后,构建每个患者的风险值公式,并根据其估计的回归系数在多变量COX回归分析中加权。根据风险值中位数将TCGA数据集的HCC患者分为高、低风险组。采用Kaplan-Meier法对两组患者的生存差异进行评估,并采用Log-rank统计方法进行比较。采用多因素COX回归分析和分层分析,探讨风险值在预测患者预后中的作用。ROC曲线下面积(AUC)可作为判断预后准确性的指标。
结 果
1.差异自噬基因的筛选:采用Wilcoxon秩检验从374例肝细胞癌组织样本及50例正常组织样本的提取差异表达的自噬相关基因(DEARGs),共筛选出上调基因58个,下调基因4个,差异自噬相关基因表达,详见图1。
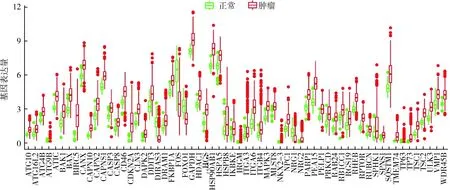
图1 差异的自噬相关基因在正常组织和肿瘤组织中的表达
2.DEARGs的功能富集:对62个差异表达的ARGs进行功能富集分析,GO富集显示,基因的生物学过程主要集中在自噬过程及膜的调节。KEGG通路显示,差异基因的途径主要集中在自噬、细胞凋亡、PI3K-AKT信号通路,详见图2。
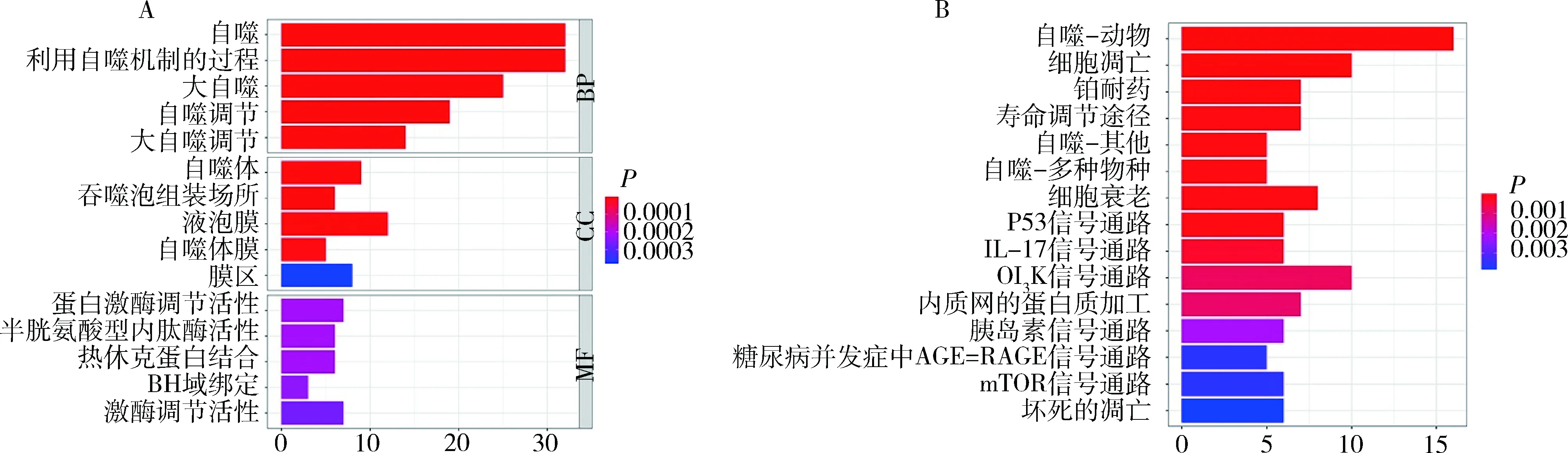
图2 差异表达的自噬相关基因GO及KEGG富集分析 A.GO富集分析;B.KEGG通路富集分析
3.预后相关ARGs的筛选:将62个差异自噬相关基因进行单因素COX分析,发现共32个ARGs与肝细胞癌患者整体生存明显相关。风险比森林图显示只有FOXO1基因是保护性基因,详见图3。
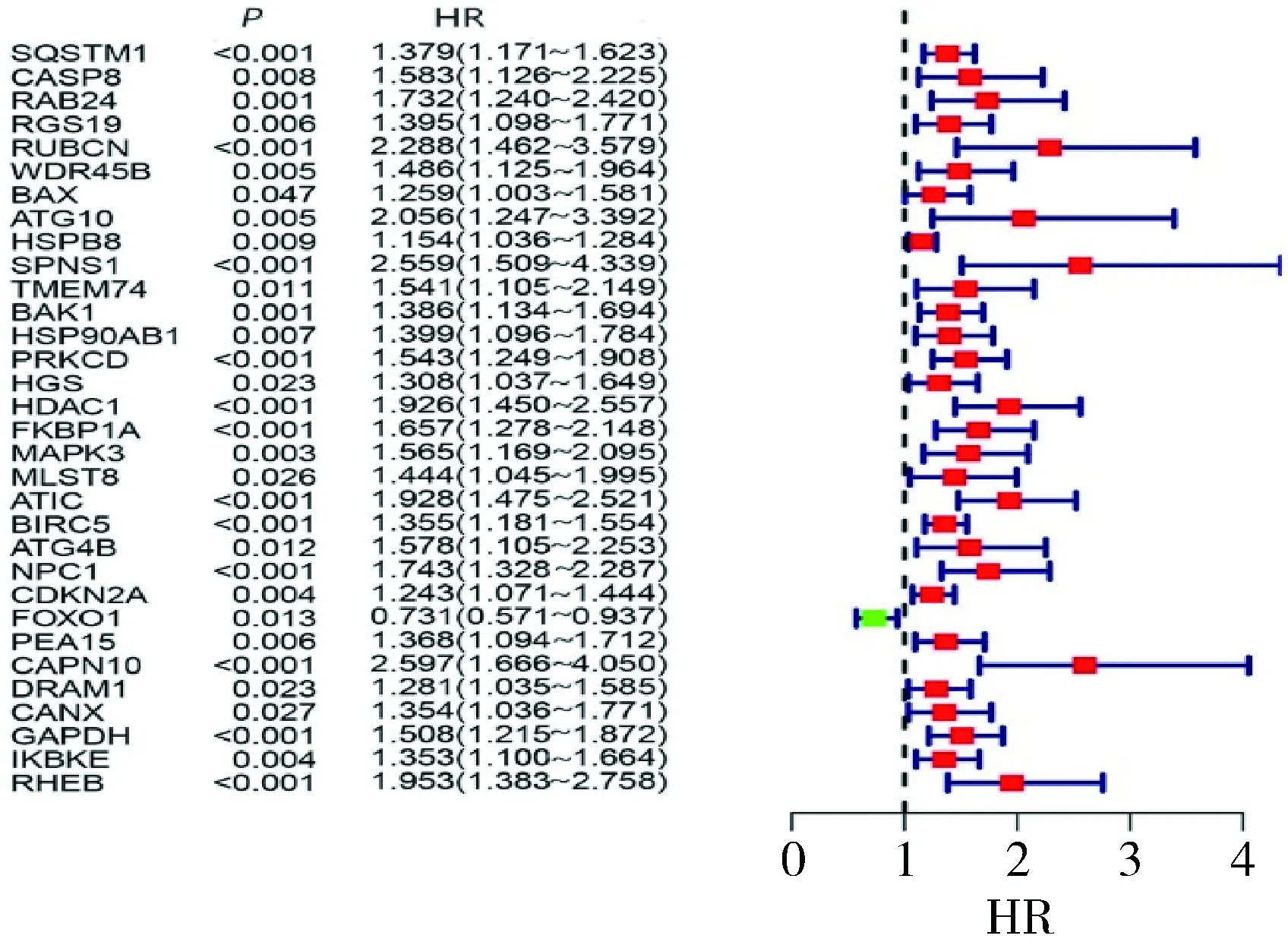
图3 预后相关的自噬基因风险比森林图
4.ARGs预后风险评分的建立:采用多因素COX回归筛选出最具有预后潜力的14个自噬相关基因(SQSTM1,CASP8,RGS19,ATG10,HSPB8,SPNS1,HSP90AB1,HGS,HDAC1,MLST8,ATIC,BIRC5,FOXO1,RHEB),详见表1。根据每个基因的mRNA表达水平和风险系数计算每个患者的风险值。根据以下风险值计算公式,风险值=(0.232)×SQSTM1+(-0.497)×CASP8+(-0.259)×RGS19+(0.395)×ATG10+(0.149)×HSPB8+(1.598)×SPNS1+(-0.285)×HSP90AB1+(-0.354)×HGS+(0.453)×HDAC1+(-0.747)×MLST8+(0.672)×ATIC+(0.189)×BIRC5+(-0.257)×FOXO1+(0.545)×RHEB,将肝细胞癌患者分为高风险组和低风险组,Kaplan-Meier生存曲线分析显示,高、低风险组患者的生存率比较,差异有统计学意义(P<0.001),详见图4A。
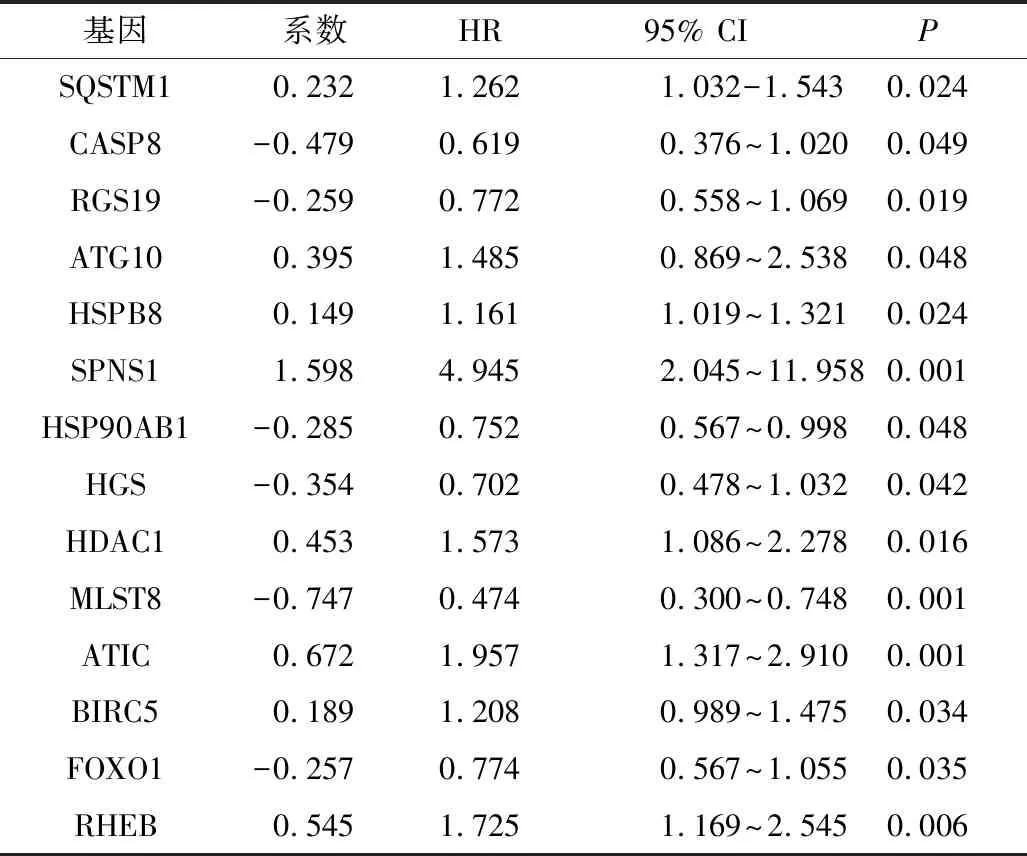
表1 多因素COX回归构建模型基因
5.ARGs的独立预后分析及风险模型准确性:单因素分析显示,肝细胞癌患者的分期和风险值与OS有关(P<0.05,图4B)。此外,根据临床病理特征如年龄、性别、肿瘤病理分级、肿瘤分期等进行多因素COX回归分析结果表明,风险值仍是患者的独立预后指标(P<0.05,图4C)。1年、3年对应的受试者工作特征(ROC)曲线下面积分别为0.765和0.732(图4D、图4E)。
6.风险评分与临床特征相关性:将ARGs构建的风险值与患者临床特征进行比较,根据2017版肝癌AJCC分期,Ⅲ~Ⅳ期患者风险值较Ⅰ~Ⅱ期患者更高(P<0.05,Z=-2.12),详见图5A。高风险组患者肿瘤病理等级较低风险组患者更高(图5B)。
讨 论
大量研究报道,自噬与癌症的发生密切相关。有研究表明,自噬相关基因ATG10在非小细胞肺癌中表达上调,其高表达是肺癌患者死亡的危险因素[12]。在乳腺癌中,BECN1等位基因缺失通过p53依赖的机制抑制乳腺肿瘤发生[13]。EIF4G1在鼻咽癌组织及细胞系中高表达,是判断鼻咽癌患者整体生存的独立预后指标[14]。在这项研究中,FOXO1是肝细胞癌的保护基因,过表达FOXO1可改善HCC患者预后,这与以往的研究一致[15,16]。
生物信息学研究发现,自噬相关基因富集在凋亡及PI3K-AKT等信号通路上。有研究报道了PI3K信号通路与乳腺肿瘤的发生及血管生成有关[17]。乙型肝炎病毒可通过调节PI3K-AKT信号通路,增强抗凋亡蛋白cIAP2表达,诱发肝癌[18]。体外细胞实验发现,同时使用芦荟素和二甲双胍可通过PI3K/AKT/mTOR通路抑制HCC的生长和侵袭,诱导其凋亡和自噬,从而增强抗肿瘤作用[19]。
自噬与凋亡之间相互作用,自噬和凋亡分别控制细胞内的细胞器和蛋白质以及细胞内的细胞的更替,许多应激途径依次诱导细胞内的自噬和凋亡,自噬可促进或抑制细胞凋亡。近年来研究发现,细胞凋亡存在多种类型,凋亡、坏死和自噬之间存在重叠[20]。
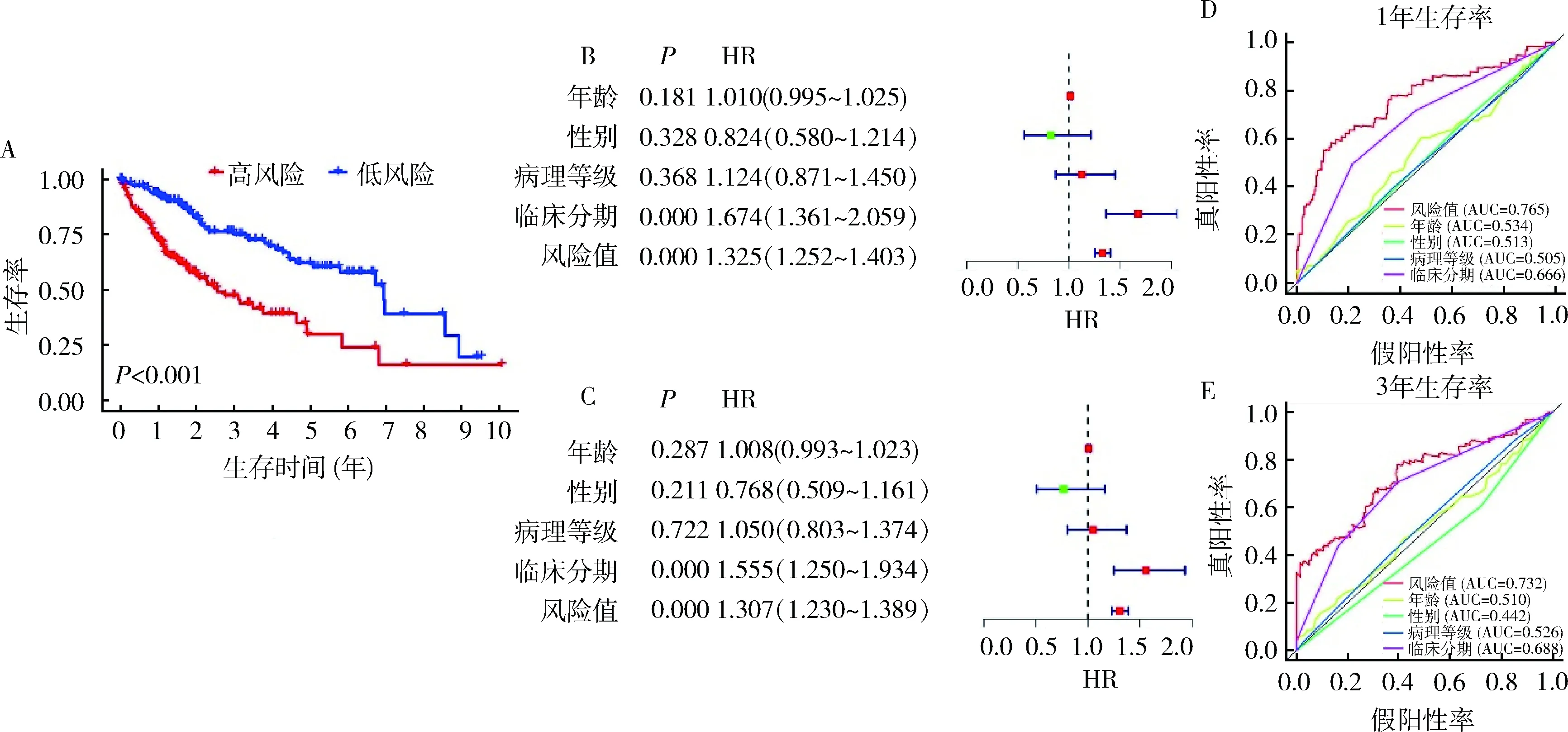
图4 HCC患者的预后分析及风险值预后价值 A.高低风险组生存差异;B.单因素COX分析预后因素;C.多因素COX分析预后因素; D.HCC患者1年生存率的ROC曲线;E.HCC患者3年生存率的ROC曲线

图5 风险值与患者临床分期及病理分级相关性 A.临床分期;B.病理等级
本研究分析了来自TCGA数据库HCC患者的基因表达数据及临床信息,以确定影响患者整体生存的ARGs。62个DEARGs在肿瘤样本及正常组织中差异表达,并富集在PI3K-AKT信号通路上。经过单因素及多因素COX回归分析,最终确立了14个预后相关的自噬基因纳入研究。基于自噬的分子特征,构建了风险模型,K-M曲线分析显示高风险组生存时间较低风险组明显缩短。风险值可作为独立预后指标,并证明了它们可以为HCC患者提供准确的预后分析,较肿瘤AJCC分期更为准确。进一步的分析表明,高风险组的患者具有更高的TNM分期及更高的病理等级,这证实了随着风险值升高,患者的长期预后更差。自噬途径发现的基因及通路也为临床上HCC患者的靶向治疗提供了新的可能性,但其具体机制仍有待于进一步研究。
