miR-4715-5p通过靶向MUC1基因对乳腺癌细胞迁移和增殖的影响
2021-02-05黄建棋郭文利范伟民陆建菊
黄建棋 郭文利 范伟民 陆建菊 陆 凯
乳腺癌起源于乳腺上皮组织,是女性发生率最高的恶性肿瘤之一[1]。乳腺癌的发生率逐年上升且日趋年轻化[2]。尽管乳腺癌的治疗手段得到很大发展,过度增殖和转移仍是影响患者预后的主要因素[3]。因此,探究乳腺癌的增殖和转移机制对寻找新的分子治疗靶点具有重要临床意义。微小RNA(miRNA)是一类内源性、非编码、单链小分子RNA,负责调控人类基因组内30%基因的表达,对细胞迁移、侵袭、增殖、分化、凋亡等生物学过程至关重要[4, 5]。miRNA直接参与人类肿瘤如淋巴癌、甲状腺癌、鼻咽癌、乳腺癌等的发生和发展,与肿瘤的直径、临床分期、化疗敏感度、放疗敏感度等密切相关,miRNA可能成为肿瘤的生物学标志物和分子治疗靶点[6,7]。miR-4715-5p是一个新近报道的miRNA,可有效抑制肺癌的生长和转移,发挥抑癌基因功能[8]。然而,miR-4715-5p在乳腺癌中的表达、功能和分子机制尚不明确。本研究旨在观察miR-4715-5p在乳腺癌组织和细胞系中的表达水平,分析高表达miR-4715-5p对乳腺癌细胞迁移和增殖的影响,探讨miR-4715-5p在乳腺癌细胞中的分子机制,为乳腺癌的分子靶向治疗提供新的思路。
材料与方法
1.组织标本:43例乳腺癌组织和癌旁组织来自2017年8月~2019年12月于笔者医院乳腺病科经手术切除治疗的患者。患者平均年龄为51.59±7.46岁;高分化 22例、中分化 16例、低分化5例;TNM 分期Ⅰ期 26 例、Ⅱ期13例、Ⅲ期4例;肿瘤直径≤3cm 18例,>3cm 25例。所有组织标本均经两名以上病理学专家确诊,组织置于液氮中冷冻保存。本研究由笔者医院医学伦理学委员会批准。
2.细胞系和主要试剂:正常乳腺细胞系(MCF-10A)和乳腺癌细胞系(HCC1937、MCF-7、MB-MDA-468、SKBR3)均购自中国典型培养物保藏中心。Lipofectamine 3000转染试剂盒购自美国Invitrogen公司。胎牛血清(FBS)、DMEM培养基、RPMI-1640培养基购自美国Gibco公司。对照模拟物NC、miR-4715-5p模拟物(5′-AAGUUGGCUGCA-GUUAAGGUGG-3′)、MUC1 mRNA野生型质粒和突变型质粒购自上海吉玛生物工程公司。双荧光素酶报告基因检测试剂盒购自美国Promega公司。qRT-PCR试剂盒购自美国Applied Biosystems公司。CCK-8试剂盒购自上海拜力生物科技有限公司。抗β-actin、MUC1、p-PI3K、p-AKT、p-PDK1、MDM2抗体均购自美国Cell Signaling Technology公司。
3.细胞培养和转染:采用含10% FBS、青霉素和链霉素的DMEM培养基培养MCF-10A和MB-MDA-468细胞,采用含10% FBS、青霉素和链霉素的RPMI-1640培养基培养HCC1937、MCF-7、SKBR3细胞,在37℃、5%CO2条件下培养。收集对数生长期的MCF-7细胞接种于6孔板,分别将2μl Lipofectamine 3000与5nmol NC模拟物或miR-4715-5p以体积比1∶50均匀混合,冰上静止15min,缓慢加入6孔板,摇晃均匀后继续培养,分别命名为对照组和实验组。转染48h后进行后续实验。
4.RNA提取、反转录和实时荧光定量PCR(qRT-PCR):采用Trizol法提取乳腺癌组织和细胞系总RNA,反转录为cDNA。配置qRT-PCR反应体系20μl,设定反应参数:95℃预变性5min;62℃ 35s,70℃ 35s,共35个循环。以U6为内参检测miR-4715-5p的表达水平,以β-actin为内参检测MUC1 mRNA的表达水平。引物由上海生工生物科技服务有限公司合成,β-actin上游引物:5′-GGCACCACACCTTCTACAAT-3′,下游引物:5′-GCCTGGATAGCAACGTACAT-3′。miR-4715-5p上游引物: 5′-AAGTTGGCTGCAGTTAAGGTGG-3′,下游引物:5′-GTCGTATCCAGTGCAGGGT-3′。U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。MUC1上游引物: 5′-TGCCGCCGAAAGAACTACG-3′,下游引物:5′-TGGGGTACTCGCTCATAGGAT-3′。
5.细胞划痕实验:收集对数生长期的两组MCF-7细胞,采用无血清RPMI-1640培养基制成密度为5×105个/毫升的单细胞悬液,以2毫升/孔接种至6孔板,待细胞贴壁后,采用200μl无菌枪头在6孔板底部划痕,采用PBS溶液洗3次,加入无血清RPMI-1640培养基,倒置显微镜下观察并拍照,记录划痕面积S1。继续培养 24h,倒置显微镜下观察并拍照,记录划痕面积S2。细胞迁移率(%)= (S1-S2)/S1×100%。
6.CCK-8法:收集对数生长期的两组MCF-7细胞,以5×103个/孔接种于96孔培养板,每孔200μl,在培养箱中分别培养1、2、3、4、5天,每孔加入30μl CCK-8溶液,在培养箱中继续培养4h。采用酶标仪记录在450nm波长下各孔的吸光度(A)值,绘制两组MCF-7细胞的生长曲线。
7.生物信息学软件预测和双荧光素酶报告基因实验:采用miRNAMap、miRWalk、PicTar软件预测miR-4715-5p可互补结合的靶基因。收集对数生长期的MCF-7细胞接种于6孔板,细胞实验分组:共转染野生型质粒+NC、共转染野生型质粒+miR-4715-5p、共转染突变型质粒+NC、共转染突变型质粒+miR-4715-5p。24h后分别检测每孔萤火虫荧光素酶活性和海肾荧光素酶活性。相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
8.Western blot法:收集对数生长期的两组MCF-7细胞,在冰上提取细胞总蛋白。配制10%十二烷基苯磺酸钠-聚丙烯酰胺凝胶,上样后电泳110min。采用硝酸纤维素膜进行转膜,于5%脱脂牛奶中封闭。配制一抗,稀释比例:β-actin(1∶2000)、MUC1(1∶1000)、p-PI3K(1∶2000)、p-AKT(1∶2000)、p-PDK1(1∶1000)、MDM2(1∶2000),在4℃冰箱中孵育过夜。配制二抗,在室温下孵育3h。滴加ECL显影液,在凝胶成像系统下成像,以β-actin为内参。
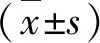
结 果
1.miR-4715-5p在乳腺癌组织和乳腺癌细胞系中的表达水平:miR-4715-5p在乳腺癌组织和癌旁组织中的表达分别为0.91±0.38和4.89±0.64,miR-4715-5p在乳腺癌组织中的表达水平显著低于癌旁组织(P<0.01,图1)。miR-4715-5p在正常乳腺细胞系(MCF-10A)和乳腺癌细胞系(HCC1937、MCF-7、MB-MDA-468、SKBR3)中的表达分别为1.01±0.08、0.76±0.06、0.13±0.03、0.50±0.05、0.38±0.08,miR-4715-5p在乳腺癌细胞系中的表达水平显著低于正常乳腺细胞系(P均<0.05),MCF-7细胞中miR-4715-5p的表达水平最低(P<0.01,图2)。

图1 乳腺癌组织和癌旁组织中 miR-4715-5p的表达水平

图2 乳腺癌细胞系和正常乳腺细胞系中 miR-4715-5p的表达水平 与MCF-10A细胞系比较,*P<0.05,**P<0.01
2.各组MCF-7细胞miR-4715-5p的表达水平:对照组和实验组MCF-7细胞中miR-4715-5p的表达分别为1.13±0.30和9.98±1.10,实验组miR-4715-5p的表达水平显著高于对照组(P<0.01),表明miR-4715-5p模拟物在MCF-7细胞中成功高表达。
3.高表达miR-4715-5p抑制MCF-7细胞的迁移:细胞划痕实验显示(图3),对照组和实验组细胞迁移率分别为69.58%±6.73%和34.84%±3.84%,实验组细胞迁移率显著少于对照组(P<0.01),表明高表达miR-4715-5p可抑制MCF-7细胞的迁移。

图3 高表达miR-4715-5p对MCF-7细胞迁移的影响 结晶紫染色,×100
4.高表达miR-4715-5p抑制MCF-7细胞的增殖:CCK-8法显示(图4),接种MCF-7细胞第2天开始,与对照组比较,实验组细胞的增殖能力显著降低(P<0.05),表明高表达miR-4715-5p可抑制MCF-7细胞的增殖。

图4 高表达miR-4715-5p对MCF-7细胞增殖的影响 与实验组比较,*P<0.05,**P<0.01
5.生物信息学软件预测miR-4715-5p的靶基因:采用miRNAMap、miRWalk、PicTar软件预测,miR-4715-5p互补结合的靶基因可能是MUC1,MUC1 mRNA突变序列见图5。

图5 miR-4715-5p与MUC1 mRNA互补结合的序列
6.双荧光素酶报告基因实验验证miR-4715-5p互补结合MUC1 mRNA:双荧光素酶报告基因实验显示,野生型质粒+NC组和野生型质粒+miR-4715-5p组的相对荧光素酶活性分别为1.02±0.11和0.33±0.06,野生型质粒+miR-4715-5p组相对荧光素酶活性被抑制(P<0.01),而突变型质粒+NC组和突变型质粒+miR-4715-5p组相对荧光素酶活性差异无统计学意义(P>0.05),表明miR-4715-5p可互补结合MUC1 mRNA,详见图6。

图6 双荧光素酶报告基因实验验证 miR-4715-5p的靶基因
7.高表达miR-4715-5p对MUC1 mRNA表达的影响:qRT-PCR实验显示,对照组和实验组MCF-7细胞中MUC1 mRNA表达分别为1.06±0.21和0.22±0.07,表明高表达miR-4715-5p可抑制MUC1 mRNA的表达(P<0.01)。
8.高表达miR-4715-5p对MUC1蛋白及PI3K/AKT信号通路蛋白表达的影响:Western blot法实验显示,高表达miR-4715-5p后,MCF-7细胞中MUC1蛋白表达降低,PI3K/AKT信号通路蛋白p-PI3K、p-AKT、p-PDK1、MDM2表达降低(图7)。

图7 高表达miR-4715-5p对MCF-7细胞MUC1 蛋白及PI3K/AKT信号通路蛋白表达的影响
讨 论
miRNA是一类由19~22个核苷酸组成的非编码RNA,通过与靶基因mRNA的3′非翻译区不完全互补结合,诱导靶基因mRNA的降解或者抑制其翻译,导致靶基因蛋白表达降低,从而参与细胞的各种生理和病理活动[9, 10]。越来越多的研究表明,miRNA可发挥癌基因或抑癌基因功能,通过调控靶基因表达,参与调控各种信号通路的活化,影响肿瘤的发生和进展[11, 12]。Cui等[13]研究发现,在人乳腺癌组织和MCF-7细胞中,miR-216a的表达水平均显著降低,高表达miR-216a可抑制MCF-7细胞的迁移并促进其凋亡。Mansoori等[14]研究发现,与正常组织比较,miR-142-3p在乳腺癌组织中表达水平下调,高表达miR-142-3p可抑制乳腺癌细胞的增殖、侵袭和迁移,上调miR-142-3p可诱导多种抑癌miRNA包括miR-330,miR-145和miR-34a的表达。近年来的研究显示,miR-4715-5p在肺癌组织和细胞系中表达水平显著降低,高表达miR-4715-5p可显著抑制肺癌细胞的增殖、迁移、侵袭和细胞周期,干扰miR-4715-5p表达可促进肿瘤的生长和转移,miR-4715-5p发挥明显的抑癌基因功能[8]。miR-4715-5p在乳腺癌细胞中的功能和分子作用机制尚不清楚。
本研究显示,与癌旁组织比较,乳腺癌组织中miR-4715-5p的表达水平显著降低;与正常乳腺细胞比较,乳腺癌细胞系中miR-4715-5p的表达水平显著降低,提示miR-4715-5p可能参与乳腺癌发生、进展。采用体外转染法高表达miR-4715-5p后,可显著抑制乳腺癌MCF-7细胞的迁移和增殖,miR-4715-5p在乳腺癌中发挥明显的抑癌基因功能。本研究采用miRNAMap、miRWalk、PicTar软件预测,黏蛋白1(mucins 1,MUC1)可能是miR-4715-5p的靶基因。MUC1是一种高度糖基化的跨膜蛋白,主要表达于上皮细胞,介导多种信号转导,与细胞的黏附和增殖密切相关[15, 16]。MUC1在结肠癌、胰腺癌、卵巢癌等肿瘤中明显高表达,与肿瘤的恶性程度、淋巴结转移、不良预后存在相关性[17, 18]。MUC1在乳腺癌组织中高表达,MUC1可诱导乳腺癌细胞对他莫昔芬的耐药,MUC1表达较高的乳腺癌患者预后较差,沉默MUC1可抑制乳腺癌细胞的转移和生长[19, 20]。本研究采用双荧光素酶报告基因实验证明,miR-4715-5p与MUC1可互补结合。本研究高表达miR-4715-5p后,MUC1基因表达显著降低,进一步证明MUC1是miR-4715-5p的靶基因。PI3K/AKT信号通路是肿瘤细胞获得异常转移和增殖能力的关键机制[21]。Western blot法显示,MUC1蛋白表达降低后,PI3K/AKT信号通路蛋白p-PI3K、p-AKT、p-PDK1、MDM2表达显著降低,PI3K/AKT信号通路转导被抑制,表明细胞的迁移和增殖能力降低。
综上所述,本研究证实乳腺癌组织和细胞系中miR-4715-5p的表达水平显著降低,高表达miR-4715-5p可通过干扰MUC1基因表达,阻滞PI3K/AKT信号通路转导,抑制乳腺癌MCF-7细胞的迁移和增殖。本研究可能为乳腺癌发病机制研究和分子靶向治疗提供新的方向。
