AAV-DJ病毒对H9C2细胞感染效果的研究
2021-02-05章晶晶
章晶晶 钟 鹏 孔 彬 黄 鹤
外源基因转入真核细胞即通常所说的细胞转染技术,是研究基因表达调控及基因治疗的有效技术之一,目前可通过磷酸钙沉淀法、脂质体介导法、电穿孔法、显微注射法及病毒感染等实现[1~5]。而大鼠心肌细胞系 H9C2能稳定传代,有着骨骼肌的很多特性,是一种常用的心肌细胞模型[6]。随着细胞转染技术的广泛应用,找到高效、无毒转染 H9C2 细胞的方法将为心血管疾病治疗提供更多思路。其中病毒感染是一种应用广泛的策略,其具有操作简便、宿主范围广且可以高效感染细胞等特点。而腺相关病毒(AAV)是迄今为止最安全、最良好、最有前景的基因治疗工具,AAV-DJ病毒是近年来新发现的一种由AAV2型、8型、9型组成的嵌合体,是通过改组8种不同的野生型病毒而产生的。已有报道显示,AAV-DJ病毒对多种组织和细胞的感染效率远高于原生AAV血清型[7]。因其具有广泛的侵噬性,可以高效地感染多种细胞,而被广泛地用于基因转导。然而,AAV-DJ病毒对心脏感染的研究却少有报道,到目前为止,仅有1例研究报道AAV-DJ病毒对心肌梗死后小鼠的心脏具有感染效能[8]。所以,笔者想探究AAV-DJ病毒对心肌细胞的感染能力,从而寻找出一种可以安全高效地感染心脏的病毒载体。
材料与方法
1.材料:质粒载体包括pAAV-MCS、pcDNA3.1-EGFP、pHelper、pAAV-DJ、pAAV-RC9均购自武汉淼灵生物科技有限公司。EcoRⅠ和XbaⅠ限制酶购自美国NEB公司。T4 DNA连接酶和凝胶纯化试剂盒购自上海碧云天生物技术有限公司。DH5α感受态细胞获自上海威迪生物技术有限公司。
2.细胞培养:H9C2细胞和HEK293T细胞获自上海生物化学与细胞生物学研究所。将H9C2细胞培养在含10%FBS,100U/ml青霉素和100mg/ml链霉素的DMEM/F12培养基(美国Gibco公司)中。将HEK293T细胞培养在含10%胎牛血清,100U/ml青霉素和100mg/ml链霉素的DMEM培养基(美国Gibco公司)中。将所有细胞置于37℃含5%CO2的培养箱中培养。
3.腺相关病毒的生产和纯化:AAV的生产和纯化参考文献[9]进行。简而言之,为了产生AAV,将HEK293T细胞接种在10个15cm2的培养皿中。当融合度达到95%时,将pAAV-EGFP、pHelper、pAAV-DJ 3种质粒共同转染到 HEK293T 细胞中(使用PEI作为转染试剂, 每种质粒的摩尔量按照1∶1∶1比例加入, 每15cm2的培养皿中共转入40μg质粒,质粒和PEI按照 1μg∶4μg 的比例加入),转染3天后,收集细胞和细胞上清液并离心以分离细胞沉淀物和上清液,两者均含有AAV。含有AAV的细胞上清液可直接用于随后的定性实验,以测试AAV在体外培养的心肌细胞的转导效率。至于定量实验,将细胞沉淀物收集在300μl PBS中,然后进行5次冻融循环,在液氮和37℃水浴锅中进行冻融循环。最后,以18000×g的离心力除去细胞碎片,合并含AAV的上清液和细胞培养上清液,然后进行PEG 8000沉淀和不连续的碘克沙醇梯度超速离心。
4.细胞感染:按不同的感染复数(multiplicity of infection,MOI) 把细胞分为6 组:MOI= 0微克/细胞的细胞组(对照组),即未转染病毒组;MOI=100微克/细胞的细胞组; MOI=200微克/细胞的细胞组; MOI=400微克/细胞的细胞组; MOI =1×103微克/细胞的细胞组;MOI =1×104微克/细胞的细胞组。将细胞置于37℃、5%CO2的培养箱中,24h 后,在原有液体的基础上继续加入适量FBS 及DMEM/F12培养基,使FBS 终浓度达到10%。
5.荧光显微镜采图:培养24h后,开始用荧光显微镜观察,MOI=0微克/细胞作为对照组,于转染后第1、2、3、4、5、6 和7天进行细胞形态和生长的观察,以波长为490nm 的蓝色光激发出绿色荧光的H9C2 细胞为阳性细胞,按一个随机高倍视野下计数200 个细胞中阳性细胞的个数计算出平均百分率(重复3 次),并照相记录。
6.细胞明场照片及CCK-8法检测评价细胞活性:培养24h后,用普通显微镜对6组不同MOI的H9C2细胞进行拍照以观察AAV-DJ病毒对细胞生长情况的影响。并参考已发表的文献,使用CCK-8细胞计数试剂盒(日本Dojindo Laboratories公司)测量细胞的存活率[10]。简而言之,将细胞以2×104个/孔的密度接种在96孔板中,在处理期结束时,将10μl WST-8溶液添加到细胞中,并将细胞在37℃下孵育3h,通过美国的Bio- Rad酶标仪测量450nm处的吸光度来定量细胞增殖。
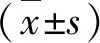
结 果
1.AAV-DJ病毒可有效感染心肌H9C2细胞:笔者首先构建pAAV-EGFP作为病毒载体。为了构建pAAV-EGFP载体,笔者用EcoRⅠ和XbaⅠ限制性内切酶从pcDNA3.1-EGFP载体中分离出EGFP cDNA片段。同时,用相同的限制酶组合消化pAAV-MCS载体(图1A)。然后,通过琼脂糖凝胶电泳纯化所需片段(图1B)。接着将纯化的EGFP片段和pAAV-MCS骨架通过T4连接酶连接,并在化学感受态DH5α细胞中转化回收,最后在带有氨苄青霉素的琼脂板上划线(图1C)。其中,EGFP的表达由组成型启动子CMV启动表达。
笔者尝试通过如前所述的三重转染方法制备AAV-DJ-EGFP病毒。笔者混合了pAAV-EGFP、pHelper和pAAV-DJ载体,并利用PEI作为转染试剂(图1D),然后将混合后的质粒加到HEK293T细胞的培养基中。由于AAV可以自行分泌到培养基中,因此于第3天收集上清液,更换细胞培养基,并于第6天再次收集上清液。在第3天和第6天观察细胞的荧光强度(图1E)。最后,将含有AAV-DJ-EGFP的细胞上清液通过0.2μm过滤器过滤,以除去细胞碎片,最终将病毒上清液用于以下实验。
笔者尝试定性检测AAV-DJ病毒对H9C2细胞的感染效率。将含有AAV-DJ-EGFP的病毒上清液加到H9C2细胞的培养基中。在AAV-DJ-EGFP感染后的不同时间点,通过荧光显微镜观察H9C2细胞的荧光强度。如图1F和1G所示,笔者发现H9C2细胞的荧光强度以时间依赖性方式增加。这些结果证明了AAV-DJ-EGFP病毒对H9C2细胞有较强的感染效率。
2.荧光强度检测评价AAV-DJ病毒对H9C2细胞的感染效率的定量实验:为了进一步定量确定AAV-DJ病毒对H9C2细胞的基因转导效率,利用纯化的明确病毒效价的AAV-DJ-EGFP病毒以不同MOI分别感染H9C2细胞,然后在感染病毒后的第1、2、3、4、5、6、7天连续观察细胞荧光强度。如图2所示,AAV-DJ-EGFP感染H9C2细胞后荧光细胞所占的百分比以剂量依赖性和时间依赖性方式逐渐增加。
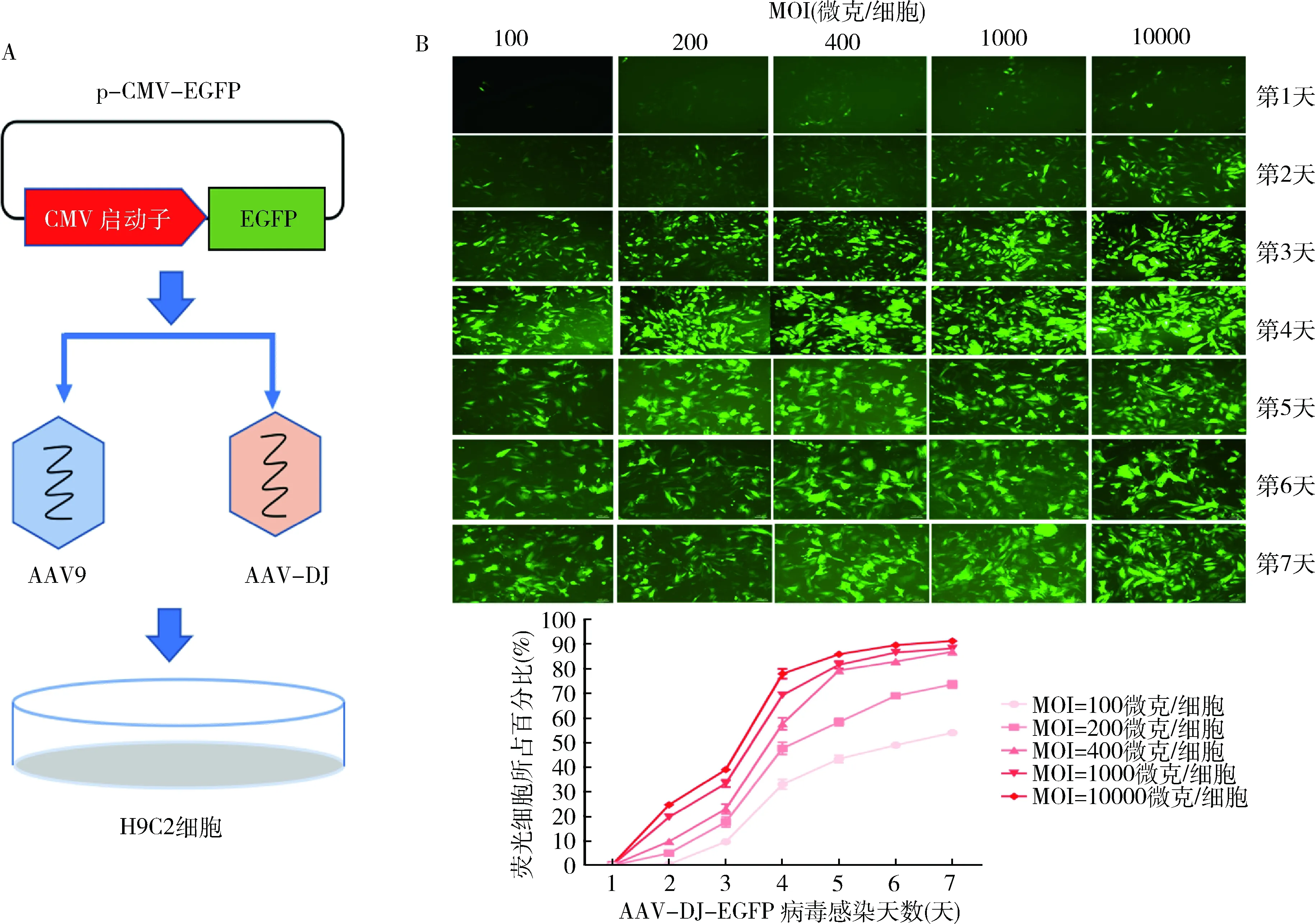
图2 AAV-DJ-EGFP病毒对H9C2细胞感染效率评估的定量实验 A.显示将具有相同启动子及绿色荧光蛋白基因的AAV9-EGFP和AAV-DJ-EGFP病毒分别加入H9C2细胞的示意图;B.显示用不同MOI的AAV-DJ-EGFP病毒分别感染H9C2细胞,然后分别在感染病毒后的第1、2、3、4、 5、6、7天观察细胞荧光(×10),并显示了荧光细胞百分比的统计数据
3.AAV-DJ病毒与AAV9病毒对H9C2细胞的感染效率的比较:为了明确AAV-DJ病毒对H9C2细胞的感染效率是否比AAV9病毒的强,笔者用相同MOI的AAV-DJ病毒与AAV9病毒分别去感染H9C2细胞。发现当MOI分别为100~10000微克/细胞时,AAV9-EGFP所感染的细胞中没有明显的荧光细胞,而AAV-DJ-EGFP所感染的细胞中荧光细胞所占的百分比以剂量依赖性和时间依赖性方式递增(图3)。
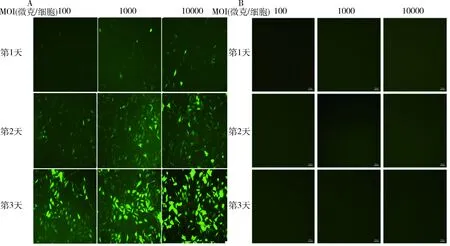
图3 AAV-DJ与AAV9病毒对H9C2细胞感染效率的比较(×10) A.AAV-DJ;B.AAV9
4.细胞明场照片及CCK-8检测评价AAV-DJ病毒对H9C2细胞活性的影响:笔者通过拍摄细胞明场照片及CCK-8试剂盒分析明确了AAV-DJ病毒感染H9C2细胞后对其细胞活性的影响。如图4所示,以不同MOI的AAV-DJ病毒分别感染H9C2细胞24h后,其细胞生长状况及细胞活性均没有明显变化。
图4 AAV-DJ病毒对H9C2细胞活性的影响 A.细胞明场照片(×10);B.CCK8检测
讨 论
目前,基因治疗是一个正在飞速发展的学科,其通过病毒载体将正常基因导入到缺陷组织中,以替代或补偿缺陷基因的功能,达到治疗遗传性或获得性疾病的目的。因此,基因治疗相关的病毒载体也受到广泛关注,主要包括慢病毒、腺病毒、腺相关病毒以及非病毒载体,各有其优缺点。其中,腺相关病毒载体因其较高的生物安全级别、低免疫原性、宿主范围广泛且稳定表达等独特优势成为目前应用最为广泛的基因治疗载体[11]。而良好的病毒载体系统必须具备3个要素: 安全性、转导高效性和相对特异性[12]。慢病毒生物安全性较低,腺病毒难以形成细胞内稳定转染,且表达持续时间短,而腺相关病毒安全性最高(RK1级别),目前无报道其参与任何疾病的发生,且腺相关病毒感染宿主范围广,相对特异性高,免疫原性和宿主炎性反应极低,表达时程长(可稳定表达半年以上)。迄今为止,已经找到来自人类的13 种血清型的腺相关病毒,主要区别在于其衣壳蛋白Cap不同,对不同的组织和细胞有不同的感染效率[13]。
AAV-DJ病毒是近年来新发现的一种具有广泛侵噬性的嵌合体病毒,对多种器官具有高转导效率及低免疫原性,同时,可防止胞内降解并促进转基因表达。已有不少研究报道其可以安全高效地感染多种细胞,如AAV-DJ载体可用于敲除猪成纤维细胞的基因,其靶向性远高于其他野生型腺相关病毒[14]。AAV-DJ对人类角质细胞的转导效率远大于其他血清型[15]。AAV-DJ载体可以把目的基因转导到光感受器层,其对视网膜内的多种细胞具有高感染效率,尤其是视网膜内的米勒细胞,且对视网膜功能并无影响[16]。此前,还未曾有研究将目的基因成功地转导到小鼠的味觉细胞,直到将AAV-DJ作为一种病毒载体将EGFP成功地转导到小鼠的味觉细胞,并且小鼠未产生免疫反应[17]。最近,Wei等[18]以AAV-DJ为载体成功介导了靶基因的上调与下调,从而实现了胆管上皮细胞向肝细胞的分化。基于AAV-DJ病毒的特性并成功地应用于其他类型细胞的感染及基因转导,笔者研究了其在心血管领域的应用。
笔者证实,AAV-DJ病毒对H9C2细胞有很强的感染特性,其感染效率与时间及病毒效价呈正相关,且该病毒对H9C2细胞没有明显的细胞毒性。慢病毒属于反转录病毒,能与宿主细胞的染色体随机整合并对转录沉默作用有一定的抵抗力,从而可以稳定转染细胞系并持续高表达水平,然而,也正是由于该特点使慢病毒的生物安全性明显降低,造成致瘤致突变的风险,同时,慢病毒还具有明显的细胞毒性[19]。相对于慢病毒,AAV-DJ 病毒的生物安全性明显提升,几乎不会产生致瘤致突变的风险,另外,笔者也证实了AAV-DJ 病毒对H9C2细胞的活性无明显影响。AAV-DJ 病毒能安全有效地介导绿色荧光蛋白基因的表达,这为AAV-DJ 病毒转导其他治疗基因提供了一定的基础,为心脏疾病的基因治疗提供一个可行的研究模式。
本研究就AAV-DJ病毒对H9C2细胞的感染特性进行了定性验证及一定程度的定量验证,有待于进一步的定量实验验证AAV-DJ病毒的该特性,且本研究局限于体外细胞实验,未在动物层面上进行验证,这些也为下一步的实验提供了思路。
综上所述,AAV-DJ病毒是一种新型的且具有广阔前景的基因治疗载体,随着对其研究的深入会为心血管疾病方面的基因治疗和再生医学领域带来突破性进展。
