心肺复苏成功后血清缺氧诱导因子- 1α 和缺氧诱导因子- 2α与患者预后的关系
2021-02-05郑松娅张胜
郑松娅 张胜
心搏骤停是指心脏射血功能突然停止,常发生于有心血管疾病的患者[1]。导致心搏骤停的常见病理生理机制为快速型室性心律失常(心室颤动和室性心动过速),其次为缓慢型心律失常或心室停顿,心搏骤停发生时机体可发生强烈的应激反应,若抢救不及时可引起患者全身器官组织严重缺血、缺氧,造成不可逆损害甚至死亡[2]。心肺复苏是心搏骤停的首选抢救方法,复苏过程中患者机体经历缺血、缺氧、再灌注损伤的过程,在这种强烈应激反应状态下,伴随血流动力学不稳定、全身低灌注,可能发生多器官功能障碍[3],并导致缺氧诱导因子(hypoxia inducible factors,HIFs)过度表达,HIFs 可调控炎症发展、细胞代谢等[4]。而缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、缺氧诱导因子-2α(hypoxia inducible factor-2α,HIF-2α)表达降低可降低细胞存活率、糖酵解酶基因表达以及促血管生成因子生成[5]。本研究探讨行心肺复苏的心搏骤停患者HIF-1α、HIF-2α 与预后的关系,现将结果报道如下。
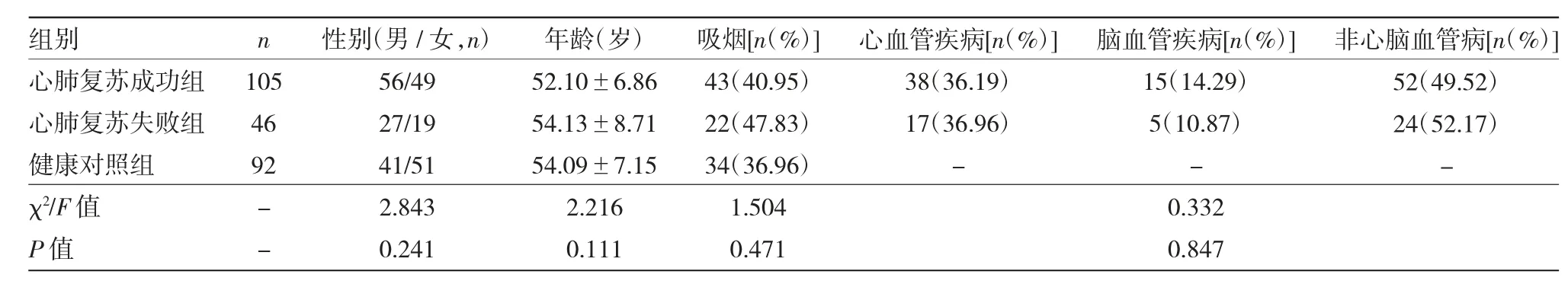
表1 3 组对象一般资料比较
1 对象和方法
1.1 对象 选取2016 年6 月至2019 年3 月常山县人民医院急诊科接受心肺复苏治疗成功的心搏骤停患者105 例作为心肺复苏成功组,选取同期接受心肺复苏治疗失败的心搏骤停患者46 例作为心肺复苏失败组,另选取同期常山县人民医院体检健康者92 例作为健康对照组,3 组对象性别、年龄等指标比较差异均无统计学意义(均P>0.05),见表1。心肺复苏成功组纳入标准:(1)心搏骤停发生年龄>18 岁;(2)心肺复苏治疗结果成功,存活时间≥48 h;(3)左心室射血分数(left ventricular ejection fraction,LVEF)≥40%。排除标准:(1)既往有严重心、肝、肾功能衰竭病史;(2)合并各种癌症。本研究经常山县人民医院医学伦理委员会审查批准(批准文号:LL2016-009 号),3 组对象或家属均对本研究知情同意并自愿签署知情同意书。
1.2 方法
1.2.1 抢救方法及判断标准 依据《2010 国际心肺复苏与心血管急救指南》[6]判断呼吸心跳停止、实施心肺复苏措施、自主循环恢复(recovery of spontaneous circulation,ROSC)、终止心肺复苏的标准判断。一旦诊断呼吸心跳停止,立即行心肺复苏抢救,由心电图确定心搏骤停的类型,选择心室除颤、胸部按压或人工通气、建立静脉液路、给予复苏药物如肾上腺素等措施。
1.2.2 HIF-1α、HIF-2α 表达水平检测 转录试剂盒(批号:DEM201-20T)购自北京拜尔迪生物技术有限公司;Prime ScriptTMRT reagent Kit(Perfect Real Time,批号:RR037A)及TRIzol 试剂(批号:JMS12279)均购自日本TaKaRa 公司;实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪(型号:MiniAmp)购自赛默飞世尔科技(中国)有限公司。健康对照组于本院体检时于空腹12 h 状态下采集静脉血5 mL,心肺复苏成功组与心肺复苏失败组均于心搏骤停发生后心肺复苏过程中采集静脉血5 mL,心肺复苏成功组再于心肺复苏成功后24 h、48 h 采集静脉血5 mL。所有样本存于真空采集管中,4℃下3 000 r/min 离心10 min,分离血清装于Ependorf 管中,封管,-30 ℃保存待测。从-70 ℃冰箱中取出血清样本,解冻后按试剂盒说明书提取血清总RNA,异丙醇沉淀浓缩后,用75%酒精洗涤,干燥后加入100 μL 焦碳酸二乙酯水,检测所得RNA 纯度及完整度;按照逆转录试剂盒说明书将RNA 逆转录为cDNA,产物置于-20℃保存。qRT-PCR 反应(反应体系25 μL):cDNA(50 ng/μL)模板2 μL,缓冲液5 μL,10 mmol/L dNTP 0.5 μL,上下游引物各1 μL,1.5 U Taq 酶0.3 μL,水15.2 μL,每个样本设置3 个平行。上下游引物、内参基因由上海恒斐生物科技有限公司设计并合成,HIF-1α、HIF-2α 均以β-actin为内参,反应条件:95 ℃预变性10 min;94 ℃变性30 s、55 ℃退火30 s,72 ℃延伸1 min,30 个循环,每个循环72 ℃收集荧光。采用2-ΔΔCt法计算血清中HIF-1α、HIF-2α 相对表达量。HIF-1α、HIF-2α引物序列见表2。
1.2.3 随访及预后评价 随访观察起点为心肺复苏成功后即刻,终点为达到心肺复苏后6 个月或因各种原因死亡。通过电话随访,每30 d 随访1 次,记录患者死亡原因。以格拉斯哥预后评分[7](Glasgow Outcome Scale,GOS)为标准对患者进行疗效观察。1分:死亡;2 分:植物状态;3 分:无法独立生活,重度残疾,但意识清醒;4 分:恢复正常生活但略微残疾;5 分:恢复正常生活。将GOS≤3 分判定为预后不良亚组,GOS>3 分判定为预后良好亚组,比较两亚组HIF-1α、HIF-2α 表达水平。根据预后不良亚组患者测定出的HIF-1α、HIF-2α 平均值,将预后不良亚组患者分为HIF-1α 高表达者、HIF-1α 低表达者及HIF-2α 高表达者、HIF-2α 低表达者,统计其生存率以分析HIF-1α、HIF-2α 表达水平与生存率的关系。
1.3 统计学处理 采用SPSS 21.0 统计软件,计量资料以表示,多组比较采用方差分析,组间两两比较行SNK-q 检验;计数资料以百分率表示,比较采用χ2检验。采用Kaplan-Meier 法绘制心肺复苏治疗成功的心搏骤停患者6 个月的生存曲线并计算生存率,行Log-rank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组对象HIF-1α、HIF-2α 表达水平比较见表3。
由表3 可见,心肺复苏成功组复苏成功即刻,HIF-1α、HIF-2α 表达水平均低于心肺复苏失败组,均高于健康对照组,差异均有统计学意义(均P<0.05)。心肺复苏成功组复苏成功后24 h HIF-1α、HIF-2α 均低于复苏成功即刻,复苏成功48 h 更低,差异均有统计学意义(均P<0.05)。
2.2 预后良好亚组与预后不良亚组HIF-1α、HIF-2α 表达水平比较 见表4。
由表4 可见,预后良好亚组患者HIF-1α、HIF-2α 表达水平均低于预后不良亚组,差异均有统计学意义(均P<0.05)。
2.3 预后不良亚组患者的生存情况比较 预后不良亚组患者中HIF-1α 高表达者23 例,其中死亡16 例;低表达者10 例,死亡3 例,HIF-2α 高表达者25 例,其中死亡18 例;低表达者8 例,其中死亡1 例。见图1。
由图1 可见,HIF-1α 低表达者6 个月生存率为70.00%,高于高表达者(30.43%),差异有统计学意义(χ2=4.329,P<0.05);HIF-2α 低表达者6 个月生存率为87.50%,高于高表达者(28.00%),差异有统计学意义(χ2=7.557,P<0.01)。
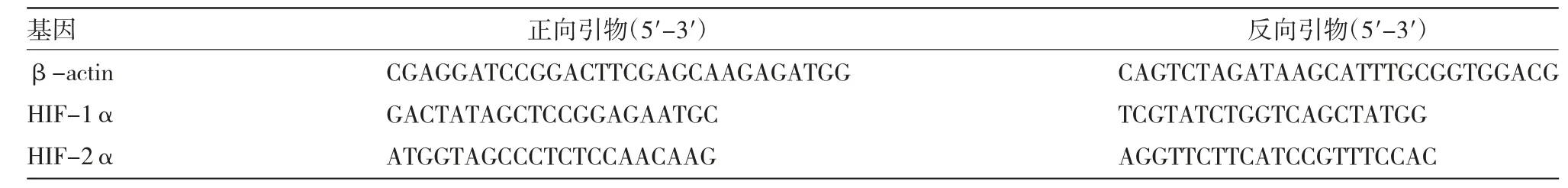
表2 qRT-PCR 引物序列

表3 3 组对象HIF-1α、HIF-2α 表达水平比较(pg/mL)

表4 预后良好亚组与预后不良亚组HIF-1α、HIF-2α表达水平比较(pg/mL)
3 讨论
心搏骤停是目前世界各国尤其是发达国家人群猝死的主要原因,随着心肺复苏技术理念的不断进步,人们对胸外按压质量、人工通气策略、电击除颤时机等认识的不断提高,越来越多的心搏骤停患者能够实现ROSC[8],有研究显示心肺复苏至ROSC时间越短越有利于患者存活[9],脑源性疾病和创伤性疾病引起的心搏骤停患者行心肺复苏病死率较高,能够在心搏骤停发生时尽早、及时、正确施行心肺复苏抢救,能够极大提高患者的生存率。但心搏骤停患者经心肺复苏实现ROSC 后仍有45%~70%的存活心搏骤停患者出现缺血缺氧性疾病,表现为严重神经功能受损甚至死亡[10]。目前缺乏有效评估心搏骤停患者心肺复苏后预后情况的指标。
HIF-1α 表达水平与缺氧程度密切相关[11],郭营波等[12]发现急性心肌梗死患者血清HIF-1α 水平明显低于健康对照组,检测血清HIF-1α 水平对评估急性心肌梗死患者预后具有临床价值。Ball 等[13]发现HIF-1α 是缺氧细胞中转录的主要调节因子,其上调涉及能量代谢、增殖和细胞外基质重组,而慢性缺氧条件下,平滑肌中的HIF-1α 有助于肺血管重构和肺动脉高压。HIF-2α 也是HIF 的一个亚基,夏宇等[14]认为相较于HIF-1α,HIF-2α 更易于与血管内皮生长因子的启动子结合,且可通过Norch 配体的表达促进血管重塑。也有学者发现HIF-2α 调控叉头框M1 蛋白表达明显增加,促进低氧大鼠肺动脉平滑肌细胞增殖[15]。本研究中心搏骤停患者心肺复苏术中血清HIF-1α、HIF-2α 水平均高于健康人群,但心肺复苏失败组血清HIF-1α、HIF-2α 水平高于成功组,提示HIF-1α、HIF-2α 与心肺复苏治疗成功与否有一定关系。另有研究结果显示HIF-1α 通过增强电刺激诱发的能量消耗从而调节缺血性肌肉恢复,HIF-2α 基因转移可促进肌肉结缔组织中毛细血管生长,且维持左心室功能[16]。本研究结果显示心肺复苏成功组复苏后24 h、48 h 血清HIF-1α、HIF-2α 水平呈下降趋势,且48 h 时血清HIF-1α、HIF-2α 水平基本恢复正常水平,估计此时患者缺血缺氧状况部分缓解。HIF-1α、HIF-2α 参与血管重建,促进平滑肌增殖,可促进神经恢复。但是HIFs 在免疫细胞中的表达除可由缺氧引发,也可由与病理性应激相关的其他因素(例如炎症等)触发,增强吞噬细胞能力、驱动T 细胞分化、提高细胞毒活性[17],HIFs 过度高表达可能会促进相关炎症因子表达,不利于患者术后恢复。郭异之等[18]通过研究发现重型颅脑损伤患者颅内脑组织处于缺血和缺氧状态,预后不良亚组患者HIF-1α 含量显著高于预后良好亚组,提示血清HIF-1α 浓度升高与神经血管损伤有关。本研究中心肺复苏术成功后预后不良患者血清HIF-1α、HIF-2α 水平高于预后良好的患者,且预后不良患者血清HIF-1α、HIF-2α 高表达者总生存率低于HIF-1α、HIF-2α 低表达者,提示心肺复苏术成功患者术后48 h 血清HIF-1α、HIF-2α 高表达者可能提示术后6 个月内预后不良,需加强监护,同时预防感染并保持患者呼吸道通畅,提高患者生存率。
综上所述,HIF-1α、HIF-2α 在心搏骤停患者心肺复苏成功后呈低表达,与预后良好有关,HIF-1α、HIF-2α 低表达患者生存率更高。本研究仍存在一定缺陷,如样本数较小、HIF-1α 与HIF-2α 表达是否存在相关性或共同作用机制,尚需进一步研究。