澜沧江中上游光唇裂腹鱼四个地理群体遗传多样性分析
2021-02-04金方彭李光华吴俊颉左鹏翔雷春云
金方彭 李光华 冷 云 吴俊颉 左鹏翔 雷春云
(云南省渔业科学研究院,昆明 650111)
近些年来,澜沧江中上游江段梯级水电站正在建设中,有的已经建成并完成蓄水发电,水电站的开发产生了巨大的经济效益,也促进了当地经济的发展,但对生态环境造成的影响也是不容忽视的,澜沧江中上游梯级水电站的开发隔断了流域水体,许多支流也被隔断了与澜沧江的联系,因而破坏了河流的连续性,造成鱼类栖息地片段化,将对其流域内特有的土著鱼类的群体遗传多样性产生很大的影响。
简化基因组测序是通过限制性内切酶测序的基因组DNA,获得大量遗传多态性标记序列,充分展示该物种全基因组的测序策略,该方法降低了基因组的复杂性、操作过程简单且成本低。同时还可以在不依赖参考基因组的情况下获得全基因组中的遗传多态性标签,因此被广泛应用于进化学和基因学[1],它主要是通过生物信息学来设计标记及开发程序,收集具有特异性长度的片段并利用高通量测序方法得到大量标记序列的测序方法,对部分基因组进行测序,代表目标物种全基因组信息的测序方法,目前该技术已经用于鱼类等生物间进化关系的研究,成效明显[2,3]。
光唇裂腹鱼(Schizothorax lissolabiatus,Tsao),隶属于鲤形目裂腹鱼属(Schizothorax),分布于澜沧江中上游,元江上游及南盘江,为产地常见土著鱼类[4],由于澜沧江梯级水电站的开发,光唇裂腹鱼自然群体数量也逐渐减少。目前对光唇裂腹鱼的研究主要有鱼病防治、人工驯养繁殖、肉质、空壳率和耐受性等方面。但对野生光唇裂腹鱼的遗传多样性方面的研究极少,本文主要采用简化基因组测序对光唇裂腹鱼变异位点、核苷酸多样性、等位基因数、观测杂合度、期望杂合度和近交系数等进行分析,以期了解澜沧江不同地理群体光唇裂腹鱼的遗传多样性,对光唇裂腹鱼种质资源方面的研究起到数据支撑作用,为今后光唇裂腹鱼进一步选育提供基础支撑。
1 材料与方法
1.1 实验材料
此次实验材料取自澜沧江中上游苗尾-功果桥库区、黄登-大华桥库区、里底江段和乌弄龙江段4个地理群体的野生样本(表1和图1)。光唇裂腹鱼体长(20±5)cm,体重(150±50)g,利用液氮将尾鳍进行固定,并及时放入-85℃度冰箱保存。

表1 澜沧江中上游采样点及采样时间Tab.1 Sampling sites and sampling time in the upper Lancang River
1.2 DNA的提取制备
本文采用传统的苯酚-氯仿法提取基因组DNA[5],DNA的提取质量和浓度用紫外分光光度法进行检测。将提取的基因组DNA在-20℃的冰箱中保存[16]。
根据Sun等[6]方法,构建SLAF-seq文库,本文选取锦鲤(Cyprinus carpio)基因组作为酶切预测的参考基因组,其基因组大小为1.71 Gb,GC含量37.00%,(ftp://ftp.ncbi.nlm.nih.gov/genomes/all/GCF/000/951/615/GCF_000951615.1_common_carp_genome/GCF_000951615.1_common_carp_genome_genomic.fna.gz),内切酶的选择原则是避免重复序列的内切酶片段且片段必须均匀地分布在基因组中。此外,酶切片段的数量与SLAF标签的预期数量保持一致。操作步骤如下:在限制性片段的3′端加上poly(A),连接一个双索引PCR扩增的特殊测序连接器。对目标片段进行纯化、混合、切割回收,Illumina Hiseq 2500用于双末端测序(PE100)。本文选用日本晴水稻(Oryza sativassp.japonica)的基因组(http://rapdb.dna.affrc.go.jp/)作为对照组,并将同一过程进行排序以评估建库的准确性。
1.3 数据处理
根据等位基因数量与基因序列的不同,筛选具有多态性的SLAF标记,以SLAF标记中序列深度最大的作为参考序列,利用bwa将测序reads比对到参考基因组上[7],并使用GATK和samtools两种方法开发SNP[8,9],最终会得到SNP标记交集,它便成为最终可靠的SNP标记数据集[10,11]。然后对所获得的SNP位点进行筛选,筛选为次要基因型频率(MAF)不小于0.05、完整度不小于0.8;满足以上条件的SNP最终用作光唇裂腹鱼的遗传结构和群体遗传多样性分析。
使用Power-Marker V3.25软件计算观测杂合度(Observed heterozygosity,Ho)、观测等位基因数(Observed allele number,No)、期望杂合度(Expected heterozygosity,He)、期望等位基因数(Expected allele number,Ne)和多态性信息含量(Polymorphism information content);光唇裂腹鱼的群体遗传结构利用Admixture软件[12,13]进行分析,个体间的亲缘关系用SPAGeDi软件[14]进行分析,聚类分析使用MEGA5[15]中Neighbor-Joining 算法进行。
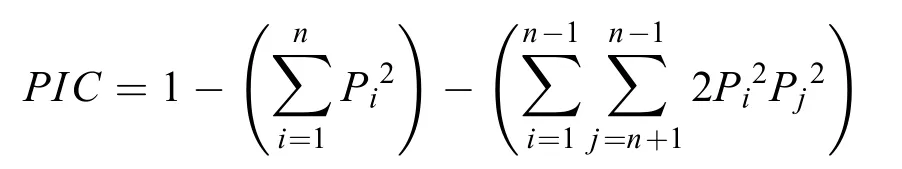
式中,n为某一位点上等位基因的数量,Pi、Pj分别为第i和第j个等位基因在群体中的频率,j=i+1。
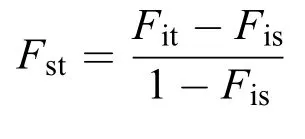
式中,Fis为地方群体的平均近交系数;Fst为有亲缘关系地方群体的平均近交系数;Fit为整个群体的平均近交系数。
2 结果
2.1 SLAF-seq酶切及建库分析
用限制性内切酶对锦鲤进行酶切预测,然后确定限制性内切酶组合RsaⅠ+HaeⅢ对光唇裂腹鱼进行酶切,目标片段长度为414—464 bp,每个样本平均获得134500个SLAF标签(表2)。为保证分析质量,采用读长为126 bp×2做数据的后续分析与评估,Control数据量为0.31 M reads。本次试验共得到240.29 M reads数据,Control数据双端率为94.32%,酶切效率为87.19%,SLAF建库正常。Q30平均为94.96%,GC含量平均为39.80%。reads比对率均大于70%,表明实验过程没有污染,插入片段长度呈正态分布(图2),建库正常。

图1 澜沧江中上游采样点Fig.1 Sampling points in the upper and middle reaches of Lancang River
按对照双端比对序列在基因组中的位置,计算SLAF标签的实际读长,绘制控制读长插入片段的长度分布图[16]。
2.2 光唇裂腹鱼SNP标记开发
SLAF标签和SNP信息统计 本实验平均测序深度为255.2553X,共获得474390个SLAF标签,共得到1151083个SNP,SNP完整度:31.54%—45.37%,平均完整度为36.66%,SNP的杂合率:5.55%—14.1%,平均杂合率为9.5%(表2)。

表2 样品SLAF标签和SNP信息统计Tab.2 SLAF number and SNP information statistics of sample
2.3 遗传多样性分析
4个采样点的遗传多样性使用Arlequin软件进行分析,基于过滤后的SNP(过滤掉完整度小于0.5,第二等位基因频率小于0.05的SNP)计算各组的核酸多样性指数。序列变异位点的转换在鱼类近亲中能够更频繁的发生,而远亲物种中更容易发生的是颠换,同一物种不同个体之间,转换是在嘌呤和嘌呤之间的替换,或嘧啶和嘧啶之间的替换,颠换是在嘌呤和嘧啶之间的替换[17]。对4个地理群体的转换、颠换数以及替换数作显著性方差分析,结果显示F(112.31)>Fcrit(4.46)且P(1.40E-06)<0.01,转换、颠换和替换数在4个地理群体之间均呈现显著性差异:每个地理群体的转换、颠换和替换数之间F(13.75)>Fcrit(3.84)且P(0.0012)<0.01也呈现显著性差异。苗尾-功果桥、黄登-大华桥、里底和乌弄龙4个地理群体都是转换大于颠换(表3)。其中,乌弄龙地理群体的私有变异位点为5716,远远高于其他3个地理群体,证明在乌弄龙地理群体中存在较大变异。核苷酸多样性总价值以乌弄龙地理群体最大,苗尾-功果桥次之,里底再次,黄登-大华桥最小。

续表 2

图2 插入片段分布图Fig.2 Controlreads reads insertion fragment distribution diagram
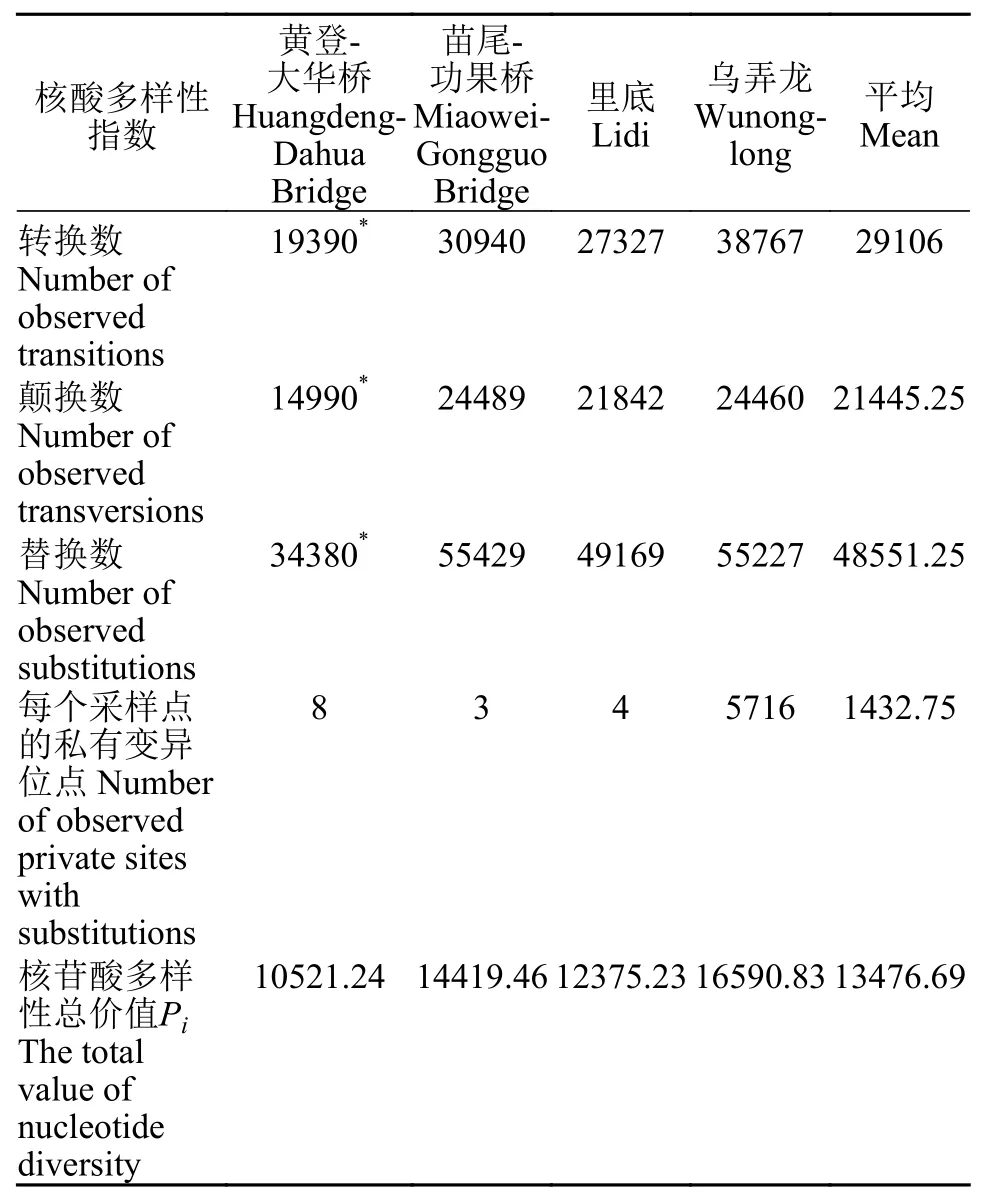
表3 核酸多样性指数Tab.3 Nucleic aeid diversity index
根据4个分组,分别提每个分组的SNP,之后过滤掉完整度小于0.5,第二等位基因频率小于0.05的SNP;用过滤后的SNP基于公式计算各分组的遗传多样性指数,苗尾-功果桥、黄登-大华桥、里底和乌弄龙4个采样点的观测等位基因数均为2;期望等位基因数、观测杂合度和期望杂合度(基因多样性)均是乌弄龙地理群体最大(1.5029、0.3131和0.3115);多样性指数里以底地理群体最大(0.3248),香浓指数和多态性信息含量(PIC)均以乌弄龙地理群体最大(0.4811和0.2553),次要基因频率以里底地理群体最大(0.2216)详见表4。对不同地理群体的观测等位基因数、期望等位基因数、观测杂合度、期望杂合度、多样性指数、香浓指数、多态信息含量(PIC)做显著性分析,结果显示F(55.06)>Fcrit(3.29)且P(2.49E-08)<0.01,呈显著性差异。
计算:
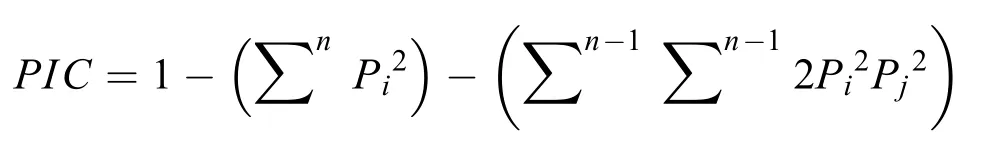
2.4 群体间遗传分化分析
群体间遗传距离根据测序结果60尾光唇裂腹鱼样本间的遗传距离介于0.05—0.15,群体间成对Fst值(表5)表明,里底-乌弄龙群体的分歧最大(0.12985),苗尾、功果桥-乌弄龙群体分歧最小(-0.01496),平均为0.07629,显著平均水平P=0.005,说明Fst值均达到显著性水平(P<0.05)。

式中,Fis为地方群体的平均近交系数;Fst为有亲缘关系地方群体的平均近交系数;Fit为整个群体的平均近交系数。
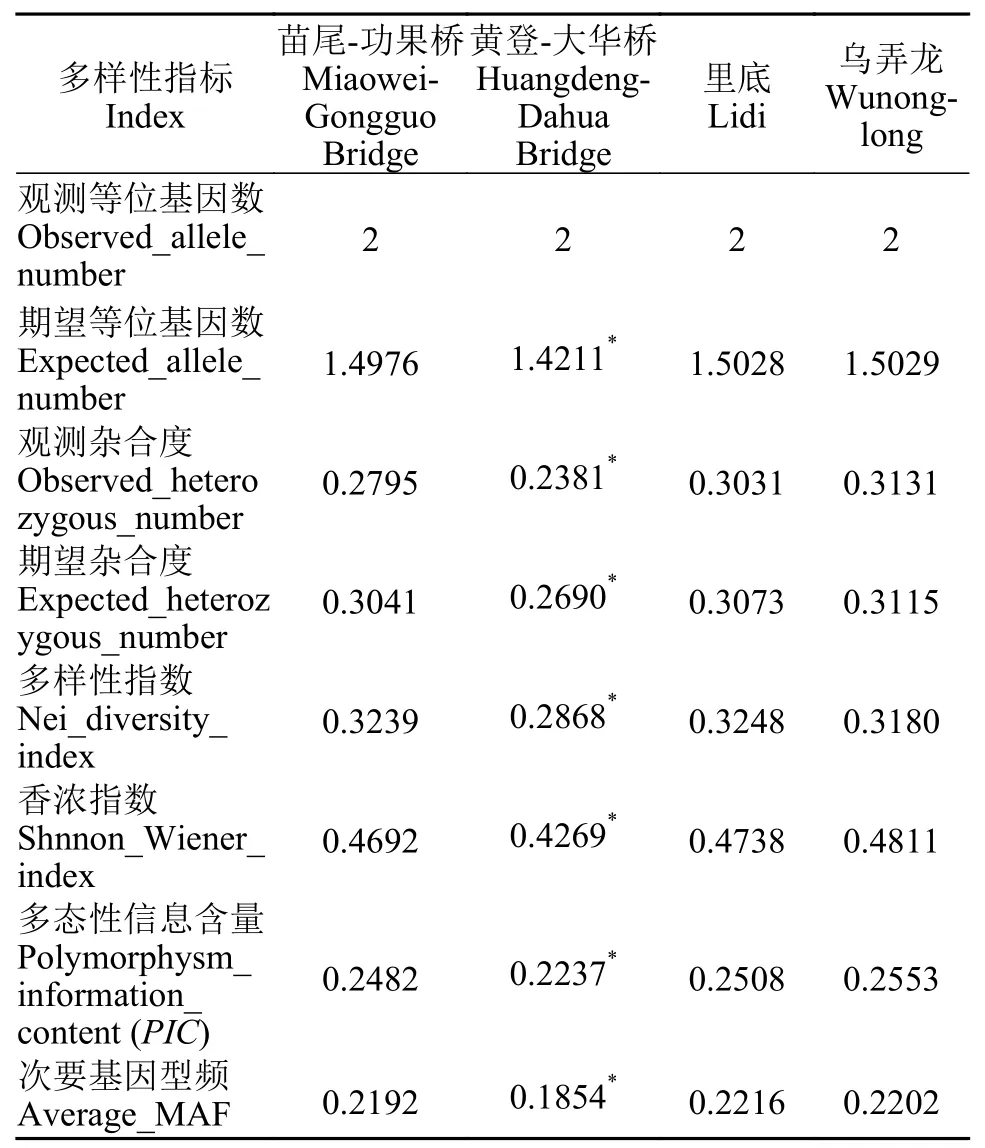
表4 遗传多样性分析Tab.4 Genetic diversity analysis
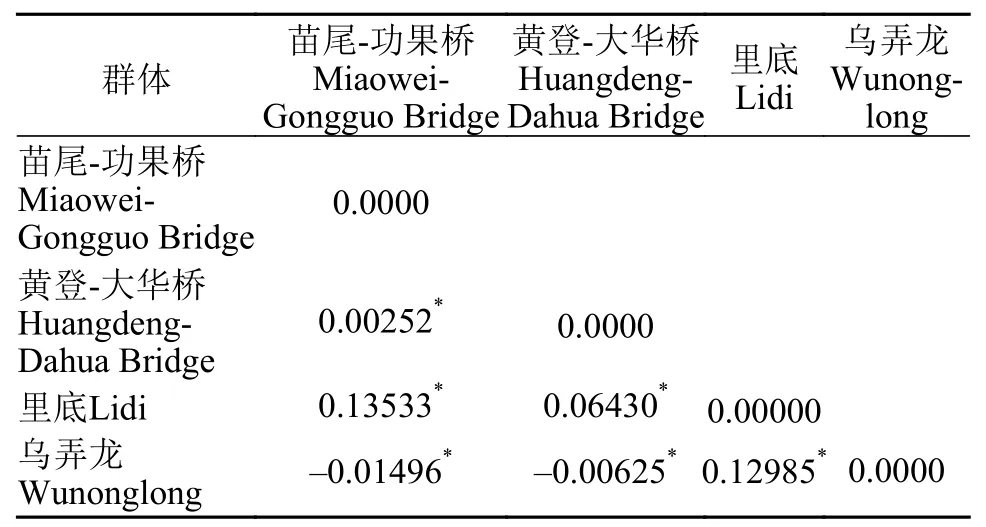
表5 光唇裂腹鱼4个群体间的遗传分化指数Tab.5 Genetic differentiation index among 4 populations of Schizothorax lissolabiatus Tsao
群体间聚类分析由图3可以看出,苗尾-功果桥、黄登-大华桥和里底3个地理群体的个体间相互交叉聚类,乌弄龙地理群体的各个个体聚为一支。这表明苗尾-功果桥群体、黄登-大华桥群体和里底群体间遗传关系更接近,乌弄龙群体与它们有相对较远的遗传距离。黄登-大华桥群体、里底群体里的个体出现少数几个和乌弄龙群体交叉聚类的情况。

图3 光唇裂腹鱼自然群体进化树Fig.3 Natural population evolution tree of Schizothorax lissolabiatus Tsao
群体间分子变异分析对光唇裂腹鱼4个地理群体的控制区序列作分子生物学方差分析(AMOVE),结果显示,群体遗传分化指数Fst=0.10273(P>0.01),群体间的变异占10.27%,表明遗传分化较少发生在群体间。群体内的变异占89.73%,表明遗传分化主要发生在每个群体内部(表6)。
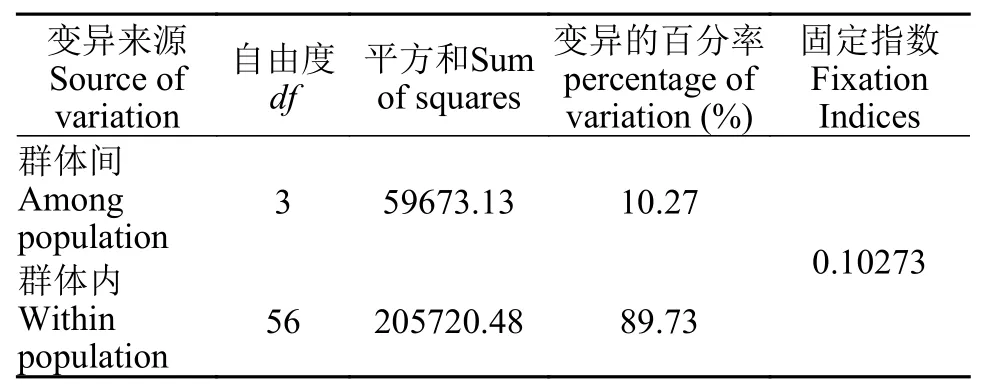
表6 光唇裂腹鱼4个自然地理群体基于简化基因组位点的分子变异分析(AMOVE)Tab.6 Molecular variation analysis(AMOVE)of four natural geographic populations of Schizothorax lissolabiatus Tsao based on simplified genomic loci
3 讨论
3.1 变异位点分析
有研究表明,序列变异位点的转换在鱼类的近亲中更频繁发生,而远亲物种中更容易发生颠换,在同一物种不同个体之间,转换通常比颠换多,比例为5﹕1,有的甚至高达10﹕1[18,19]。本研究发现,光唇裂腹鱼转换(Ti)与颠换(Tv)的比值大于1,证明光唇裂腹鱼转换发生率大于颠换,mtDNA 控制区的变异更多的发生在嘌呤与嘌呤或者嘧啶与嘧啶之间,而嘌呤与嘧啶或嘧啶与嘌呤之间的颠换则较少发生。每个采样点的私有变异位点显示,在4个地理群体中,群体变异位点大小依次为乌弄龙(5716)>苗尾-功果桥(8)>里底(4)>黄登-大华桥群体(3),乌弄龙群体的变异位点远远高于其他3个地理群体,说明乌弄龙地理群体中存在的变异大。
对光唇裂腹鱼4个地理群体的控制区序列作分子变异分析(AMOVE)表明,群体间的变异占10.27%,群体内的变异占89.73%,表明遗传分化主要发生在每个群体内部,群体间虽无显著遗传分化,但还是一直有发生群体间的遗传分化,与Fst分析结果相吻合。与同为裂腹鱼属的塔里木裂腹鱼(群体内变异81.01%,群体间变异占16.68%)相比较,群体内变异程度稍高,群体间的变异程度没有塔里木裂腹鱼高[25]。
3.2 遗传多样性分析
遗传多样性是物种进化潜力的重要指标。遗传多样性越高,物种适应环境变化的能力越强,进化潜力越大[20,21]。多态信息含量(PIC)主要是衡量基因位点群体多态性的重要指标,它能够反映群体的遗传变异程度,当多态信息含量(PIC)大于0.5时,该位点为高度多态性位点;当多态信息含量(PIC)小于0.25时,该位点为低度多态性位点,当多态信息含量(PIC)大于0.25且小于0.5时,该位点为中度多态位点[22—24]。本研究4个地理群体中,除黄登-大华桥地理群体表现为低度多态性,其余3个地理群体均表现为中度多态性,这些中度多态的标记为今后遗传多样性的进一步分析以及未来光唇裂腹鱼遗传连锁图谱的构建有着重要的意义。另外,核苷酸多样性(Pi)的分析时,Pi需要除以序列总长度才可以得到,但是无参序列总长不好定义,每个群的序列长度基本是一样的,所以可以直接比较该值。
平均杂合度是群体在检测到的位点上的杂合子频率,用于检测群体内的遗传变异,可以度量群体的杂合程度。杂合度的高低和遗传多样性与群体对环境的适应能力呈正相关[22],本研究中4个地理群体的观测杂合度和期望杂合度均是乌弄龙地理群体(0.3131和0.3115)最大,黄登-大华桥群体(0.2381和0.2690)最小。4个地理群体平均观测杂合度和期望杂合度为(0.2695和0.2892),与同一属的短须裂腹鱼相比较(0.2007和0.3160)[20]相比较,杂合度较低,遗传变异程度低,对环境的适应能力差。
多样性指数是群落丰富度指标,该指数越高,群落越稳定;香浓指数是用来反应群体的多样性的高低,指数越大,多样性越高[21]。本研究光唇裂腹鱼四个地理群体的多样性指数在0.2868—0.3248,说明4个群体多样性指数低,群体多样性不稳定,香浓指数在0.4269—0.4811,与同属的短须裂腹鱼(遗传多样性指数为0.3386,香浓指数为0.4827[19]),遗传多样性指数和香浓指数均较低,说明群体多样性偏低。就群体之间看来,乌弄龙群体的多样性最高,可能是乌弄龙群体收人工干扰少的缘故。
3.3 遗传分化分析
根据Thorp的一系列研究,当遗传距离大于0.05且小于0.3时为同种不同群体;遗传距离大于0.3且小于0.9时为同属不同种;遗传距离大于0.9为不同属[21]。本研究中60个样本的遗传距离介于0.05—0.15,说明研究对象为同种不同群体。根据评价标准,当0<Fst<0.05时,表现为低等分化水平;当0.05<Fst<0.15时,表现为中等分化水平;当Fst>0.15时,表现为高等分化水平[23]。本研究中,群体间遗传分化指数在-0.01496—0.12985,与同属的墨脱裂腹鱼(遗传分化指数-0.014—0.771)相比较,遗传分化指数较低[26]。群体间分化指数均值为0.07629,分化程度处于中等水平。除苗尾-功果桥、乌弄龙、黄登-大华桥和乌3个群体间分化处于低等水平外,其他群体间分化都处于中等水平。
4个群体的聚类进化结果表明,地理位置较近且想连续的苗尾-功果桥、黄登-大华桥和里底3个地理群体相互交叉聚类,乌弄龙地理群体聚为一支,这说明地理分布差距和遗传距离呈正相关,随着距离的变大,遗传距离也随之增大[24],由此可见,地理距离对光唇裂腹鱼自然群体的遗传分化程度有较大的影响,地理位置靠近,相互间基因交流较多,遗传分化程度较低[23]。此结论与群体间遗传分化程度的分析结果一致。此外,乌弄龙群体与它们有相对较远的遗传距离,黄登-大华桥群体和里底群体里的个体出现少数几个和乌弄龙群体交叉聚类的情况。这可能是2013年以来鱼类增殖放流活动造成的,黄登鱼类增殖放流站2013年以来承担着大华桥、黄登、拖巴、里底及乌弄龙的人工增殖放流任务,特别是近3年以来,连续开展增殖放流活动,这可能就与黄登-大华桥、里底和乌弄龙3个地理群体出现个别交叉聚类相关(表7)。就地理位置来看,苗尾-功果桥、黄登-大华桥和里底3个点是相互连续的,且样品采集时电站还没开始蓄水,因此交叉聚类也符合实际情况。
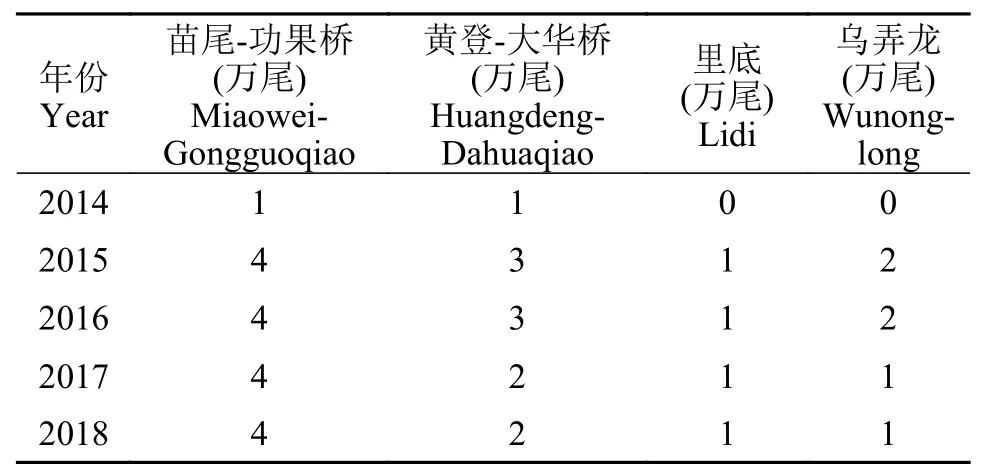
表7 各采样点2014年以来增殖放流数量Tab.7 The number of breeding and releasing streams at different collection points from 2014 to 2018
