虾青素对过氧化氢诱导的骨髓间充质干细胞氧化应激的保护作用
2021-02-04李露壮姜衍徐爱华辛昊王京杨孙永新
李露壮,姜衍,徐爱华,辛昊,王京杨,孙永新
(中国医科大学 1.附属第一医院康复医学科;2.附属第一医院药学部,沈阳 110001;3.口腔医学专业102期,沈阳 110122)
骨髓间充质干细胞(bone marrow messenchymal stem cell,BMSC)是从骨髓中分离出的具有强大增殖和分化能力的多能干细胞[1]。近年来,BMSC广泛用于治疗骨骼肌肉疾病,包括骨与肌腱软骨再生和骨不连等。由于病变组织局部活性氧增加及清除失衡[2]而产生氧化应激微环境,导致细胞在移植后大量死亡,从而极大影响了疾病预后。因此,探索移植后BMSC抗氧化应激和抗凋亡的方法,是促进BMSC移植后存活的关键[3]。虾青素是一种安全无毒的脂溶性、橙红色类胡萝卜素,在生物体内发挥抗氧化、抗炎、抗凋亡等多种作用[4]。氧化应激可能通过核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)/抗氧化响应元件(antioxidant response element,ARE)信号通路诱导细胞凋亡[5-6]。
本研究采用过氧化氢(H2O2)诱导BMSC建立氧化应激模型,通过检测细胞存活率、细胞凋亡率、还原型谷胱甘肽(glutathione,GSH)含量、超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(malonyldialdehyde,MDA)含量及Nrf2/ARE通路相关蛋白表达量的改变,探讨虾青素对体外BMSC氧化应激模型的预保护作用及可能的机制。
1 材料与方法
1.1 材料
1.1.1 细胞:人BMSC细胞株(中国科学院细胞库)。
1.1.2 试剂:虾青素标准品、CCK-8检测试剂、MDA检测试剂盒、SOD检测试剂盒、GSH检测试剂盒、30%H2O2溶液、ECL显影液(北京索莱宝公司);二甲基亚砜(美国Sigma公司);DMEM高糖培养基(美国Gibco公司);胰蛋白酶(中国Genview公司);胎牛血清(中国四季青公司);Nrf2抗体、血红素加氧酶-1(heme oxygenase 1,HO-1)抗体、还原型辅酶/醌氧化还原酶1(quinone oxidoreductase 1,NQO1)抗体(美国ABclonal公司);Annexin V-FITC细胞凋亡检测试剂盒(中国诺唯赞公司)。
1.1.3 仪器与设备:CO2恒温培养箱、酶标仪(美国Therom公司);电泳仪(美国Bio-Rad公司);台式高速低温离心机(美国Sigma公司);流式细胞仪(美国Beckman Coulter公司);显微镜(日本Nikon公司);25 cm2培养瓶、6 cm培养皿、6孔板、96孔板(澳大利亚BEAVER公司)。
1.2 实验方法
1.2.1 细胞培养:将人BMSC接种于25 cm2培养瓶,加入含10%胎牛血清、1%双抗的DMEM高糖培养基,置于37 ℃、5%CO2恒温培养箱培养。细胞生长到80%~90%融合时传代,用0.25%胰蛋白酶消化,按1∶3比例传代,选取对数生长期细胞进行后续实验。
1.2.2 细胞存活率实验:
1.2.2.1 建立H2O2诱导的BMSC氧化应激模型 将培养的BMSC以1×104/mL的密度接种于96孔板,每孔180 μL,在37℃、5%CO2恒温培养箱中培养12 h后,分别用0、100、200、300、400、500、600 μmol/L的H2O2溶液处理,每组设置3个复孔。处理24 h后CCK-8法检测细胞存活率,吸去旧培养液,每孔加入90 μL新鲜培养基,再加入10 μL CCK-8溶液,继续培养3 h。酶标仪检测450 nm处各孔的吸光值。
1.2.2.2 虾青素预保护BMSC的最佳浓度范围 将培养的BMSC接种于96孔板,分别用含0、12.5、25、50、100、200、400、800、1 600、3 200 μmol/L的虾青素培养液处理,24 h后CCK-8法检测细胞存活率,方法同1.2.2.1。确定虾青素预保护最佳浓度范围。
1.2.2.3 虾青素对H2O2诱导的BMSC氧化应激的保护作用 将培养的BMSC接种于96孔板,分别用0、25、50、100、200 μmol/L的虾青素预保护2 h,之后用500 μmol/L H2O2诱导24 h,CCK-8法检测细胞存活率,方法同1.2.2.1。对照组(0 μmol/L)细胞存活率设为100%,细胞存活率(%)=(A加药组-A空白)/(A对照组-A空白)×100。
1.2.3 氧化应激相关酶活性检测:BMSC接种于6孔板,密度为1×105/mL,细胞培养至贴壁后,分为对照组、虾青素组、H2O2组、虾青素+H2O2组。虾青素组使用200 μmol/L虾青素溶液处理BMSC 2 h,H2O2组使用500 μmol/L H2O2溶液诱导BMSC 24 h,虾青素+H2O2组使用200 μmol/L虾青素预保护BMSC 2 h后再使用500 μmol/L H2O2诱导24 h。细胞消化后1 000 r/min低速离心,收集细胞沉淀,加入提取液,超声震碎细胞,8 000g、4 ℃离心10 min。根据试剂盒说明书,分别检测细胞SOD活性和GSH含量。细胞消化后,收集细胞沉淀,加入3倍沉淀体积的提取液重悬细胞,反复冻融2~3次,8 000g、4 ℃离心10 min,收集上清,根据试剂盒说明书检测MDA含量。独立实验重复3次。
1.2.4 细胞凋亡率检测:BMSC接种于6 cm培养皿,细胞分组同1.2.3。收集细胞,用预冷PBS冲洗2次,1 mL结合缓冲液重悬细胞,300g离心10 min,弃上清,用1 mL结合缓冲液重悬细胞,使细胞密度达到1×106/mL。取流式测定管,每管加100 μL细胞溶液,再加入5 μL Annexin V-FITC,避光室温染色10 min,再加入5 μL碘化丙啶,避光室温孵育5 min,加PBS至500 μL,1 h内在流式细胞仪上检测,应用Flowjo10软件分析。独立实验重复3次。
1.2.5 Western blotting:细胞接种于6 cm培养皿,细胞分组同1.2.3。用预冷的PBS清洗3次,冰上加蛋白裂解液RIPA,用清洁的细胞刮收集细胞,4 ℃、12 000g离心15 min,收集上清,置于冰上待用。BCA试剂盒测定蛋白浓度。调节蛋白浓度,制备10%分离胶、5%浓缩胶,SDS-PAGE电泳,将蛋白转移至PVDF膜上。用5%牛血清白蛋白封闭1 h。TBST摇床洗膜3次后,一抗孵育。一抗为兔源Nrf2抗体(1∶2 000稀释)、兔源HO-1抗体(1∶1 500稀释)、兔源NQO1抗体(1∶1 500稀释),4 ℃过夜。TBST摇床洗膜3次后,加入二抗室温孵育1 h,二抗为羊抗兔IgG(1∶5 000稀释)。电化学发光显影,应用Image J软件分析灰度值。
1.3 统计学分析
所有实验均重复3次。应用SPSS 21.0软件进行统计分析,数据以表示,多组间比较采用单因素方差分析,2组间比较采用t检验。P< 0.05为差异有统计学意义。
2 结果
2.1 虾青素预保护对H2O2诱导的BMSC存活率的影响
2.1.1 H2O2诱导BMSC建立氧化应激模型:BMSC经H2O2诱导后,细胞存活率明显下降,呈浓度依赖性,H2O2浓度越大,细胞存活率越低(图1A),且存活率随H2O2诱导时间延长而下降(图1B)。500 μmol/L H2O2诱导24 h时,细胞存活率约为对照组的50%~60%(P< 0.05)。因此,后续实验选择500 μmol/L H2O2诱导24 h建立H2O2诱导氧化应激模型。

图1 建立H2O2诱导的BMSC氧化应激模型Fig.1 Model of H2O2-induced oxidative stress in BMSCs
2.1.2 虾青素预保护细胞最适浓度范围:用0~3 200 μmol/L的虾青素溶液处理BMSC 24 h,采用CCK-8法检测细胞存活率。结果表明,25~200 μmol/L的虾青素浓度为安全处理范围,与对照组相比,BMSC存活率的差异有统计学意义(P< 0.05)。确定虾青素预保护最适浓度范围为25~200 μmol/L。见图2。
2.1.3 虾青素预保护提高H2O2诱导的BMSC存活率:选取最适浓度范围(25、50、100、200 μmol/L)的虾青素预保护2 h,之后用500 μmol/L的H2O2诱导24 h。结果显示,不同浓度的虾青素预保护组与H2O2组比较,BMSC的存活率均明显升高(P< 0.05);200 μmol/L虾青素预保护组与H2O2组比较,BMSC的存活率明显升高(P< 0.05)。显微镜下观察细胞形态,也证实200 μmol/L虾青素预保护组BMSC存活率最高,因此后续试验选择200 μmol/L浓度作为预保护浓度。见图3。
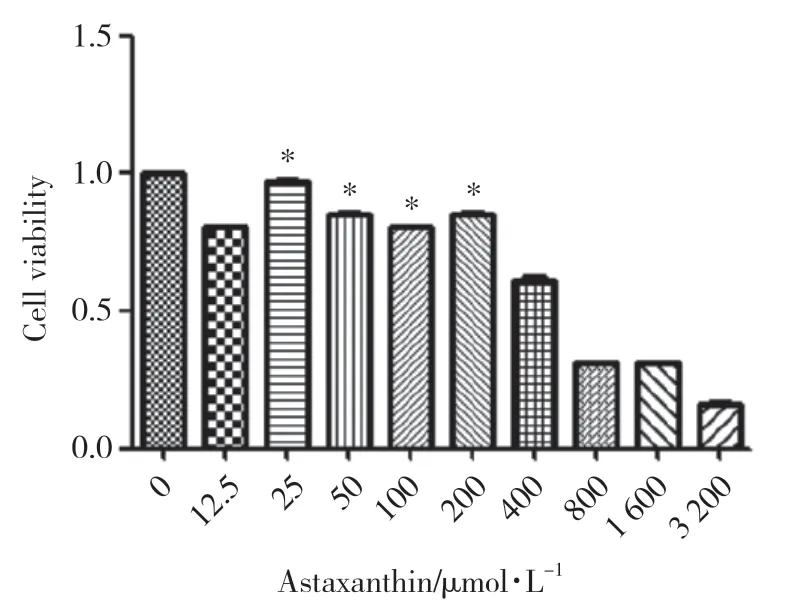
图2 不同浓度虾青素对BMSC存活率的影响Fig.2 Viability of BMSCs treated with varying concentrations of astaxanthin
2.2 氧化应激相关酶活性的检测

图3 虾青素预保护对H2O2诱导的BMSC存活率的影响Fig.3 Effect of astaxanthin pretreatment on the viability of BMSCs subjected to H2O2-induced oxidative stress
结果显示,H2O2组的SOD活性和GSH含量较对照组下降(P< 0.05),MDA含量较对照组明显升高(P<0.05);虾青素+H2O2组SOD活性和GSH含量较H2O2组明显升高(P< 0.05),MDA含量较H2O2组明显下降(P< 0.05)。见图4。
2.3 虾青素对H2O2诱导的BMSC凋亡的影响
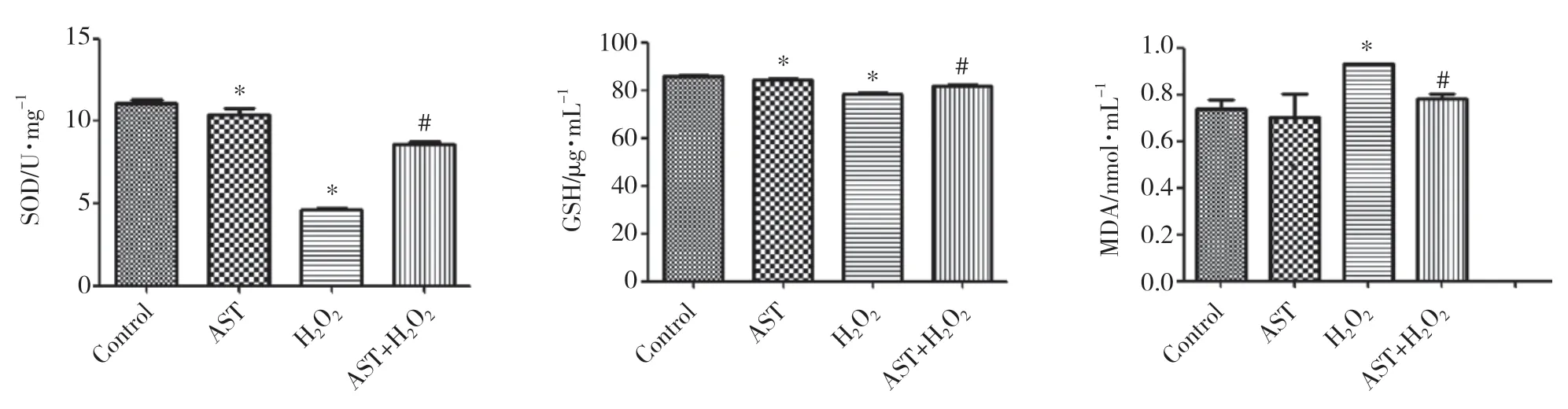
图4 虾青素对H2O2诱导的BMSC中SOD、GSH、MDA的影响Fig.4 Effect of astaxanthin on SOD,GSH,and MDA levels in BMSCs subjected to H2O2-induced oxidative stress
为探究虾青素预保护对H2O2诱导的BMSC凋亡是否有保护作用,使用Annexin V-FITC/PI凋亡试剂盒和流式细胞仪进行检测。结果显示,H2O2组(59.6%)与对照组(2.7%)比较,细胞凋亡率升高(P<0.05);虾青素+H2O2组(17.3%)与H2O2组(59.6%)比较,细胞凋亡率明显下降(P< 0.05)。见图5。
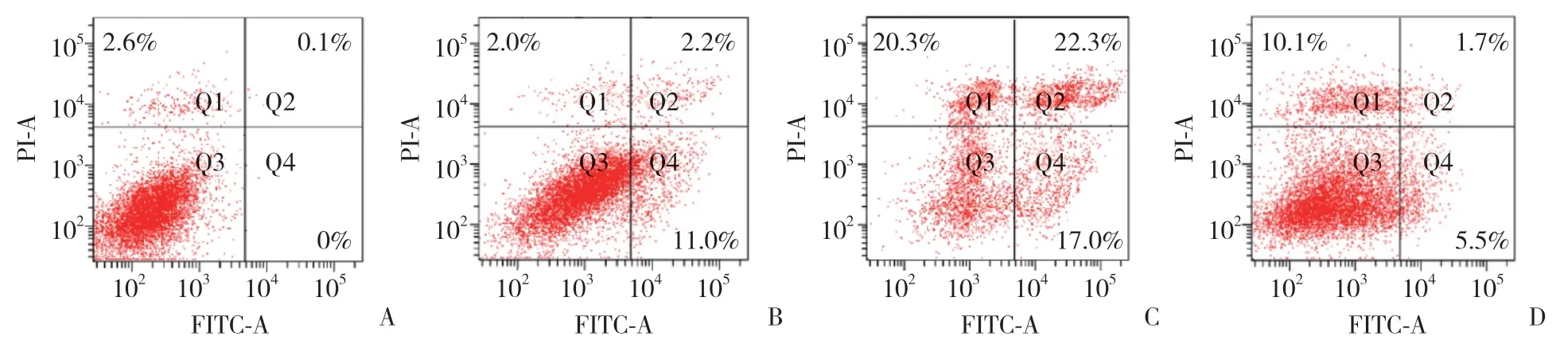
图5 虾青素对H2O2诱导的BMSC凋亡的影响Fig.5 Effect of astaxanthin on apoptosis in BMSCs subjected to H2O2-induced oxidative stress
2.4 虾青素通过Nrf2/ARE信号通路对H2O2诱导的BMSC发挥保护作用
采用Western blotting检测Nrf2、HO-1、NQO1蛋 白表达水平。结果显示,与对照组相比,H2O2组Nrf2、HO-1、NQO1蛋白表达均明显降低(P< 0.05);虾青素+H2O2组Nrf2、HO-1、NQO1蛋白表达较H2O2组均明显升高(P< 0.05)。说明虾青素预保护能够促进Nrf2、HO-1、NQO1蛋白的表达,其保护机制可能是激活了Nrf2/ARE信号通路。见图6。

图6 虾青素通过激活Nrf2/ARE信号通路保护H2O2诱导的BMSC氧化应激损伤Fig.6 Astaxanthin protects BMSCs from H2O2-induced oxidative stress via the Nrf2/ARE signaling pathway
3 讨论
BMSC具有较强的再生和分化能力,在组织修复和再生中具有重要作用[7]。然而,移植后细胞存在于氧化应激微环境会导致其死亡,这一直是研究面临的问题[8]。目前研究表明,辅酶Q可在体外保护BMSC氧化应激导致的凋亡,降低脊髓损伤大鼠的氧化应激环境[9];青蒿素通过激活c-Raf-Erk1/2-p90rsk-CREB通路对大鼠BMSC氧化应激凋亡有保护作用[10];石斛酚通过PI3K/Akt通路降低H2O2诱导的BMSC氧化损伤[11]。
虾青素最主要的生物学作用是抗氧化作用,其通过独特的分子结构,清除自由基和淬灭单线态氧[12],在各组织器官中均发挥抗氧化作用[13],具有极大的医学潜力。氧化应激是由于氧化剂MDA和抗氧化剂SOD-GSH之间不平衡导致[9]。本研究中,虾青素预保护组较H2O2组SOD活性和GSH含量明显提高,MDA含量下降,表明虾青素具有抗氧化应激的能力。细胞凋亡检测结果显示,虾青素预保护组较H2O2组细胞凋亡率明显下降。
Nrf2/ARE信号通路被认为是细胞抗氧化应激的主要信号通路。Nrf2是一种在多种细胞中表达的碱性亮氨酸拉链转录因子[14],参与调节多种抗氧化酶表达。正常生理状态下,细胞质中的Nrf2与keap1结合,呈无活性状态;当受到活性氧等刺激时,Nrf2与keap1脱离,转移至细胞核而激活,与ARE结合,激活HO-1、NQO1等抗氧化酶的转录和表达,从而抵抗外界刺激[15]。本研究采用虾青素预保护H2O2诱导的BMSC,结果表明,虾青素能够提高细胞内SOD活性和GSH含量、降低MDA含量、降低细胞凋亡水平、提高细胞存活率。进一步研究结果显示,虾青素组的Nrf2通路被激活,Nrf2、HO-1、NQO1蛋白表达较H2O2组显著升高。因此,虾青素的保护机制可能通过激活Nrf2/ARE信号通路实现。
综上所述,虾青素通过Nrf2/ARE信号通路对氧化应激环境下的BMSC起抗凋亡和抗氧化作用。可用于干细胞移植疗法中提高BMSC存活率,提高干细胞移植治疗效率,为干细胞治疗骨再生提供了新思路。
