超声在急性呼吸窘迫综合征围静脉-静脉体外膜氧合期中的应用价值
2021-02-04郭锋伟白晓芳董亚玲尚佳楠刘淼淼阮骊韬
宋 艳 郭锋伟 白晓芳 陈 红 董亚玲 尚佳楠 刘淼淼 张 颖 师 桃 闫 炀 阮骊韬
对于常规机械通气及药物治疗无效的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者,静脉-静脉体外膜氧合(veno-venous extracorporeal membrane oxygenation,VV ECMO)是一种公认有效的治疗方法[1],但其操作复杂,存在出血、血栓栓塞等较大风险。超声可及时明确插管位置,迅速判断有无插管并发症[2],在围V-V ECMO 期的应用越来越受到重视,但目前有关其应用的报道较少。本研究通过分析我院13例应用V-V ECMO 支持治疗救治的ARDS 患者的资料,初步探讨超声在围V-V ECMO 期的临床应用价值,以期降低并发症的发生率,提高救治成功率。
资料与方法
一、临床资料
选取 2018 年 4 月至 2019 年 8 月在我院就诊的 ARDS 患者13例,其中男11例,女2例,年龄36~73岁,平均(52.33±12.32)岁。均因ARDS 病情需要行V-V ECMO 支持治疗,其中重症细菌性肺炎9 例,肺移植术后4 例。所有患者均无未修复的主动脉夹层、各瓣膜重度关闭不全、先天性心脏病、心包填塞等V-V ECMO 支持治疗禁忌症。本研究经我院医学伦理委员会批准,所有患者家属均知情同意。
二、仪器与方法
1.仪器:使用Philips CX 50 彩色多普勒超声诊断仪,S5-1心脏探头,频率1~5 MHz;L12-3高频探头,频率7~10 MHz;C5-1腹部探头,频率3.5~5.0 MHz。
2.V-V ECMO 插管前评估心脏功能和外周血管。①评估心脏功能:根据美国超声心动图协会(American Society of Echocardiography,ASE)指南[3],应用双平面 Simpson 法测量左室整体收缩功能,并对其进行分级:男性,左室整体收缩功能52%~72%为正常,41%~51%为轻度异常,30%~40%为中度异常,<30%为重度异常;女性,54%~74%为正常,41%~53%为轻度异常,30%~40%为中度异常,<30%为重度异常。应用三维右室定量分析法(right ventricular quantification ,RVQ)评估右室功能,测量右室射血分数(≥45%为正常,<45%为异常)、三尖瓣瓣环运动位移(TAPSE,≥17 mm 为正常)及右室面积变化率(FAC%,≥35%为正常)。②评估外周血管:包括双侧颈内静脉、股静脉、髂静脉及下腔静脉是否存在先天性狭窄、血栓形成、静脉瓣冗长等异常,以免导致插管失败。根据患者血管情况选取合适的插管路径。
3.V-V ECMO 插管过程中监测相关心脏并发症和套管末端位置。V-V ECMO 插管方法参考文献[4],根据患者身高、体质量选择合适套管型号。
4.V-V ECMO 支持治疗期间监测相关并发症及血管。若临床表现为低氧血症等,则可能提示套管位置不正确,此时需评估套管末端位置;此外,需常规评估是否发生静脉血栓形成,包括套管周围血栓、下肢深静脉血栓及下腔静脉血栓形成。
5.脱机后监测并发症,包括静脉管腔内的血栓及栓塞。
结 果
一、患者一般情况
所有患者均使用单腔套管,采用颈内静脉-股静脉入路插管,颈内静脉为流入端,股静脉为流出端。颈内静脉套管型号均为19 Fr,股静脉套管型号均为21 Fr。V-V ECMO 支持治疗平均时间为10 d。
13 例患者中,12 例患者存活至脱机,1 例患者在V-V ECMO 辅助支持治疗期间死亡;8 例患者存活至出院,4 例因多器官功能衰竭死亡。
二、超声在V-V ECMO插管前的评估
1.评估心脏功能:插管前右室收缩功能正常9例,异常4例;左室收缩功能正常12例,异常1例(轻度减低)。
2.评估血管:所有患者双侧颈内静脉、股静脉、髂静脉及下腔静脉均正常,无明显血栓形成,且血管腔内径显著大于所选套管内径。根据血管评估结果,选择右侧颈内静脉-右侧股静脉入路插管10例,右侧颈内静脉-左侧股静脉入路插管3例。
三、超声在V-V ECMO插管过程中的监测
1.监测相关心脏并发症:在插管过程中所有患者均未发生插管相关心脏并发症。
2.监测穿刺插管及套管末端位置:所有患者颈内静脉及股静脉插管首次均未穿刺正确。超声心动图监测套管末端位置,提示5 例流出端套管末端位置过深,位于右房内;2 例流入端套管末端位置过浅,进入右房内与上腔静脉交界处,均在超声监测下将套管末端位置调整至最佳位置,见图1。
四、超声在V-V ECMO支持治疗期间的监测
1.监测相关心脏并发症:V-V ECMO 支持治疗期间,患者复查超声心动图次数平均5次,未出现严重心脏并发症。
2.监测血管:超声心动图提示2 例患者在V-V ECMO 支持治疗期间套管位置不正确。血管超声提示1例股静脉插管周围血栓形成,1 例颈内静脉插管周围血栓形成(图2A),但超声心动图未发现此2例患者套管末端血栓形成,无明显低流量表现。
3.监测其他并发症:1 例在V-V ECMO 支持治疗第4 天突发腹痛,伴血红蛋白持续性降低,急诊腹部超声提示腹腔大量积液,诊断性穿刺抽出不凝血,综合考虑系血管损伤致腹腔内出血。
五、V-V ECMO脱机后对并发症的监测
脱机后超声心动图提示1 例下腔静脉近右房入口约2 cm处(插管末端所处位置)形成一附壁血栓(图2B),CDFI 示血栓处可见充盈缺损。拔管后血管超声提示1 例同侧下肢静脉(股总及股浅静脉)血栓形成。
讨 论

图1 插管过程中超声监测流入端套管末端位置
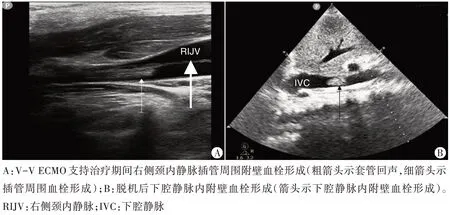
图2 超声提示血管腔内血栓形成
V-V ECMO 最常见指征是 ARDS[5],近年来也常用于等待肺移植的终末期肺病[6]及肺移植术后恢复期患者[7]。在本研究中,有9 例患者为ARDS,4 例患者为肺移植术后。在V-V ECMO 支持治疗前,需要对患者进行全面的超声心动图检查,以了解其血液动力学情况,包括心脏各腔室、瓣膜的功能,以及有无心脏压塞等情况,并评估外周大血管是否存在可能影响插管的因素[8]。本研究于插管前对患者的心脏功能和外周血管进行了评估,未发现V-V ECMO 支持治疗的心脏及血管相关禁忌症存在。
插管过程中需监测相关心脏并发症。导丝进入右房内需监测导丝的位置,避免导丝通过三尖瓣进入右室,或穿过房间隔或冠状静脉窦内。V-V ECMO 支持治疗期间,由于患者处于持续抗凝状态,因此还需严密监测有无心包积液或心包积液量有无显著增加。本研究在插管过程中、支持治疗期间及脱机后,所有患者均未发生严重的心脏并发症。
为了获得最佳的引流效果,流入端导管末端应位于右房中部,流出端套管末端应位于右房与下腔静脉间交界处。若流出端套管末端位置在下腔静脉内,则会增加套管尖端损伤血管壁的风险;若导丝在下腔静脉内弯曲,造成静脉阻塞,则会导致血栓形成[9];若套管位置深入右房内,则可能损伤房间隔或三尖瓣;若两个套管末端位置太近,则会增加发生再循环的可能性[10],直接影响支持治疗的效果。本研究在插管过程中,超声心动图提示5 例患者流出端套管末端位置深入右房内;2 例患者流入端套管末端位置过浅,进入右房内与上腔静脉交界处,以上患者均在超声监测下将套管末端位置调整至最佳位置,调整后患者未见低氧血症等表现。
V-V ECMO 插管及支持治疗期间发生的血管并发症包括出血和血栓。本研究中在V-V ECMO支持治疗期间发现股静脉、颈内静脉内插管周围血栓形成各1例,均位于穿刺点下方及周围,套管末端未见明显血栓形成,套管内血流充盈良好;1例患者于V-V ECMO 支持治疗的第4 天突发腹痛,伴有血红蛋白持续性降低,急诊腹部超声提示腹腔大量积液,诊断性穿刺抽出不凝血,综合考虑可能系持续抗凝及血管损伤导致腹腔出血。因此,笔者认为在V-V ECMO 支持治疗期间应用腹部超声筛查腹腔积液也是支持治疗期间监测的内容之一。
脱机后主要监测的并发症是静脉管腔内的血栓及栓塞。在本研究中,1 例患者脱机后发现下腔静脉附壁血栓形成,系脱机前1 d 超声提示下腔静脉内套管末端位置外移至距右房入口2 cm 处,但未及时调整套管位置。因此笔者考虑可能系套管末端位置外移至下腔静脉内,套管尖端损伤下腔静脉内壁所致。本研究中,还有1例患者系脱机后同侧下肢股总静脉及股浅静脉全程血栓形成。
综上所述,超声在V-V ECMO 支持治疗中有重要的作用。尽管超声的监测和引导不能直接改善患者预后,但有助于减少并发症发生的高危因素,及时发现并发症的发生,以此提高VV ECMO救治的成功率。
