五虎汤对RSV诱导的哮喘小鼠模型树突细胞自噬和炎性因子IL-17A和IL-17F水平的影响
2021-02-03王孟清罗银河江智豪
张 鑫,王孟清,罗银河,江智豪
1.湖南中医药大学,湖南 长沙 410208
2.湖南中医药大学第一附属医院,湖南 长沙 410007
3.湖南中医药大学 中医学国内一流建设学科,湖南 长沙 410208
支气管哮喘是气道慢性炎症性疾病,近年儿童哮喘呈逐年增加的趋势[1]。儿童哮喘与呼吸道合胞病毒(respiratory syncytial virus,RSV)密切相关,研究表明超过85%的儿童哮喘与RSV 感染有关[2]。RSV 感染人体后,肺中的抗原提呈细胞摄取抗原,树突细胞被激活,此外,树突细胞自噬功能的改变也会影响其抗原提呈功能,进而影响T 细胞分泌的炎性因子,从而诱发哮喘[3-6]。辅助性T 细胞1(T helper 1,Th1)、辅助性T 细胞2(T helper 2,Th2)细胞分泌的细胞因子和辅助性T 细胞17(T helper 17,Th17)分泌的白细胞介素-17(interleukin-17,IL-17)在哮喘的炎症反应中发挥着重要作用[7]。五虎汤为治喘名方,可显著改善哮喘患儿的气道炎症,课题组前期研究表明五虎汤可通过作用树突细胞,从而调节Th1、Th2 细胞分泌的细胞因子水平[8-9]。本研究通过体内和体外实验探讨五虎汤对RSV 诱导的哮喘小鼠树突细胞自噬的影响,以及对Th17 细胞分泌的炎性因子IL-17A 和IL-17F 水平的影响,揭示五虎汤改善哮喘气道炎症的机制。
1 材料
1.1 动物
SPF 级雌性BALB/c 小鼠88 只,6~8 周龄,体质量(20±2)g;SPF 级SD 雄性大鼠12 只,6周龄,体质量(200±5)g,购自湖南斯莱克景达动物实验有限公司,许可证号 SCXK(湘)2016-0002。转基因OT2 小鼠3 只,4 周龄,体质量(18±2)g,购自美国Jackson Laboratory,许可证号2061A00649。动物饲养于湿度(55±5)%、温度(22±2)℃、12 h 亮/12 h 暗循环条件下,自由饮食饮水。动物实验经湖南中医药大学动物伦理委员会批准(批准号20180810-02)。
1.2 细胞
RSV 病毒株和人喉表皮样癌Hep-2 细胞由武汉大学医学院病毒学研究所提供。
1.3 药材
麻黄、苦杏仁、生石膏、甘草、细茶叶由湖南中医药大学第一附属医院药房提供,经刘绍贵主任药师鉴定分别为麻黄科植物草麻黄Ephedra sinicaStapf 的干燥草质茎、蔷薇科植物山杏Prunus armeniacaL.var.ansuMaxim.的干燥成熟种子、硫酸盐类矿物硬石膏族石膏、豆科植物甘草Glycyrrhiza uralensisFisch.的干燥根和根茎、山茶科植物茶Camellia sinensis(L.) O.Ktze.的嫩叶。
1.4 药品与试剂
鸡卵清蛋白(ovalbumin,OVA,批号MP6110-1G)购自上海懋康生物科技有限公司;小鼠外周血淋巴细胞分离液试剂盒(批号P8620)购自北京索莱宝科技有限公司;乙酰胆碱(批号2260-50-6)购自上海禾午生物科技有限公司;雷帕霉素(批号S1039,质量分数>98%)购自美国Selleck 公司;地塞米松(批号D1756,质量分数为99%)、DMSO(批号D2650-100ML)购自美国Sigma公司;苏木精-伊红(HE)染色液(批号P032IH)、中性树胶(批号P033IH)、二甲苯(批号10023418)、无水乙醇(批号10009218)购自国药控股湖南有限公司;微管相关蛋白轻链3I(microtubule-associated protein lightc hain 3I,LC3I)抗兔单抗(批号4599S)、微管相关蛋白轻链3Ⅱ(LC3Ⅱ)抗兔单抗(批号3868S)购自美国CST 公司;β-actin 抗小鼠单抗(批号YM3028)购自美国Immunoway 公司;IL-17A、IL-17F ELISA 试剂盒(批号分别为E20181109021、E20181109024)购自上海晶天生物科技有限公司;PBS 缓冲液(批号LM1711)、胎牛血清(fetal bovine serum,FBS,批号0500)、RPMI 1640 培养基(批号0002)、重组人粒巨噬细胞集落刺激因子(批号kx30-GM)、重组人白细胞介素4(批号rh114)、Opti-MEM 培养基(批号1967689)购自赛百慷(上海)生物技术股份有限公司;PE/Cy7 抗小鼠CD69抗体(批号104511)、APC 抗小鼠CD3 抗体(批号100235)、PE 抗小鼠CD4 抗体(批号100407)购自美国Biolegend 公司;CD11cPerCP-Cyanine5.5/APC/PE 抗体(批号130-102-413)、小鼠CD4(L3T4)微珠(批号130-117-043)、肺分离试剂盒、CD11c MicroBeads UltraPure 购自德国Miltenyi 公司;红细胞裂解液(批号S371KJ)购自上海源培生物科技股份有限公司;荧光染料CFSE(批号HY-D0938)购自美国MCE 公司;OVA-17 肽(批号BP015382)购自武汉百意欣生物技术有限公司。
1.5 仪器
S888E 超声波雾化器(南京道芬电子有限公司);DHX-50 小动物呼吸机(成都仪器厂);YT-6C生物组织摊铺机(孝感宏翔生物医械技术有限公司);BE41 光学显微镜(苏州胜视电子设备有限公司);DYY-6C 电泳仪(北京六一仪器厂);YH-C3001电子天平(五鑫衡器有限公司),TS-2 水平脱色摇床(上海皖宁公司);EASY15 纯水仪(力康生物医疗科技控股有限公司);12008007 台式离心机(金坛市大地自动化仪器厂);DK-600S 恒温水浴锅(上海精宏实验设备有限公司),BC-J160S 细胞培养箱(上海博迅实业有限公司医疗设备厂);75004250 高速离心机(美国Thermo Fisher Scientific 公司);DS-Ri2 高级分析倒置显微镜(美国Nikon 公司);MACSQuant Analyzer 流式细胞仪(德国Miltenyi公司);Transwell 小室(6.5 mm)、T25 细胞培养瓶(美国Corning 公司)。
2 方法
2.1 五虎汤的制备
依据朱丹溪《幼科全书》中的药物与剂量配方,取麻黄2.4 g、杏仁6.0 g、生石膏9.0 g、生甘草2.4 g、细茶叶4.8 g,加入5 倍量蒸馏水浸泡30 min,回流提取40 min,滤过,再加入5 倍量蒸馏水,回流提取40 min,合并2 次提取液,用旋转蒸发仪浓缩成2.46 kg/L(以生药量计)原液。原液用作高剂量组,原液以等体积生理盐水稀释作为中剂量组,原液以3 倍体积生理盐水稀释作为低剂量组。
2.2 RSV 诱导哮喘小鼠模型的建立
78 只BALB/c 小鼠适应性饲养7 d 后,随机分为对照组(14 只)和模型组(64 只),参照课题组前期研究[9]造模。于实验第1、2 天,模型组小鼠鼻腔滴入0.1 mL RSV(2.4×106PFU/mL),同时ip 0.25 mL 1% OVA(以生理盐水配制);对照组小鼠鼻腔滴入0.1 mL Hep-2 细胞滴,同时ip 等体积生理盐水。自实验第9 天,每天9: 00 时将小鼠放入雾化吸入箱中,模型组给予1% OVA 雾化以激发哮喘,对照组给予等体积生理盐水雾化,隔天1次,每次30 min,连续14 d。
致敏前后每3 天称定小鼠体质量,并观察小鼠有无搔鼻、点头样喘息等行为学变化。最后1 次造模24 h 后分别从对照组和模型组随机取4 只小鼠,进行气道反应性实验。小鼠麻醉后待四肢松弛,固定消毒,外科剪切开颈部皮肤,暴露气管,用静脉留置针行颈静脉穿刺并固定,V 行剪开气管,予深静脉穿刺针行气管插管,接小动物呼吸机切开气管插管固定。呼吸机参数调整为呼吸频率为75 次/min,潮气量为8 mL/kg。记录气道压力、气道流量和潮气量的变化。小鼠气道压力稳定后给予0.1 mL 不同质量浓度(0、6.25、12.50、25.00、50.00 μg/mL)乙酰胆碱雾化,收集吸入乙酰胆碱5~60 s 的数据,采用动物肺功能分析软件计算用药后的最大肺阻力,与对照组比较,模型组肺阻力显著升高则表明造模成功。
2.3 分组与给药
将造模后的小鼠随机分为对照组、模型组、地塞米松(1.82 mg/kg)组、雷帕霉素(1 mg/kg)组、五虎汤低剂量(1.6 g/kg,相当于临床1/2 剂量)组、五虎汤中剂量(3.2 g/kg,相当于临床等效剂量)组、五虎汤高剂量(6.4 g/kg,相当于临床2 倍剂量)组,每组10 只。五虎汤组ig 五虎汤(20 mL/kg),并ip生理盐水;地塞米松、雷帕霉素组ip 0.4 mL 相应药物,并ig 等体积生理盐水;对照组和模型组ig 等体积生理盐水,并ip 等体积生理盐水,1 次/d,连续14 d。
2.4 五虎汤对RSV 小鼠肺泡灌洗液中IL-17A 和IL-17F 水平的影响
末次给药后48 h,小鼠脱颈椎处死,分离肌肉,暴露气管,在气管上剪一个T 形口,插入自制的气管,注入1 mL PBS 至肺部组织,轻揉后吸出,2500 r/min 离心10 min,吸取上清液。按照IL-17A、IL-17F ELISA 试剂盒说明书检测小鼠肺泡灌洗液中IL-17A 和IL-17F 水平。
2.5 五虎汤对RSV 小鼠肺组织病理的影响
取小鼠肺组织,将1 mL 4%多聚甲醛注入气管,全肺浸泡4%多聚甲醛24 h。常规石蜡包埋、切片后进行HE 染色,观察肺组织的病理变化。
2.6 五虎汤对RSV 小鼠肺组织中自噬小体的影响
取小鼠肺组织,用2.5%戊二醛缓冲液固定4 h,再用0.1 mol/L 磷酸洗涤10 min,重复3 次。1%锇酸固定2 h,梯度乙醇脱水、环氧树脂包埋,于30 ℃烘箱中过夜后再于60 ℃烘箱内放置12 h,切片(厚100 nm)后用醋酸铀、硝酸铅染色,于透射电镜下观察肺组织中的自噬小体。
2.7 五虎汤对RSV 小鼠肺组织树突细胞中自噬相关蛋白表达的影响
2.7.1 肺组织中树突细胞的分离 小鼠肺组织剪碎后,将小鼠肺组织解离成单细胞混悬液,在MACS SmartStrainers 中去除细胞团块,采用CD11c MicroBeadsUltraPure 分选磁珠从肺单细胞混悬液中分选获得树突细胞。
2.7.2 Western blotting 法检测树突细胞中自噬相关蛋白的表达 树突细胞提取总蛋白,BCA 法测定蛋白质量浓度,蛋白样本经SDS-PAGE 电泳,转至PVDF 膜,5%牛奶封闭1 h,分别加入LC3I(1∶2000)、LC3II(1∶1000)、β-actin(1∶5000)抗体孵育过夜,TBST 洗涤3 次,每次10 min;加入辣根过氧化物酶标记的二抗,室温孵育1 h,TBST 洗涤3 次,每次10 min。采用凝胶成像系统成像扫描,用Quantity One 软件进行灰度分析。
2.8 树突细胞的分离与鉴定
将10 只BALB/c 小鼠脱颈椎处死,浸泡于75%酒精中。于无菌操作台分离小鼠股骨、胫骨,剥除结缔组织,暴露髓腔,用PBS 缓冲液反复冲洗髓腔,收集骨髓滤液,离心后弃上清,加入红细胞裂解液裂解2 min,1000 r/min 离心5 min,弃上清,PBS缓冲液洗涤后加入RPMI 1640 培养基(含10 ng/mL重组人粒巨噬细胞集落刺激因子、1 ng/mL 重组人白细胞介素4、1% FBS、1%双抗),接种于6 孔板中培养。第3 天起每天更换一半培养基,第7 天收集细胞,以PBS缓冲液调整树突细胞密度至1×106个/mL,加入CD11ccPerCP-Cyanine5.5/APC/PE 抗体,采用流式细胞仪进样分析。
2.9 五虎汤含药血清的制备与剂量筛选
2.9.1 五虎汤含药血清的制备 将12 只SD 大鼠随机分为对照组及五虎汤低剂量(1.1 g/kg,相当于临床1/2 剂量)、中剂量(2.2 g/kg,相当于临床等效剂量)、高剂量(4.4 g/kg,相当于临床2 倍剂量)组,每组3 只。对照组ig 生理盐水(10 mL/kg),各给药组ig 等体积药物,2 次/d,连续7 d。末次给药后禁食,各组大鼠腹主动脉取血,离心取上清液,血清灭活后滤过,分别用作空白血清和五虎汤低、中、高剂量含药血清,于-80 ℃保存备用。
2.9.2 含药血清最佳剂量的筛选 树突细胞以含RSV 的Opti-MEM 培养基培养24 h,以PBS 洗涤后,随机分为空白血清组和含药血清低、中、高剂量组。各组分别加入5%、10%、20%、30%含药血清,孵育24 h 后采用台盼蓝染色法计算细胞存活率。
2.10 CD4+T 细胞分离和CFSE 标记
3 只OT2 小鼠脱颈椎处死,浸泡于75%乙醇中。于无菌操作台取小鼠脾脏,研磨过200 目筛网,收集滤液,1500 r/min 离心5 min,弃上清。取4 支15 mL 离心管,每管加入4 mL 小鼠外周血淋巴细胞分离液,将外周血细胞沉淀加入离心管中,加入10 mL PBS 洗涤细胞,离心10 min,弃上清,滤过后收集滤液,250×g离心10 min。每1×107个细胞加入90 μL Buffer 溶液(PBS、pH 7.2、0.5%牛血清白蛋白、2 mmol/L EDTA)和10 μL CD4 抗体,于4 ℃孵育10 min,用于免疫磁珠分选。
无菌操作台中,将分选柱吸附在分选器上,分选柱下放置15 mL 离心管,向分选柱中加入3 mL Buffer溶液待其自然滤过,将分选柱置于15 mL 离心管中,向分选柱中加入5 mL Buffer 溶液,待所有液体全部滤下时,使用助推器推下分选柱内残余液体,离心管内液体即为CD4+T 淋巴细胞悬液。1000 r/min 离心5 min,弃上清,加入5 mL PBS 洗涤,加入含10%FBS 的RPMI 1640 培养基重悬细胞悬液,接种于T25细胞培养瓶中。用含0.1% BSA 的PBS 溶液调整细胞密度为1×106/mL,加入1 μL CFSE 储存液,于37 ℃培养箱中孵育30 min,于冰上孵育5 min,1000 r/min 离心5 min,弃上清,重复3 次。
2.11 五虎汤对CD4+T 细胞增殖和T 细胞活化标志物CD69 表达的影响
“2.8”项中分离的树突细胞以1×104/孔接种于Transwell 小室下室,“2.10”项中分离的CD4+T 细胞以1×105/孔接种于Transwell 小室上室。设置对照组,模型组,五虎汤低、中、高剂量含药血清组,雷帕霉素(10 ng/mL)组,对照组加入完全培养基,其他组加入含RSV 的Opti-MEM 培养基,培养24 h,PBS 洗涤后加入OVA-17 肽,培养24 h,构建RSV诱导的树突细胞自噬模型。对照组与模型组加入空白血清,含药血清低、中、高剂量组分别加入20%相应含药血清,雷帕霉素组加入雷帕霉素,培养24 h。收集细胞,分别加入 CD4-PE、CD3-APC 和CD69-PE/Cy7 抗体,流式细胞术分析CD4+T 细胞的增殖与CD69 的表达情况。
2.12 统计分析
实验数据采用SPSS 25.0 软件进行统计分析,数据结果采用表示。两组数据比较,满足正态性和方差齐性,用配对t检验,多组比较满足正态性和方差齐性的计量资料采用One-way ANOVA,各组间两两比较采用 LSD 法,方差不齐者用Dunett’s 检验。
3 结果
3.1 RSV 诱导哮喘小鼠模型的验证
与对照组比较,模型组小鼠体质量减轻,出现呼吸快、搔鼻、竖毛、耸肩、上肢缩抬、点头样喘息等行为学改变。如表1 所示,与对照组比较,吸入不同质量浓度(0、6.25、12.50、25.00、50.00 μg/mL)乙酰胆碱后,模型组小鼠肺阻力显著增加(P<0.01),表明造模成功。
3.2 五虎汤对RSV 小鼠肺组织病理变化的影响
如图1 所示,对照组小鼠支气管管腔壁完整,未见脱落的上皮细胞,支气管黏膜平整,平滑肌无炎性细胞浸润;模型组小鼠支气管管壁增厚,气道变窄,气道和血管周围有大量的炎症细胞浸润,以嗜酸粒细胞和中性粒细胞为主;五虎汤各剂量组、地塞米松组、雷帕霉素组小鼠肺组织炎症表现均减轻,支气管管腔内可见少量黏液和脱落,炎性细胞浸润较模型组明显减轻。
表1 对照组与模型组小鼠肺阻力比较 ()Table 1 Comparison of airway reactivity in mice between control group and model groups ()
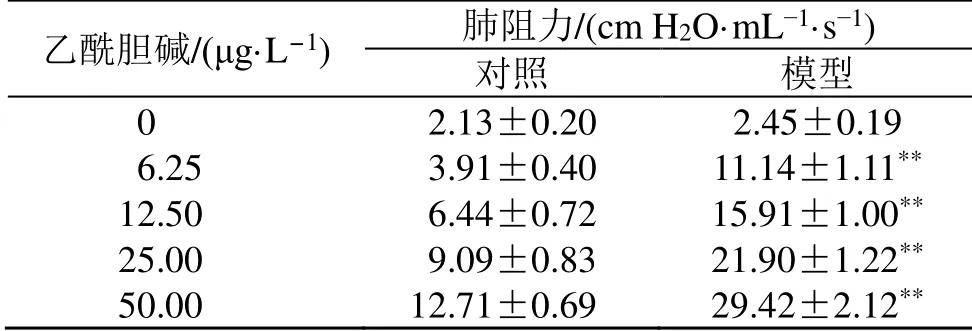
表1 对照组与模型组小鼠肺阻力比较 ()Table 1 Comparison of airway reactivity in mice between control group and model groups ()
与对照组比较:**P<0.01**P < 0.01 vs control group
乙酰胆碱/(μg·L-1) 肺阻力/(cm H2O·mL·s)对照 模型00 02.13±0.20 2.45±0.19 06.25 03.91±0.40 11.14±1.11**12.50 06.44±0.72 15.91±1.00**25.00 09.09±0.83 21.90±1.22**50.00 12.71±0.69 29.42±2.12**
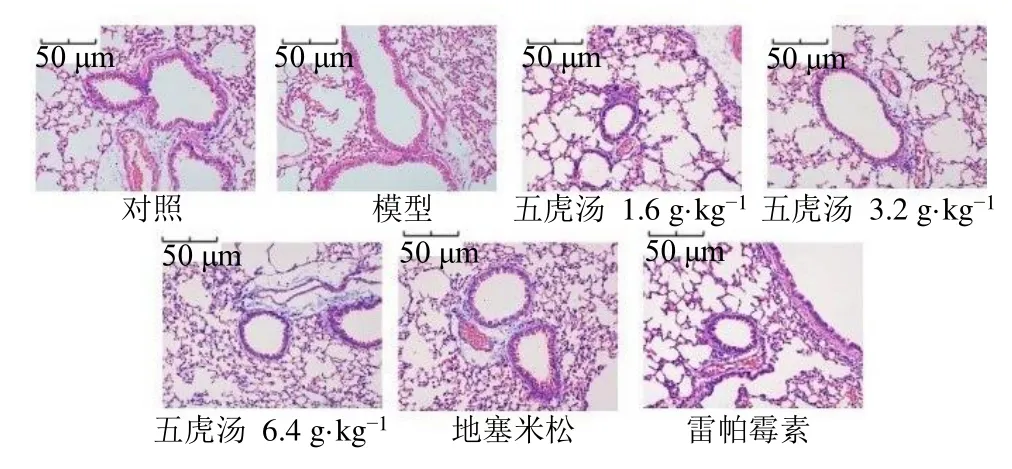
图1 五虎汤对RSV 小鼠肺组织病理的影响 (HE,×200)Fig.1 Effect of Wuhu Decoction on lung pathology of RSV mice (HE,× 200)
3.3 五虎汤对RSV 小鼠肺组织自噬小体的影响
如图2 所示,与对照组比较,模型组、各给药组小鼠肺组织自噬小体增多。
3.4 五虎汤对RSV 小鼠肺组织树突细胞中自噬相关蛋白表达的影响
如图3 和表2 所示,与对照组比较,模型组小鼠树突细胞中LC3Ⅱ/LC3I蛋白表达水平显著升高(P<0.01);与模型组比较,五虎汤低、中、高剂量组和雷帕霉素组小鼠树突细胞中LC3Ⅱ/LC3I蛋白表达水平显著增高(P<0.01)。
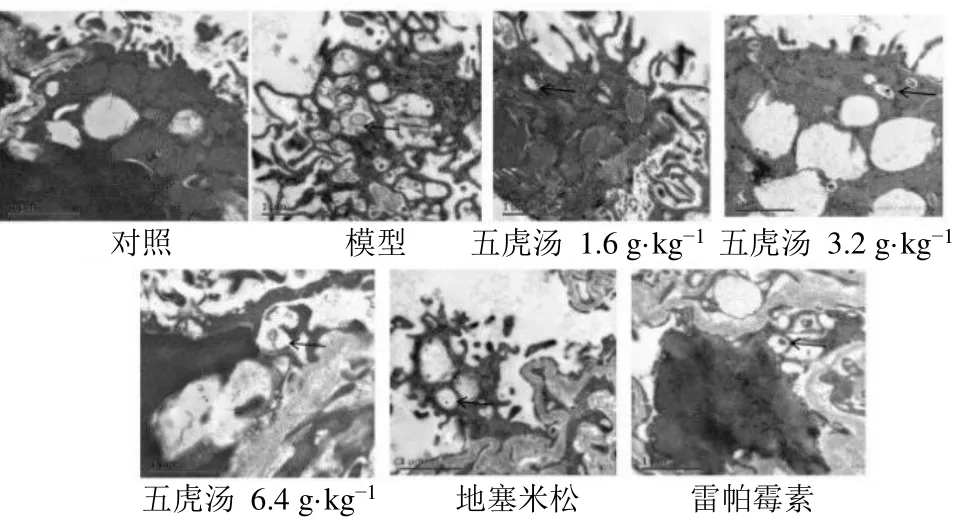
图2 五虎汤对RSV 小鼠肺组织自噬小体的影响Fig.2 Effect of Wuhu Decoction on pulmonary autophagosome of RSV mice
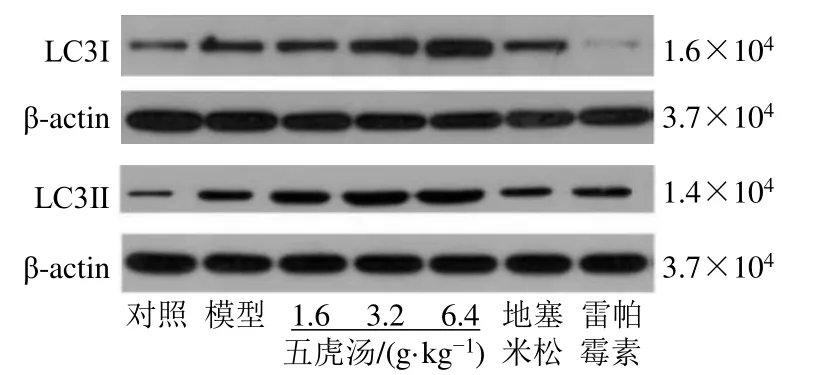
图3 五虎汤对RSV 小鼠肺组织树突细胞中LC3I 和LC3Ⅱ蛋白表达的影响Fig.3 Effect of Wuhu Decoction on expressions of LC3I and LC3Ⅱ in dendritic cells in lungs of RSV mice
3.5 五虎汤对RSV 小鼠肺泡灌洗液中IL-17A 和IL-17F 水平的影响
如表3 所示,与对照组比较,模型组小鼠肺泡灌洗液中IL-17A 和IL-17F 水平显著升高(P<0.01);与模型组比较,地塞米松组、雷帕霉素组、五虎汤中、高剂量组小鼠肺泡灌洗液中IL-17A 和IL-17F 水平显著降低(P<0.05、0.01),五虎汤低剂量组IL-17A 水平显著降低(P<0.01)。
表2 五虎汤对RSV 小鼠肺组织树突细胞中LC3I 和LC3Ⅱ蛋白表达的影响 ()Table 2 Effect of Wuhu Decoction on expressions of LC3I and LC3Ⅱ in dendritic cells in lungs of RSV mice ()
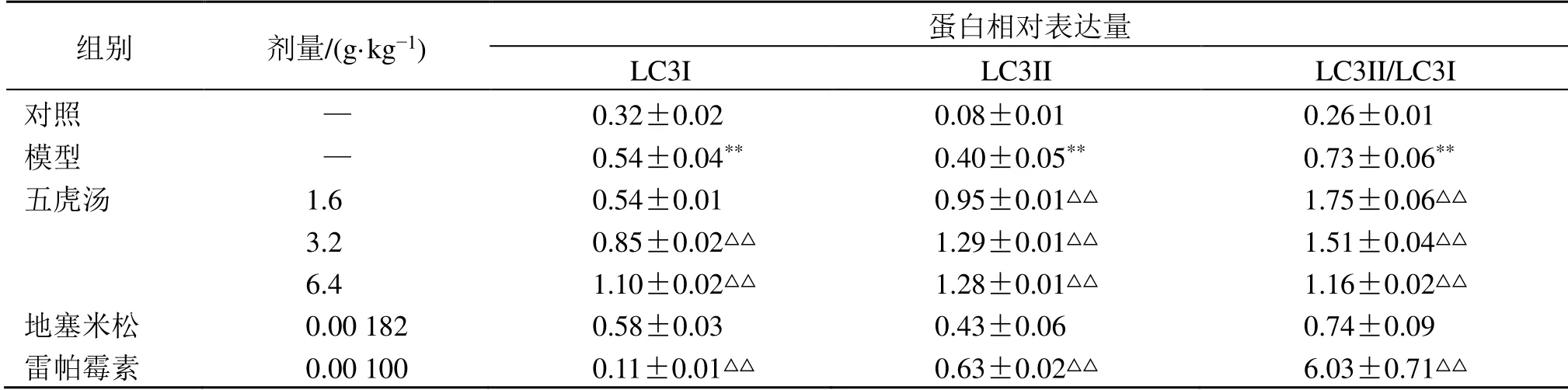
表2 五虎汤对RSV 小鼠肺组织树突细胞中LC3I 和LC3Ⅱ蛋白表达的影响 ()Table 2 Effect of Wuhu Decoction on expressions of LC3I and LC3Ⅱ in dendritic cells in lungs of RSV mice ()
与对照组比较:**P<0.01;与模型组比较:△△P<0.01**P < 0.01 vs control group;△△P < 0.01 vs model group
组别 剂量/(g·kg-1) 蛋白相对表达量LC3I LC3II LC3II/LC3I对照 — 0.32±0.02 0.08±0.01 0.26±0.01模型 — 0.54±0.04** 0.40±0.05** 0.73±0.06**五虎汤 1.6 0.54±0.01 0.95±0.01△△ 1.75±0.06△△3.2 0.85±0.02△△ 1.29±0.01△△ 1.51±0.04△△6.4 1.10±0.02△△ 1.28±0.01△△ 1.16±0.02△△地塞米松 0.00 182 0.58±0.03 0.43±0.06 0.74±0.09雷帕霉素 0.00 100 0.11±0.01△△ 0.63±0.02△△ 6.03±0.71△△
表3 五虎汤对RSV 小鼠肺泡灌洗液中IL-17A 和IL-17F 水平的影响 ()Table 3 Effect of Wuhu Decoction on levels of inflammatory cytokines IL-17A and IL-17F in bronchoalveolar lavage fluid of RSV mice ()
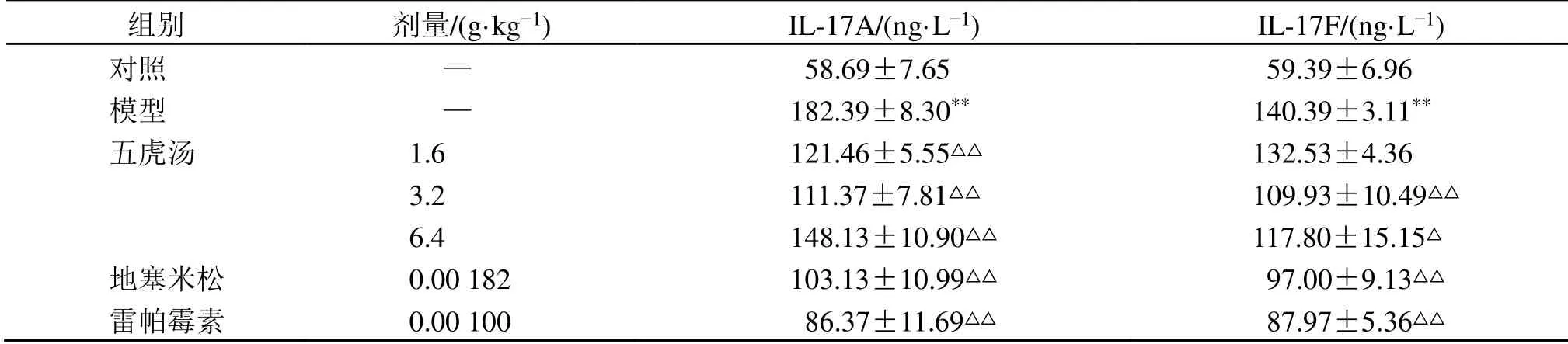
表3 五虎汤对RSV 小鼠肺泡灌洗液中IL-17A 和IL-17F 水平的影响 ()Table 3 Effect of Wuhu Decoction on levels of inflammatory cytokines IL-17A and IL-17F in bronchoalveolar lavage fluid of RSV mice ()
与对照组比较:**P<0.01;与模型组比较:△P<0.05 △△P<0.01**P < 0.01 vs control group;△P < 0.05 △△P < 0.01 vs model group
组别 剂量/(g·kg-1) IL-17A/(ng·L-1) IL-17F/(ng·L-1)对照 — 58.69±7.65 59.39±6.96模型 — 182.39±8.30** 140.39±3.11**五虎汤 1.6 121.46±5.55△△ 132.53±4.36 3.2 111.37±7.81△△ 109.93±10.49△△6.4 148.13±10.90△△ 117.80±15.15△地塞米松 0.00 182 103.13±10.99△△ 97.00±9.13△△雷帕霉素 0.00 100 86.37±11.69△△ 87.97±5.36△△
3.6 树突细胞的分离与鉴定
从小鼠骨髓中分离的树突细胞在培养基中悬浮生长,培养至第7 天,如图4 所示,镜下可见细胞边缘有树突样突起,具有典型的树突细胞形态。如图5 所示,从小鼠骨髓中分离培养的树突细胞纯度为99.3%。
3.7 五虎汤含药血清最佳剂量的筛选
如图6 所示,20%五虎汤含药血清对细胞存活率较高,选取20%含药血清进行后续实验。
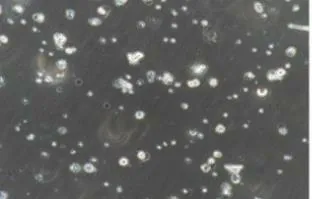
图4 小鼠骨髓来源树突细胞的形态 (×200)Fig.4 Morphology of mice bone marrow derived dendritic cells ( × 200)
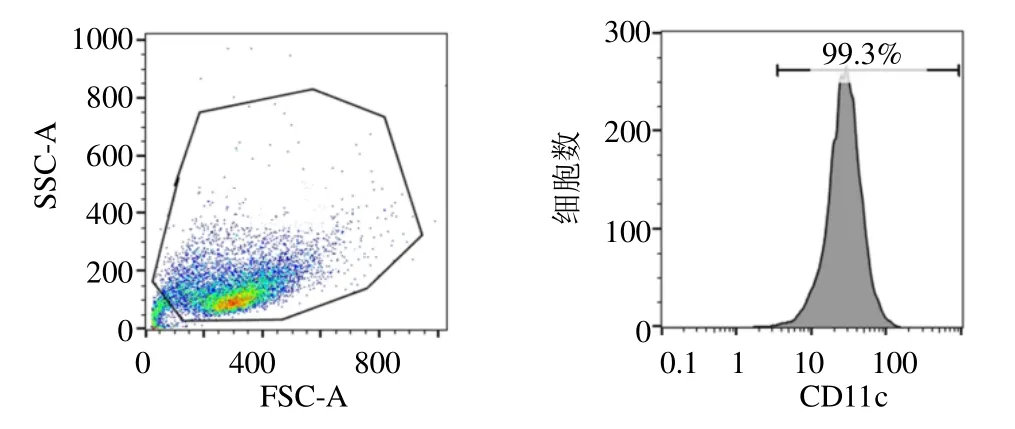
图5 小鼠骨髓来源树突细胞的鉴定Fig.5 Identification of mice bone marrow-derived dendritic cells
3.8 五虎汤对CD4+T 细胞增殖和CD69 表达的影响
如图7、8 和表4 所示,与对照组比较,模型组CD4+T 细胞增殖和T 细胞活化标志物CD69 表达显著升高(P<0.01);与模型组比较,中、高剂量含药血清组和雷帕霉素组CD4+T 增殖和CD69表达显著降低(P<0.05、0.01),低剂量含药血清组CD4+T 增殖显著降低(P<0.01)。表明五虎汤含药血清在体外具有抑制RSV 诱导的T 细胞增殖活化的能力。
4 讨论
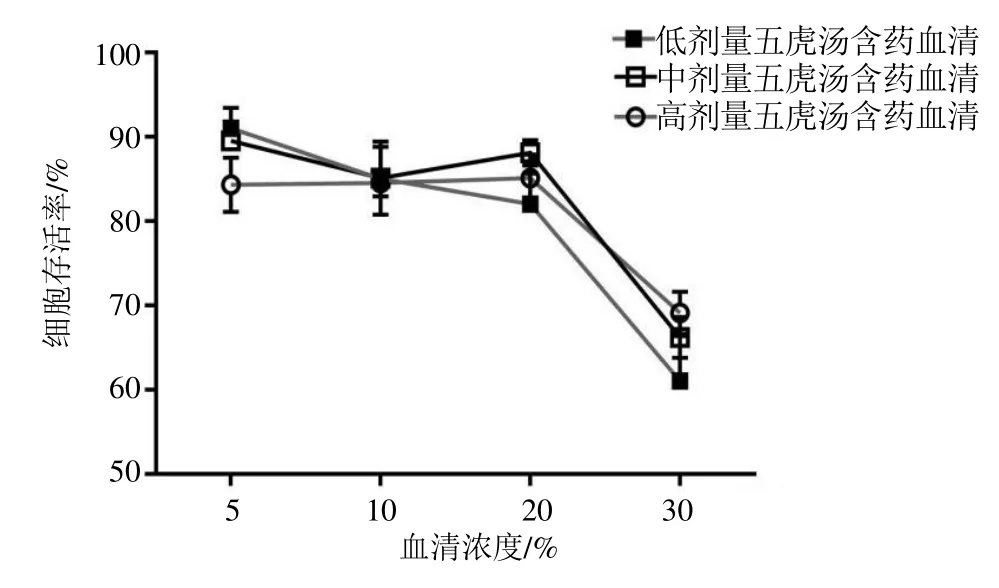
图6 五虎汤含药血清对树突细胞活力的影响Fig.6 Effect of drug-containing serum of Wuhu Decoction on dendritic cell activity
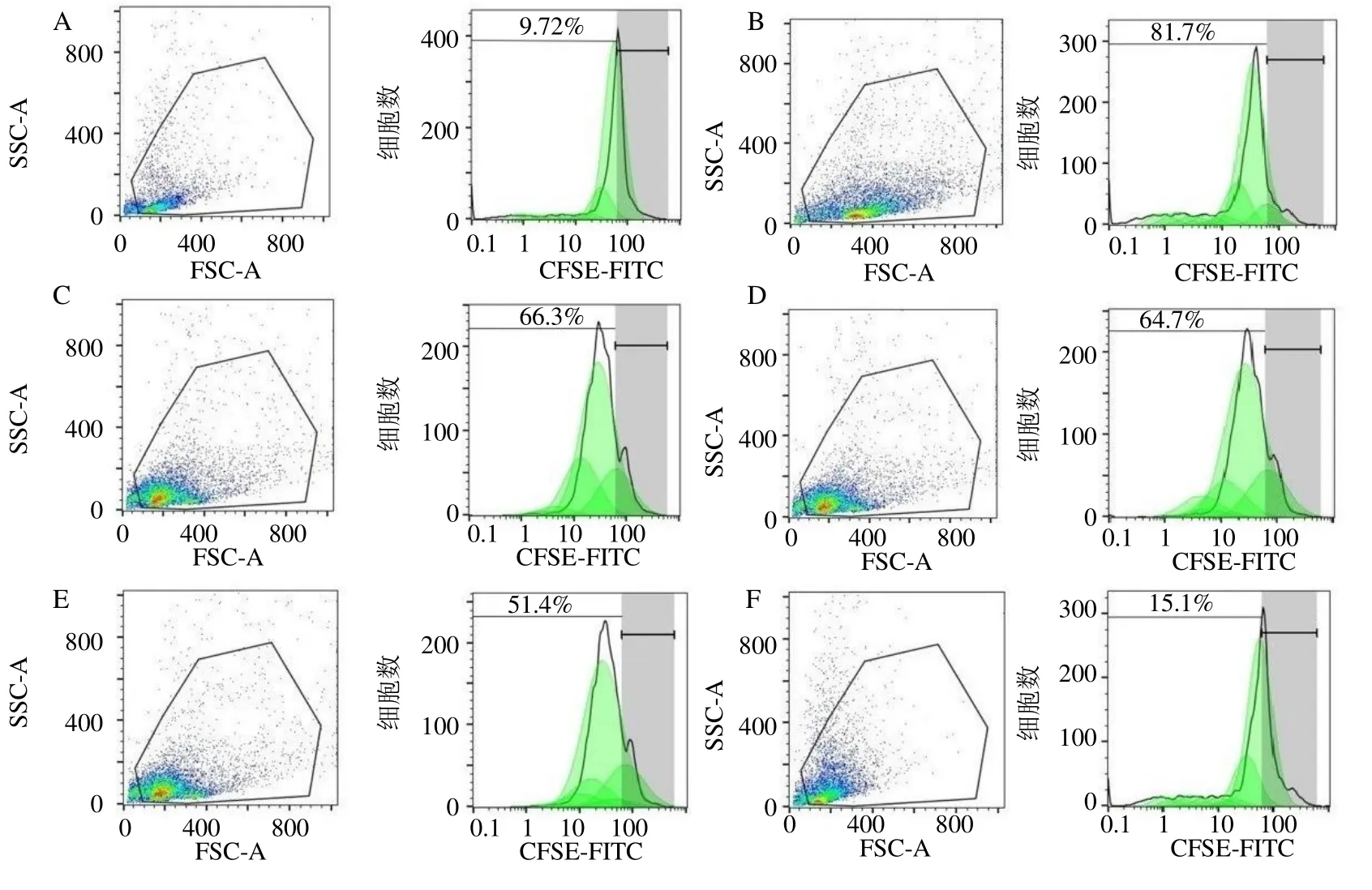
图7 对照组 (A),模型组 (B),五虎汤低、中、高剂量含药血清组 (C~E) 和雷帕霉素组 (F) CD4+T 细胞的流式结果Fig.7 Flow results of CD4+T cells in control group (A),model group (B),drug-containing serum low,medium,high dose of Wuhu Decoction group (C—E) and rapamycin group (F)
气道炎症是支气管哮喘重要的发病机制,树突细胞介导的CD4+T 淋巴细胞的增殖活化与气道炎症密切相关[10-11]。抗原的识别与递呈、炎症细胞的趋化、T 细胞的分化及其细胞因子的产生是哮喘炎症反应的重要环节[12]。树突细胞为肺中最重要的抗原呈递细胞,成熟后可提呈抗原,激活分化初始T 细胞[13]。研究表明,哮喘患者的树突细胞与自体T 细胞共培养促进T 细胞分泌IL-4、IL-5、IL-9 和IL-13,提示树突细胞通过影响T 细胞分泌的炎性因子,诱发气道炎症,从而参与哮喘发病[14]。自噬是细胞利用溶酶体降解自身物质以适应生存环境的过程,病毒感染诱发机体细胞自噬,机体可通过提高自噬清除病毒[15]。自噬影响树突细胞的抗原提呈功能,树突细胞摄取、加工提呈抗原需要高水平的内吞和溶酶体活性,树突细胞自噬功能紊乱引起的T 细胞炎性因子分泌变化可能是哮喘的发病机制之一[16-17]。
表4 五虎汤对CD4+T 细胞增殖和CD69 表达的影响()Table 4 Effect of Wuhu Decoction on proliferation of CD4+T cells and expression of CD69 ()

表4 五虎汤对CD4+T 细胞增殖和CD69 表达的影响()Table 4 Effect of Wuhu Decoction on proliferation of CD4+T cells and expression of CD69 ()
与对照组比较:**P<0.01;与模型组比较:△P<0.05 △△P<0.01**P < 0.01 vs control group;△P < 0.05 △△P < 0.01 vs model group
组别 CD4+T/% CD69 相对表达量对照 09.72±0.22 06.26±0.18模型 81.70±0.42** 16.73±0.37**含药血清 66.30±0.54△△ 15.57±0.47 52.40±0.33△△ 10.70±0.64△54.90±0.29△△ 11.67±0.69△雷帕霉素 18.10±0.40△△ 10.63±0.19△△
五虎汤是治疗儿童哮喘的名方,由麻黄、杏仁、石膏、甘草、细茶叶组成,有清肺平喘的功效。本研究采用RSV 与OVA 建立哮喘小鼠模型,以自噬诱导剂雷帕霉素作为阳性对照,观察五虎汤是否可以通过影响小鼠肺中树突细胞的自噬水平治疗哮喘,结果表明RSV 诱导的哮喘小鼠肺部可见炎性细胞浸润,各给药组小鼠肺部炎症减轻;模型组小鼠肺树突细胞自噬标志蛋白LC3Ⅱ/LC3I表达水平显著升高(P<0.01),雷帕霉素和五虎汤组树突细胞的自噬水平进一步升高(P<0.01),提示五虎汤可以提高哮喘小鼠肺中树突细胞细胞的自噬水平。
IL-17 是Th17 细胞分泌的重要细胞因子,具有募集粒细胞、促进其他炎性细胞因子释放的作用[18-19]。IL-17 参与机体多种炎症与免疫性疾病,在RSV 诱导的哮喘小鼠肺组织中IL-17 水平明显升高[20-21]。IL-17 家族包含IL-17A~F,IL-17F 与IL-17A的同源性达50%,二者功能类似[22-23]。IL-17A 可通过促进成纤维细胞和气道上皮细胞释放细胞因子活化中性粒细胞,并使中性粒细胞在气道募集,还可促进气道上皮细胞黏蛋白表达,促进黏液分泌[24]。IL-17F 可刺激支气管上皮细胞促进细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)表达,并刺激IL-17 分泌使炎性细胞募集,同时对气道高反应性与气道重塑有重要影响[25-26]。IL-17A 和IL-17F通过促进前炎性细胞因子的释放来放大炎症反应,均可作为T 细胞诱导炎症反应的早期启动因子,研究认为IL-17A 在类风湿性关节炎发病中更为重要,IL-17F 对消化道啮齿枸橼酸杆菌感染与免疫的机制更为重要[27-28]。本研究结果显示,RSV 诱导的哮喘小鼠肺泡灌洗液中IL-17A和IL-17F水平均显著升高(P<0.01),经五虎汤治疗后二者水平均显著降低(P<0.05、0.01),以五虎汤中剂量为佳,IL-17A 水平的变化较IL-17F 更为显著,推测在RSV 诱导的哮喘模型中IL-17A 可能更适合作为病情变化的指标。
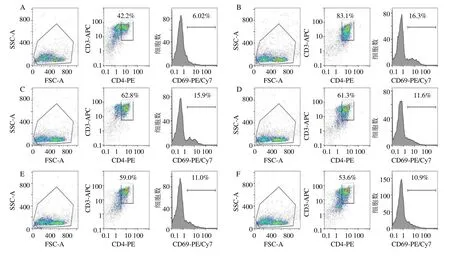
图8 对照组 (A),模型组 (B),五虎汤低、中、高剂量含药血清组 (C~E) 和雷帕霉素组 (F) 的CD69 表达的流式结果Fig.8 Flow cytometry of CD69 expression in control group (A),model group (B),drug-containing serum low,medium,high dose of Wuhu Decoction group (C—E),and rapamycin group (F)
为了进一步研究炎性因子IL-17A、IL-17F 的变化是否由树突细胞自噬直接介导,体外采用RSV 感染树突细胞与T 细胞共培养,发现CD4+T 细胞增殖水平和T 细胞活化标志物CD69 表达升高,五虎汤含药血清与自噬诱导剂雷帕霉素组CD4+T 细胞增殖和CD69 的表达均显著降低(P<0.05、0.01),表明五虎汤可通过作用树突细胞,抑制过度活化增殖的T 细胞。
综上所述,树突细胞的自噬水平与细胞因子IL-17A 和IL-17F 的分泌有关,RSV 可诱导哮喘小鼠肺组织树突细胞自噬水平升高,使IL-17A、IL-17F水平上升,介导炎症反应。五虎汤可通过上调RSV诱导的哮喘小鼠的自噬水平,进而降低IL-17A、IL-17F 等炎性细胞因子的表达,改善气道炎症,从而发挥治疗RSV 诱发哮喘的作用。
利益冲突所有作者均声明不存在利益冲突
