耐高温球等鞭金藻(Isochrysis galbana)藻种的选育与饵料特性初步分析*
2021-02-03赵东会赵丽达王寅初焦绪栋
赵东会 赵丽达 尤 宏 秦 松, 王寅初, ① 焦绪栋, ①
(1. 哈尔滨工业大学(威海)海洋科学与技术学院 威海 264209; 2. 中国科学院烟台海岸带研究所 烟台 264003;3. 中国科学院海洋大科学研究中心 青岛 266071; 4. 南阳师范学院生命科学与技术学院 南阳 473061)
饵料微藻可以在生物链中作为鱼虾幼苗良好的开口食物, 是水产动物苗种培育阶段的关键因素之一。与传统的人工饲料相比, 微藻生物饵料有易被养殖对象消化、便于培养、营养全面、对水体污染小等独特的优势(许家辉等, 2018)。目前研究的饵料微藻主要包括三角褐指藻(Phaeodactylum tricornutum)、等鞭金藻(Isochrysis sp.)、亚心形扁藻(Platymonas subcordiformis)、中肋骨条藻(Skeletonema costatum)、威氏海链藻(Thalassiosira weissflogii)和海水小球藻(Chlorella sp.)等(刘皓等, 2010; 熊良伟等, 2013; 刘祚屹等, 2020)。
然而, 在夏季高温条件下, 水温影响了饵料生物的正常繁殖与生长(包永波等, 2004)。普通饵料微藻容易衰败, 造成饵料微藻供应不及时或无法足量供应(邹琰等, 2010), 为水产苗种的生产带来诸多隐患。三角褐指藻在 25°C 下细胞生长最好, 小球藻(Chlorella vulgaris)在 5—30°C 均可正常生长, 20°C 为最适宜的生长温度(赵婷等, 2016)。亚心形扁藻在28°C 的生长量最大, 31°C 的温度条件下, 亚心形扁藻的生长量下降。不同温度条件下, 等鞭金藻塔溪堤品系Isochrysis galbana (Tahitian strain)的相对生长率在25°C 条件下最高, 其最适生长温度为 20—30°C (梁英等, 2011)。诸多研究表明, 目前的饵料微藻最适耐受温度普遍低于30°C。因此寻找可以在30°C 及以上温度条件下稳定生长的饵料微藻, 以保障夏季饵料微藻的供应量是比较迫切的。
单环刺螠(Urechis unicinctus)属螠虫动物门(Echiurioidea) 、 螠 纲 (Echiurida) 、 无 管 螠 目(Xenopneusta)、刺螠科(Urchidae)、刺螠 属(李诺等,1998)。目前, 单环刺螠的研究主要集中在单环刺螠的繁育、池塘养殖方面的创新工作(王淑芬等, 2016; 许星鸿等, 2016), 但对单环刺螠的摄食生理学研究甚少。单环刺属于滤食性动物, 主要以金藻、扁藻、小球藻等微藻作为饵料, 其中以金藻作为开口饵料效果较好(许星鸿等, 2016)。其夏季育苗一般自 5 月下旬开始, 至 8—9 月份结束, 育苗过程需经过夏季高温期。目前所用的饵料微藻难以在高温高光照条件下存活, 筛选耐高温饵料微藻可以满足夏季单环刺螠幼苗对活体饵料微藻的需求。
本文从夏季水温超过 40°C、已发生衰败的莱州某育苗场的球等鞭金藻培育池中分离出 4 株球等鞭金藻, 分别命名为PHY7001—PHY7004。分析了各藻株在33°C、40°C 的水温下的生长状态和藻株细胞大小、粗蛋白含量, 并对生长速率最快的一株耐高温球等鞭金藻(PHY7004)的培养条件进行优化。通过测试单环刺螠幼苗对耐高温藻株的摄食能力, 选育出具有较好适口性的藻株, 为后期的规模化利用提供了理论和现实依据。
1 材料与方法
1.1 微藻分离与培养
本实验藻液样品是在夏季从莱州市顺昌水产有限公司的饵料培育池取回, 实时水温为 43°C, 其中培育的藻类经过长期的高温已发生严重衰败。取回后立刻通过显微操作技术分离耐受住高温胁迫的微藻活细胞, 对分离的单细胞进行培养后得到藻株, 分别命名为: PHY7001、PHY7002、PHY7003、PHY7004。
微藻培养采用f/2 培养基(Guillard et al, 1962), 温度为25°C, 盐度为32, 光暗周期为 12 h/12 h, 光照强度 12 μmol/(cm2·s)。每天定时摇匀藻液 1 次, 以防细胞贴壁生长对实验结果产生干扰。
1.2 藻株的耐高温测试
本实验设 A(33°C)、B(40°C)两组温度, 对分离藻株的耐高温性能进行测试。每组每藻株设三个平行。将分离培养后达到对数生长期的藻株分别取100 mL藻液至250 mL 三角瓶。将A、B 组分别置于温度为33°C、40°C 的恒温光照培养箱中培养, 光暗周期为24 h/0 h, A、B 两组有效光强均为 16 μmol/(cm2·s)。采用681 nm 吸光光度值表征其细胞数目。
1.3 藻株PHY7004 培养基的优化
PHY7004 是33°C 条件下生长速度最快的藻株。本实验对 PHY7004 进行培养基的优化, 优化的指标为 pH 值和氮磷比(NaNO3∶Na2HPO4), 其中 NaNO3的浓度为 75 g/L; Na2HPO4·2H2O 的浓度为 5.65 g/L。pH 值设置三个梯度: pH=7, pH=8, pH=9, N/P 比设置三个梯度: 12∶1, 13∶1, 14∶1, 对 pH 值和 N/P 进行交叉实验, 共9 个梯度。
将PHY7004 置于33°C 的恒温振荡培养箱中培养,光暗周期为 24 h/0 h, 光强为 12 μmol/(cm2·s)。
1.4 藻株鲜重总蛋白含量的测定
用BCA 总蛋白浓度检测试剂盒(上海碧云天生物技术有限公司)对所筛选出的耐高温饵料微藻进行鲜重下蛋白质含量的测定。用Origin 软件线性拟合得到蛋白质的标准曲线: A=13.50C+0.1170, R2=0.9937。其中: A 为 562 nm 的吸光度值; C 为总蛋白质浓度(mg/mL)。
1.5 单环刺螠幼苗饲喂实验
选取 4 月龄, 体重为 0.32—0.90 g, 体长为2.1—3.9 cm 的单环刺螠幼苗200 尾, 从中挑选出生长状态良好的150 尾幼苗, 随机分为5 组, 1 组30 尾单环刺幼苗, 每组设 3 个平行重复。分别置于 5 0 L养殖容器中, 底部铺设15 cm 干净海沙; 采用过滤海水每天6:00am 换水1 次, 充气暂养7—10 d。分别用PHY7001、PHY7002、PHY7003、PHY7004 的新鲜培养液, 于每天 5:30pm 定时饲喂单环刺螠幼苗, 投喂的饵料微藻的初始浓度为2×106—3.5×106CFU/mL。不放单环刺螠幼苗为对照组。饲喂实验持续 5 d, 于实验开始后第3 天开始取样。饲喂后2 h 在养殖池的不同位置分别取3 次海水样品, 测试海水浊度。根据公式计算单环刺螠幼苗对所筛选出耐高温饵料微藻的摄食强度(Fi)(孙涛等, 2017)。
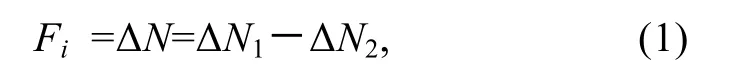
式中, ΔN1表示试验组投饵1 h 后因单环刺螠摄食和沉降造成浊度的改变值(NTU); ΔN2表示对照组投饵1 h后因沉降造成浊度的改变值(NTU)。
2 结果与讨论
2.1 藻株的分离
通过显微操作技术分离出4 株球等鞭金藻。分别命名为: PHY7001、PHY7002、PHY7003、PHY7004。单细胞培养48 h 后, 观察各藻株颜色为绿色, 颜色纯正, 镜检细胞大小一致, 无原生动物污染。
利用倒置显微镜拍摄各藻株的细胞照片后, 用Digimizer 软件测量细胞直径(图1)。计算各藻株细胞的平均直径为 5.5—7.5 μm, 与常规的球等鞭金藻(5—7 μm)相比, 大小差别不明显。
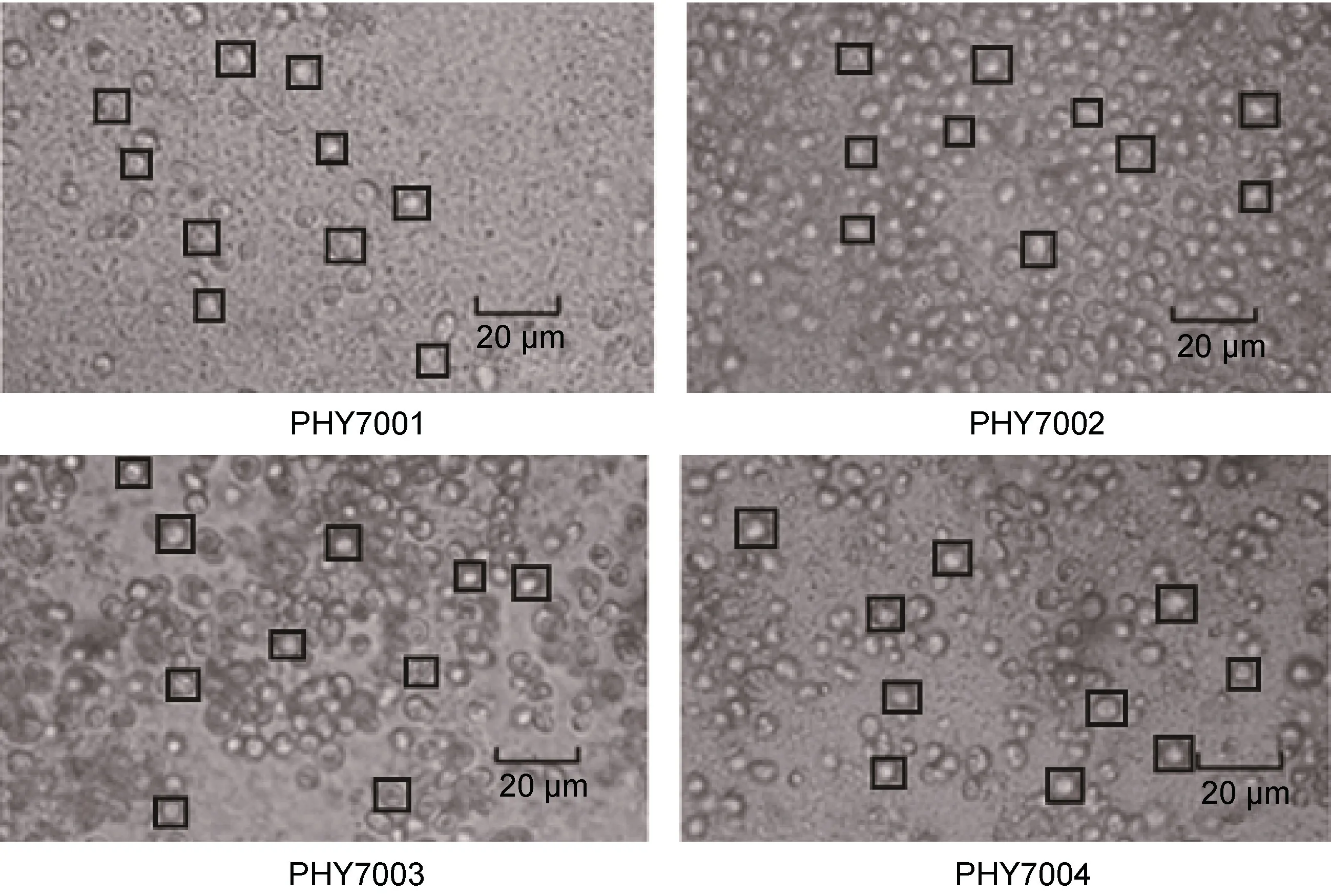
图1 分离的4 株耐高温球等鞭金藻Fig.1 Four isolated strains of I. galbana resistant to high temperature
在培养微藻过程中, 与控制温度相比, 光照条件易控制且控制成本较低, 因此本实验目的为筛选耐高温藻种, 对光照强度的设置条件为不抑制球等鞭金藻正常生长即可。本实验微藻培养与耐高温测试实验的光照条件分别为 12 和 16 μmol/(cm2·s), 均在球等鞭金藻可正常生长的光照强度范围内(郭兵等, 2011)。
2.2 耐高温性能测试
将分离的藻株在 33°C 水温中进行培养, 发现分离的藻株均可在33°C 水温下存活。其中从接种开始到第7 天, 各藻株的细胞数目均有增加; 与第7 天相比, 第 9 天的 PHY7001、CHY7004 的细胞数量继续增加, PHY7002、CHY7003 的细胞数量没有大的变化;根据生长曲线的走势, PHY7001 和PHY7004 的细胞数目可能继续增长。在培养周期内, PHY7004 的细胞数目几乎呈线性增长, 生长状态最优, 推测该藻株对高水温的适应能力较好。其他藻株也展示出了较好的生长能力, 存在不同的生长滞后过程, 提示其对高水温的适应能力需要进一步驯化(图2)。
将分离的藻株在 40°C 水温中进行培养时, 藻株的生长状态与在 33°C 时完全不同。由图 3 所示,PHY7001、PHY7002、PHY7003、PHY7004 均不能耐受40°C。与第1 天相比, 第3 天的4 株球等鞭金藻的细胞数量大幅减少, 第3 天的细胞数目约为第1 天的1/3—1/6 倍。在培育的第3—9 天, 虽然细胞数目中间有小幅度的上升, 但是最终的细胞数目仍普遍呈下降趋势, 这可能是由于球等鞭金藻最终无法适应高温造成的。
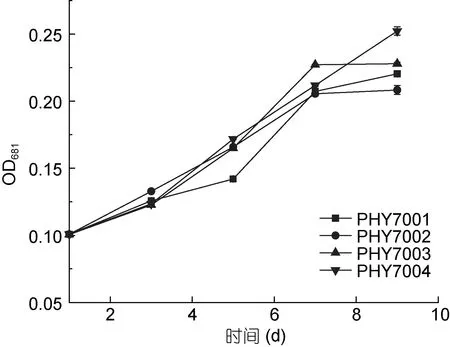
图2 球等鞭金藻的存活及生长性能(33°C)Fig.2 Analysis of the survival and growth capability of I.galbana (33°C)
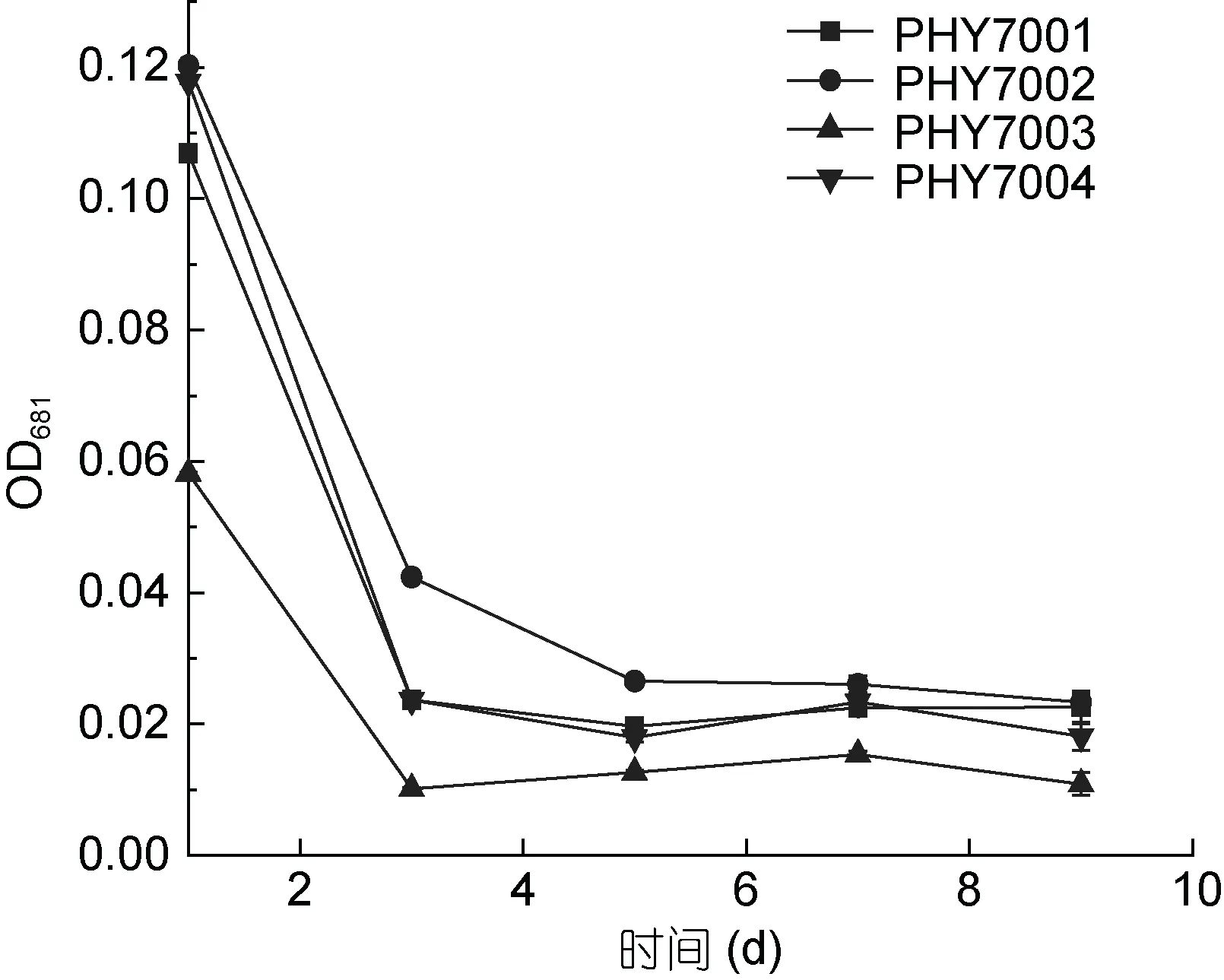
图3 球等鞭金藻的存活及生长性能(40°C)Fig.3 Survival and growth of I. galbana (40°C)
2.3 球等鞭金藻的优化
对可耐受33°C 且生长速率最快的PHY7004 绘制其在33°C 下的生长曲线。用Origin 软件对数据进行线性拟合, 拟合出的方程为: A=0.1097-0.0015T+0.0048T2-0.0003T3, R2=0.9920。由图 4 可见, 当PHY7004 起始接种量 OD681值为 0.1007 时, 第 1—2天为 PHY7004 的适应期; 第 2—9 天为 PHY7004 的对数生长期; 第 9—11 天为 PHY7004 的平稳期; 第11—12 天为 PHY7004 的衰退期。培育第 9 天时PHY7004 的OD681值为0.2491, 细胞浓度达到起始浓度的1.37 倍。梁英等(2011)对球等鞭金藻进行生长曲线的绘制, 第 10 天生长达到平稳期, 与本研究结果基本一致。丛超等(2017)研究的5 株球等鞭金藻均在培养第 4—5 天后便进入稳定期, 与本研究中的PHY7004 相比, 其生长周期要短得多。这可能与培养条件和株系不同有关。
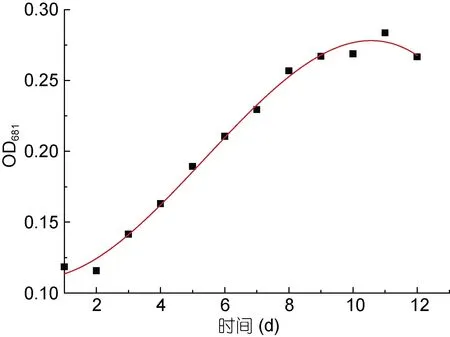
图4 球等鞭金藻PHY7004 的生长曲线(33°C)Fig.4 Growth curve of I. galbana PHY7004 (33°C)
目前微藻培养的生长速度普遍较快, 微藻的生长速度与接种浓度、培养方法和培养条件等有很大关系(Moheimani et al, 2011; 孙春晓等, 2014)。本实验数据仅限于实验室条件下测出, 藻株应用于大规模生产时的繁殖速度还有待进一步研究。
从图5 和图6 可以看出, pH 值范围为7—9, 氮、磷比例分别为12:1、13:1、14:1 时, PHY7004 的细胞数量和生长速率均呈增长趋势, 这可能是因为 pH 值和氮、磷比例均在球等鞭金藻耐受范围内。球等鞭金藻在pH 值为3—9 的条件下均能生长, 研究发现金藻生长的最适pH 范围为7.0—9.0, 当偏离这个范围时,藻体生长和体内代谢活动都将会受到抑制(王珺等,2008)。在氮、磷比等于 16:1 的条件下, 球等鞭金藻的生长速度最快(刘东艳等, 2002)。
在培育第2 天时, 各条件下的藻生长速率均增长最快; 与第2 天相比, 培育第3 天各条件下的藻生长速率明显降低; 培育第 3—8 天藻生长速率均稳步上升。据图 5 可知实验期为球等鞭金藻的对数生长期,后期还会增长。
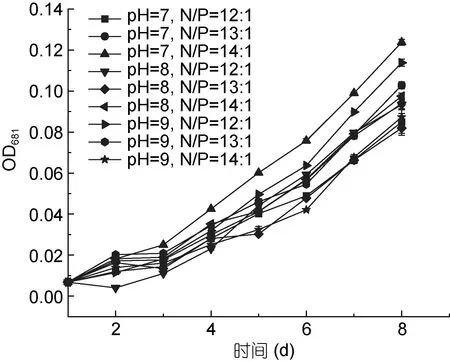
图5 球等鞭金藻PHY7004 在不同优化条件的生长曲线(40°C)Fig.5 The growth curve of I. galbana PHY7004 in different optimum conditions (40°C)
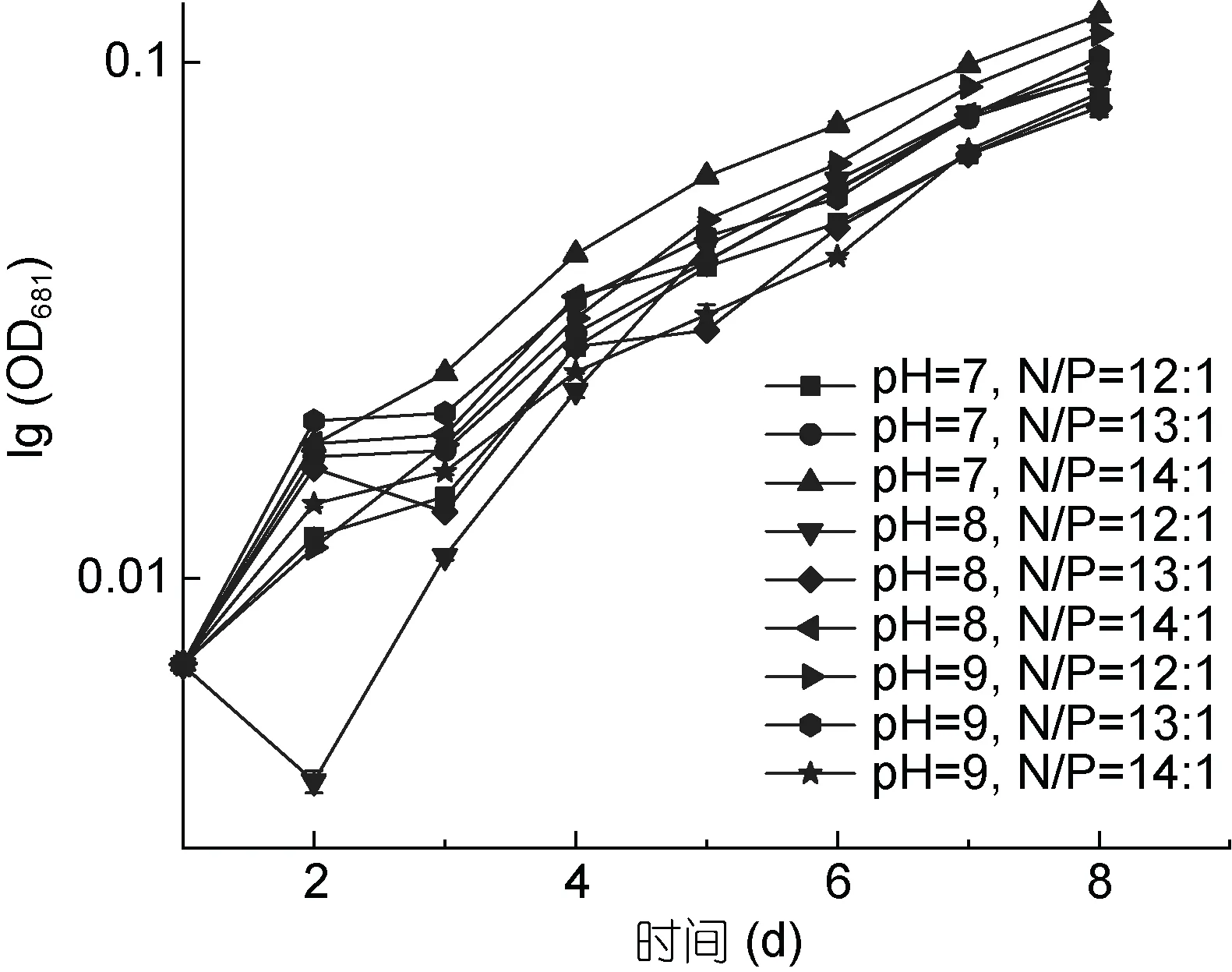
图6 PHY7004 在不同优化条件下的生长速率(40°C)Fig.6 The growth rate of PHY7004 in different optimum conditions (40°C)
通常海水中的 pH 比较稳定(pH≈8.2), 但受自然因素影响, 海水pH 值会产生波动, pH 会影响脂质生产率, 对细胞代谢具有广泛影响(Ren et al, 2013)。氮磷营养盐在藻类生长过程中是重要的影响因子。磷对于生物质生产至关重要。因此本实验对培养基中的氮磷比和 pH 值进行优化, 结果表明, 在 N/P=14:1,pH=7 的状态下, 藻细胞的生长速率最快, 细胞数量最高, 因此, PHY7004 在 33°C 下最适的培养基N/P=14:1, pH=7。在 33°C 下, 当培养基 N/P=12:1 时PHY7004 较适pH=9; 当培养基N/P=13:1 时PHY7004较适 pH=9; 当培养基 N/P=14:1 时 PHY7004 较适pH=7; 当培养基 pH=7 时 PHY7004 较适 N/P=14:1; 当培养基 pH=8 时 PHY7004 较适 N/P=12:1; 当培养基pH=9 时 PHY7004 较适 N/P=12:1。
2.4 4 株球等鞭金藻蛋白质的含量
球等鞭金藻平均蛋白质含量为 34.29 mg/L, 分离的4 株球等鞭金藻蛋白质含量差异较大, PHY7003蛋白质含量最高, 见表1。饲料蛋白质含量对动物消化酶影响显著, 在鱼虾等水产动物中均有报道(黄凯等, 2003; 赵东海, 2004)。宋萍萍等(2015)研究的球等鞭金藻的蛋白质含量可达到 110 mg/L, 其蛋白含量远高于本实验藻株。蛋白质的含量与微藻的品系、培养条件和培养方式有关(Wang et al, 2004; 张跃群等, 2009)。
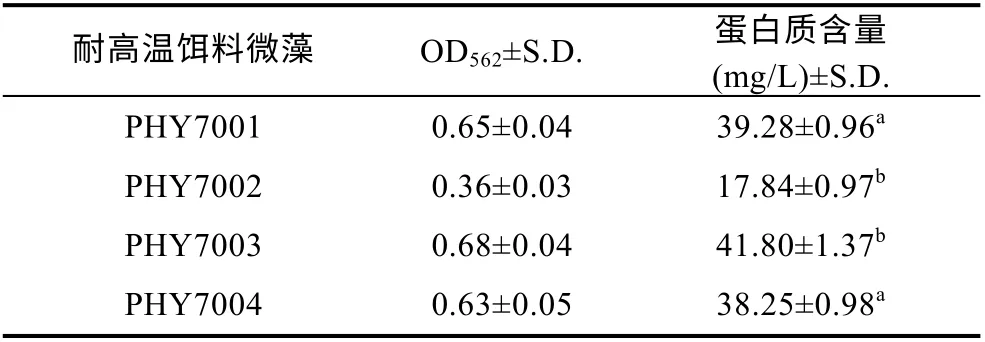
表1 耐高温饵料微藻蛋白质含量Tab.1 Protein content of high-temperature-resistant microalgae bait
总蛋白含量是评价微藻营养价值的重要指标之一, 但不是唯一标准。对于饵料微藻而言, 脂肪含量,特别是所含不饱和脂肪酸的总量和组成也是评价微藻是否适合海水养殖生物应用的重要指标。微藻饲养动物的效果不因微藻蛋白质水平而异, 微藻所含的必需脂肪酸能否满足动物的营养需求才是评定微藻营养价值的重要指标(Brown et al, 1997)。高蛋白饲料或饵料对养殖动物体内的消化道、酶系、微生态平衡都会有显著影响, 有时也会损害养殖动物的健康。
藻类蛋白的研发正在迅速发展, 小球藻、栅藻、螺旋藻等蛋白产品开发已吸引了众多的目光, 在保健品和饲料行业小有市场, 然而其他72000 种微藻资源还未得到研究和开发。本文研究的球等鞭金藻藻株,为微藻蛋白的开发提供了一个新的原料。球等鞭金藻蛋白质含量在已经研究的微藻中含量较高。以这几株藻为基础进行微藻工业开发, 在生物能源、微藻饵料、单细胞蛋白等方面均有巨大的应用潜力, 值得对其进行更多的研究和应用发掘。
2.5 单环刺螠的摄食强度
在筛选出的耐33°C 的球等鞭金藻中, 4 月龄单环刺螠幼苗(体重0.32—0.90 g, 体长2.10—3.90 cm)对筛选出的四株耐高温球等鞭金藻的摄食强度无显著性差异(P>0.05), 单环刺螠幼苗对PHY7002 的摄食强度最大, 见表 2 。一般认为饵料颗粒的大小是判断其是否适合育苗生产的关键要素。由表 2 可知,PHY7002 的细胞大小跟滤食性动物 4 月龄单环刺幼苗的口径相一致。值得注意的是, 本实验中的单环刺螠幼苗对蛋白含量最少的PHY7002 摄食强度最大,对蛋白含量最多的 P HY7003 摄食强度最小。这说明藻株的蛋白含量与单环刺螠对其摄食强度不一定成正比, 这与前人研究结果一致, 饲料蛋白含量与增重率并不呈正比(朱伟等, 2005)。
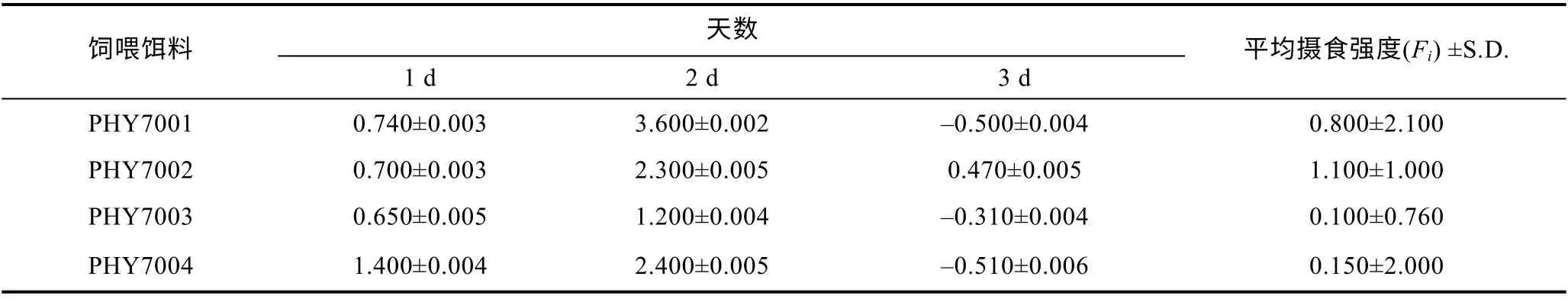
表2 单环刺螠幼苗对球等鞭金藻的平均摄食强度Tab.2 Feeding intensity of larval U. unicinctus on Days 1—3
最新研究表明, 在长期的进化过程中, 许多海洋生物幼体拥有选择适合自身生长所需的藻类的“特异功能”, 可利用其尚未明确的“嗅觉”等方式选择自己喜欢的饵料(麦康森, 2020)。球等鞭金藻(I. galbana Parke)是一种金黄色的金藻, 个体小、繁殖速度快、营养丰富, 并且没有细胞壁, 容易被动物幼虫消化吸收(王珺等, 2002), 可作为优质饵料。已有研究(Kain et al, 1958; 陈椒芬等, 1985; 周汝伦等, 1994)报道,球等鞭金藻(I. galbana Parke)是贻贝、牡蛎、泥蚶等双壳类贝苗和对虾幼体的优良饵料。但目前还没有用球等鞭金藻饲喂单环刺螠的报道。单环刺螠人工养殖正处于摸索起步阶段, 目前用饵料微藻饲养中国对虾, 牙鲆等水产动物较多, 对于单环刺螠摄食饵料微藻的研究甚少。有研究表明, 使用微绿拟球藻和三角褐指藻的混合饵料投喂单环刺螠幼苗会取得比较明显的促生长效果(常林瑞等, 2018)。因此, 在今后单环刺螠人工配合饲料的研发中可适当添加球等鞭金藻。
3 结论
通过显微操作技术分离出4 株球等鞭金藻。经耐高温测试, 分离出的 4 株球等鞭金藻均可耐受 33°C,且 PHY7004 生长速率最快, 分离出的各藻株细胞的平均直径为 5.5—7.5 μm; 经培养基优化实验得, 可耐受 33°C 且生长速率最快的一株球等鞭金藻(PHY7004)在 33°C 下较适的培养基条件为 N/P=14:1,pH=7。通过耐高温藻的单环刺螠幼苗饲喂实验, 发现单环刺螠幼苗对PHY7002 摄食强度较高, 这两株藻后期可以作为单环刺螠育苗期间的饵料微藻备选。人们对单环刺螠的摄食生理学还未开展系统的研究, 本实验可为单环刺螠的池塘养殖技术提供一定的参考。
