微生物菌剂对土壤酸碱性的改良研究
2021-02-03彭喜之王涛辉马珺童应凯王雪梅叶玉栋陈帅君
彭喜之,王涛辉 , 马珺 怡,童应凯,王雪梅,张 敏,叶玉栋,陈帅君*
(1. 天津农学院农学与资源环境学院生物技术系 天津300384;2. 天津恒基利得生物科技发展有限公司 天津300392)
0 引 言
土壤是农业发展基本的生产资料,土壤质量优略直接影响农业的健康发展。盐碱化是影响土壤质量的一个关键问题。盐碱地是盐类集积的一个种类,是指土壤里面所含大量的盐分会破坏土壤水分的平衡,改变土壤的结构,致使土壤通透性变弱,渗透率变大,容易板结和胶粘,土壤肥力下降,影响到作物的正常生长。我国有 9913万公顷盐碱化土地[1],碱土和碱化土壤的形成,大部分与土壤中碳酸盐的累积有关,因而碱化度普遍较高,严重的盐碱土壤地区植物几乎不能生存[2]。
本研究通过微生物发酵菌肥修复技术来对盐碱土和酸性土进行改良[3]。盐碱土中富含大量盐碱成分,而酸性土壤中存在着过酸物质,故制备微生物菌肥所用的微生物菌株必需具有耐酸、耐盐、降盐特性,才能在盐碱化和酸化土壤中起到治理作用[4]。研究选育耐盐、降盐微生物在本课题中具有关键作用,如果能从过酸、过碱物质或土壤中提取出某些具有抗酸碱性并能在其环境下生长的菌种[5],将其投入肥料生产,施肥于盐碱土地,可以达到改良土地酸碱性的目的。本文从动物粪便与盐碱土壤中提取出部分菌种,用于进行盐梯度生长测试;筛选出 4个耐盐菌株,通过分别测试其对盐碱土和酸性土的中和降解能力,研究4种菌与肥料混合发酵后对土壤酸碱性调节的最佳比例并获得了成功。
1 材料与方法
1.1 实验材料
1.1.1 原料与菌种
从天津静海鸡养殖场(恒基利得生物科技发展有限公司)获取的鸡粪便、盐碱土壤。
1.1.2 培养基
富集培养基:牛肉膏3g,蛋白胨10g,NaCl 5g,琼脂 15~20g,水 1000mL,pH 7.0~7.2。
M6 培养基:MgS04·7H20 0.25g,葡萄糖 10g,NaCl 20g,FeSO4·7H2O 0.5g,(NH4)2SO42.0g,KH2PO413.6g,去离子水 1000mL,pH 7.5(KOH 调节)。用于菌株筛选培养。
M63 盐梯度培养基:FeSO4·7H20 0.5g;KH2PO413.6g;(NH4)2SO42.0g;MgSO4·7H2O 0.25g;葡萄糖10g;NaCl视需要,自来水1000mL,pH 7.5(KOH调节)。用于菌株筛选培养。
1.2 主要仪器
pH仪(STARTER 2100S上海奥豪斯仪器公司),无菌操作台(BCM-1300A 苏净安泰),恒温培养箱(PH240A 上海一恒科技有限公司),电子天平(AR124CN 上海奥豪斯仪器公司),高压蒸汽灭菌锅(LDZX-30FBS 上海申安医疗器械厂)。
1.3 实验方法
1.3.1 微生物菌株分离
根据吴晓卫[4]的方法,从鸡粪和盐碱土壤中分离菌种。
1.3.2 耐盐菌筛选
选取培养皿上生长快、直径大的菌株用平板划线法接在平板上,在 30 ℃的恒温培养箱培养 72h。所得菌落再次划线转接到平板上并在恒温培养箱中培养,之后将平板上的单菌落转接斜面,置于冰箱 4 ℃保存。其中每项操作均重复3次。
筛选出 4 种生长良好的菌:N1、N2、N3、N4。筛选结果生长情况见表1。
1.3.3 菌株形态鉴定
将所得菌株划线转接到富集培养基平皿内,30℃恒温培育 24h后,显微镜观看菌株生长情况和形态特征:记录菌体形态、菌体大小、菌落质地、菌落边缘。鉴定参照微生物学《常见细菌系统鉴定手册》和《伯杰氏系统细菌学手册》实行。

表1 菌落筛选结果Tab.1 Results of colony screening
1.3.4 所选菌株性能检测
将经过鉴定的微生物菌株分别接入液体盐梯度培养基,培养基含 NaCl量分别为 10、20、30、40、50、60g/L。30℃恒温摇瓶发酵 24h,运用紫外分光光度计法吸光度 595nm值[9]检测发酵液内菌体数来判定菌株对盐耐受生长情况[9]。
1.4 微生物菌肥发酵工艺
1.4.1 发酵原料和工艺流程
以鸡粪为原料,粪便含水量很高,pH自然。
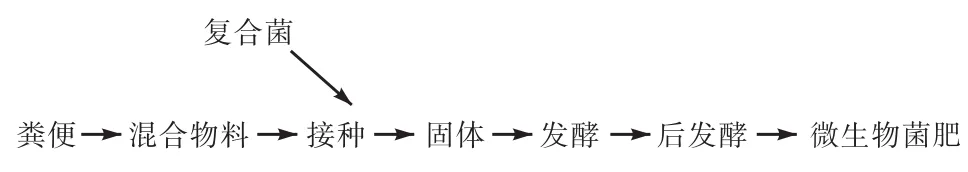
图1 工艺流程Fig.1 Process flo w
斜面保藏的菌种转接到相应的培养基培养进行活化,30 ℃恒温 24h。巨大芽孢杆菌、枯草芽孢杆菌和假单胞菌用肉汤培养基培养[10];酵母用 PDA培养基培养[11]。活化后的菌株留待扩大培养。
1.4.2 混合菌剂拮抗性能研究
将所得到的固体菌剂按照不同比例混合制备混合菌剂[12],并转接到同一肉胨平板上和同一肉胨培养基摇瓶内培养,探究混合菌剂间是否产生拮抗抑制作用[13]。通过观察平板上菌落生长情况、菌落数目、表面形态和检测摇瓶内各菌含量判断是否具有拮抗作用。
1.4.3 复配方案
按照吴晓卫[4]的方法,按照 1%接种量将混合菌剂接入粪便混合物中进行发酵,研究不同比例制成的混合菌剂对发酵结果的影响[14]。以发酵菌肥中大分子有机质降解多(有机质含量高)、活菌数目多和发酵过程升温快、保温时间长(有利于杀死粪便中的虫卵、病毒或减少有害物质和促进菌肥腐熟)的混合比例作为菌种最佳复配比例,最佳比例见表2。
1.5 土壤pH值恢复测定
1.5.1 单菌种对土壤pH值恢复测定
取天津农学院内农学种植土壤用 NaOH和 HCl调节 pH=2、4、6、8、10、12、14,每个分组做 3 次,取平均值[14]。将各试验菌种分别施入并测定其对pH的恢复能力,设立一组对照组,加入等量超纯水进行对照[15]。
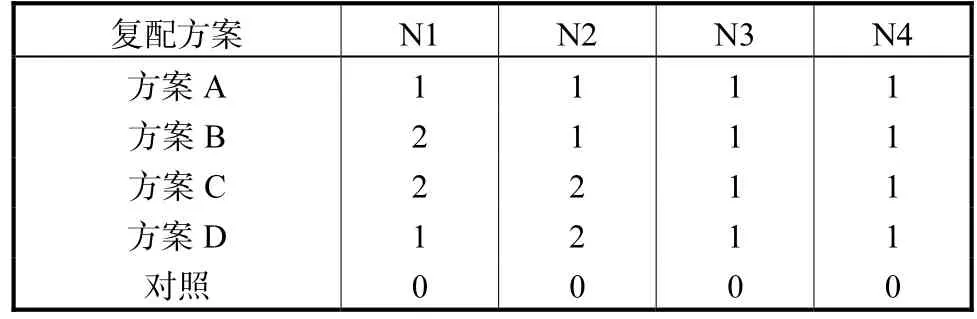
表2 混合比例Tab.2 Mixing ratio
1.5.2 复配菌种对培养基pH恢复能力测定
按复配方案中的比例将其与肥料混合发酵,再次取天津农学院内农学种植土壤用NaOH和HCl调节pH=2、4、6、8、10、12、14,每个分组做 3 次,取平均值[16]。施入并测定4种方案对pH值的恢复能力。
2 结果与分析
2.1 菌株形态鉴定
根据微生物学《常见细菌系统鉴定手册》和《伯杰氏系统细菌学手册》判断出图 2至图 5的结果。N1为巨大芽孢杆菌属,N2为枯草芽孢杆菌属,N3为假单胞菌属,N4为酵母菌属。
图2 N1巨大芽孢杆菌属Fig.2 N1 Bacillus megaterium

图3 N2枯草芽孢杆菌属Fig.3 N2 Bacillus subtilis

图4 N3假单胞菌属Fig.4 N3 Pseudomonas

图5 N4酵母菌属Fig.5 N4 Saccharomyces
2.2 菌株性能检测
如图6所示,其中枯草芽孢杆菌属在盐浓度超过50g/L时可继续生长,较其他菌属耐盐含量高,其最适生长浓度为 45g/L左右;其次是巨大芽孢杆菌属,盐浓度达到 50g/L的培养液内菌体数超过另外两种,菌体数在盐含量 30g/L时达到最高[9],巨大芽孢杆菌总体生长情况不如枯草芽孢杆菌;假单胞菌属和酵母菌属的最适盐浓度为 20g/L,过高的盐浓度对它们的生长有毒害作用。

图6 NaCl含量对各菌株生长影响Fig.6 Effect of NaCl content on growth of each strain
2.3 混合菌剂拮抗性能
实验发现混合菌剂在肉胨培养基上和摇瓶内(吸光度595nm检测)4种微生物均生长良好,无拮抗性作用,可以混合使用。
2.4 单菌种对土壤pH恢复测定结果
单菌试验结果如图7至图10所示。
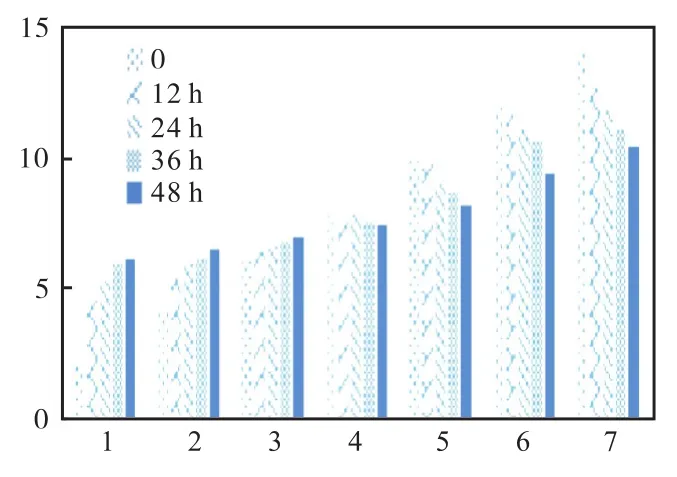
图7 巨大牙孢杆菌对土壤pH恢复测定Fig.7 Determination of soil pH recovery by Bacillus megaterium
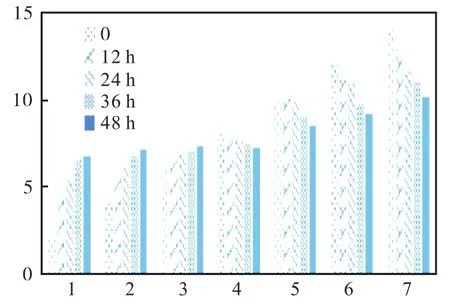
图8 枯草牙孢杆菌对土壤pH恢复测定Fig.8 Determination of soil pH recovery by Bacillus subtilis

图9 酵母菌属对土壤pH恢复测定Fig.9 Determination of soil pH recovery by Saccharomyces
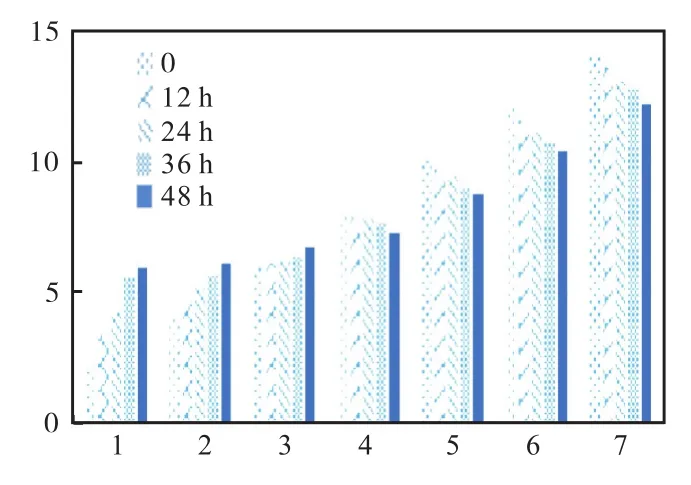
图10 假单胞菌属对土壤pH回复测定Fig.10 Determination of soil pH recovery by Pseudomonas
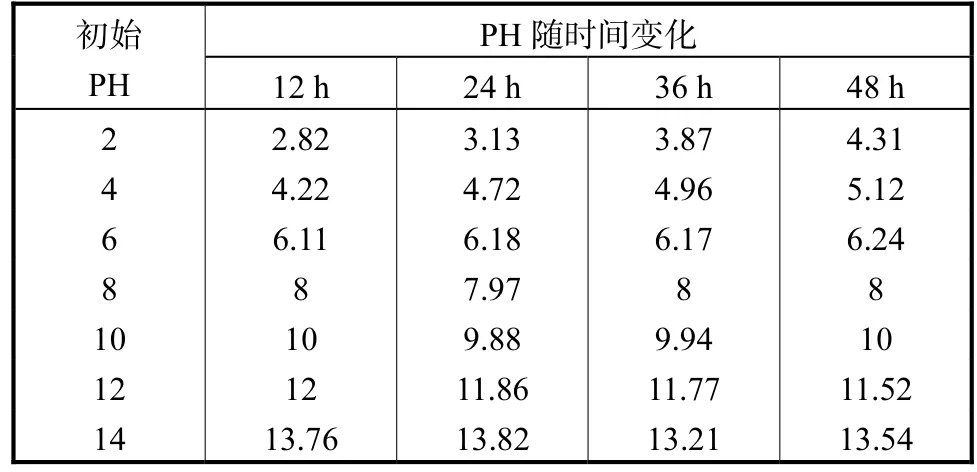
表3 对照组pH变化测定Tab.3 Change of pH value in control group
以上各图中 2至 8为起始设定土壤 pH分别为2、4、6、8、10、12、14 组的待测样品。从数据结果可知:枯草芽孢杆菌对 pH的恢复是显著的,在 pH呈酸性时恢复能力稳定,能逐渐将其恢复到 pH 6以上并接近7的程度;而在pH呈碱性时恢复能力则较弱一些,随着 pH的逐渐升高恢复能力减弱。巨大芽孢杆菌与其相似,但在 pH呈碱性时恢复能力上显得更弱一些。而酵母菌与假单胞菌在pH为酸性时的恢复能力稳定,但 pH呈碱性时恢复能力变弱,随着 pH的升高而降低。通过观察对照组可知,在 pH土壤过酸的情况下,由于酸性物质的自然挥发会使其 pH向平衡的一端转移,但是若没有微生物菌剂辅助的话,往往在某一个阶段就停止变化。根据表 3对照组所示,碱性土壤或过碱土壤中的 pH则几乎不随时间变化而变化,很好地展示出了微生物对土壤的修复能力。其中枯草芽孢杆菌对土壤恢复能力最佳,其次为巨大芽孢杆菌,假单胞菌与酵母菌属最弱。
2.5 复配菌种对培养基pH恢复能力测定结果
由图 11可知,A方案的恢复能力在 pH呈酸性时恢复能力不错,但在 pH呈碱性时弱于其他组。B方案与D方案对比A方案较强。但是C方案在pH呈酸性或碱性时,其恢复度都与其他 3组有明显差异,在 pH呈酸性时稳定上升,在 pH呈碱性时则与其他组不同,产生了显著效果,使 pH下降迅速且稳定。4种复配比例下的混合发酵中,对土壤 pH恢复能力为C>B>D>A;最佳配比为枯草芽孢杆菌∶巨大芽孢杆菌∶假单胞菌∶酵母菌=1∶2∶1∶1。
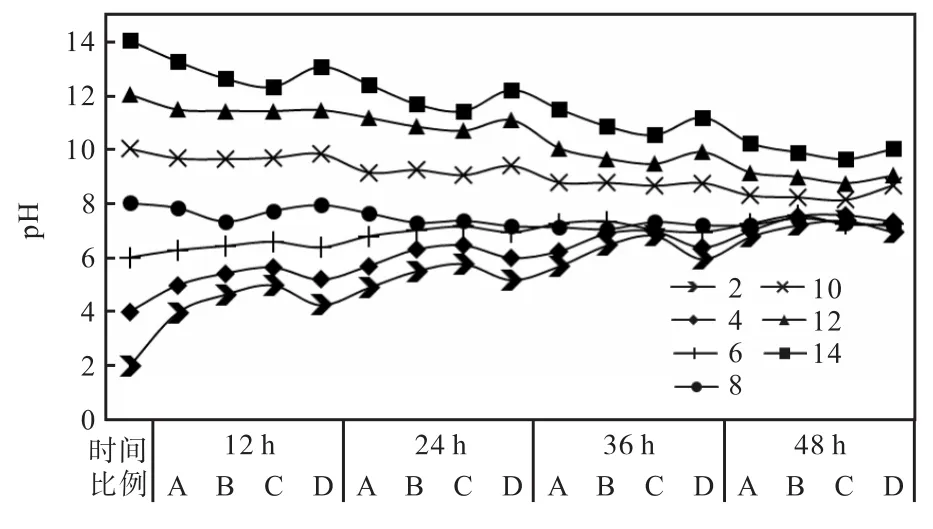
图11 4个比例的复合菌剂pH恢复测定Fig.11 Determination ofpH recovery by four proportions of compound bacteria
3 讨 论
本研究从天津静海鸡养殖场的粪便和盐碱地中分离出4种对酸碱有抗性并能改良其pH值的菌属,对其进行镜检观察并对照《手册》大致确定其为:枯草芽孢杆菌属、巨大芽孢杆菌属、假单胞菌属、酵母菌属。在确定之后分别测定了 4种菌对酸碱土壤的恢复能力,并安排了对照组进行对比,最后确定枯草芽孢杆菌属对土壤pH恢复的能力最佳。对混合菌剂开展了拮抗性试验,发现菌剂在同一平板和同一摇瓶实验中未显示菌株间有拮抗性,菌株生长良好。
确定混合菌剂肥最佳复配比例,再以 1%接种量鸡粪为原料来发酵微生物菌种,测定土壤 pH恢复值作为评价标准,最终确定了4种混合菌剂的最佳配比为 1∶2∶1∶1,在此比例下对土壤 pH 值恢复能力最佳。
由于实验材料的限制,本研究用以发酵微生物菌肥的菌株筛选方法比较单一,需要多次重复的实验过程才能得到高效株,过程繁琐。可以考虑结合化学诱变剂、等离子体诱变技术和基因组技术对菌株进行改造,获得耐盐性强的突变菌株。后续将尝试运用诱变等方法尽可能筛选出更高效的菌株并再次测定,之后施入土壤并种植作物以测定更多数据。
