稻虾综合种养模式下吡虫啉的富集与残留消除
2021-02-02李司棋杨秋红何绪刚刘永涛董靖杨移斌胥宁艾晓辉刘绍春
李司棋,杨秋红,何绪刚,刘永涛,董靖,杨移斌,胥宁,艾晓辉,刘绍春
1.华中农业大学水产学院,武汉 430070;2.中国水产科学研究院长江水产研究所/湖北省水产品质量安全工程技术研究中心/农业农村部水产品质量安全控制重点实验室, 武汉430223;3.中国水产科学研究院质量与标准研究中心/农业农村部水产品质量安全控制重点实验室,北京100141;4.岳阳渔美康生物科技有限公司,岳阳 414000
吡虫啉是国内近年发展最快的新烟碱类(neonicotinoid)杀虫剂,可防治多种抗性害虫,作用效果持久高效,杀虫谱广,毒性低,残留少,尤其对刺吸式口器害虫具有特殊作用,并具有很大的发展潜力[1]。新烟碱类杀虫剂是除拟除虫菊酯以外市场占有率增长最快的杀虫剂[2]。研究表明,只有约1%的农药作用于目标生物。其余的一部分残留在土壤中,和土壤形成结合残留态,结合残留量一般占使用量的20%~70%[3],还有一部分间接进入水环境,进而影响土壤生物和水生生物[4]。
农药给水产养殖业带来危害的事件屡见不鲜。1962年在日本北海道,由于在稻田中使用五氯酚钠,一次有超过9万t的鱼被毒死[5]。在中国,也发生过由于飞机喷药不当,大量鱼虾类死亡的事故。此外,相关研究也证实了吡虫啉对水产动物生理生化和抗氧化系统具有潜在的危害,如热带鱼类条纹鲮脂鲤(Prochiloduslineatus)在吡虫啉质量浓度为1 250 μg/L暴露120 h抗氧化酶会产生反应,出现血糖降低和DNA损伤[6];稀有鮈鲫(Gobiocyprisrarus)暴露在2.0 mg/L吡虫啉中也出现了氧化应激和遗传损伤,红细胞发生明显变化,免疫应答降低[7]。吡虫啉对沼虾48 h LC50<1.0 mg/L,参照农药对鱼类的毒性等级划分标准,吡虫啉对虾类属于高毒农药[8]。随着克氏原鳌虾产业的火热升温和稻渔综合种养模式的推广[9],农药在稻渔综合种养模式下使用频率的增加,水-底泥-克氏原螯虾中的残留问题也越来越多地引起关注[10]。笔者通过室内暴露试验以及室外田间残留消除试验,研究吡虫啉在克氏原鳌虾中的富集和残留消除情况,以期评价吡虫啉对克氏原鳌虾的安全性,为制定合理的农药控制技术提供科学的参考依据。
1 材料与方法
1.1 试 剂
60%吡虫啉悬浮剂(有效成分为300 g/L,中国农科院植保所廊坊农药中试厂);吡虫啉标准品(纯度99.8%)(德国 Dr. Ehrenstorfer GmbH 公司);乙酸、乙腈、甲醇、二氯甲烷、乙酸乙酯(色谱纯;美国CNW公司);C18粉、乙二胺-N-丙基硅烷(PSA)、石墨化炭黑粉(GCB) (博纳艾杰尔科技公司);超纯水(电阻率为18.2 MΩ·cm,美国Millipore公司)。
1.2 试验动物
试验所用的克氏原鳌虾(Procambarusclarkii)购于湖北省荆州市沙市农场洪塘分场,体质量(17.31±0.89) g,在试验前,将其置于玻璃水族箱中驯养一段时间,试验用水为充分曝气的自来水,并持续供氧,水温(19.7±0.24) ℃,溶氧为(7.22±0.11) mg/L,每天换水并投喂饲料。选择健康完整的克氏原螯虾进行试验,试验前1 d停止喂食,试验过程中不再喂食。
1.3 试验设计与采样
1)室内暴露试验。选取吡虫啉质量浓度0.2 mg/L(参考郑岚等[11]施药的推荐剂量)为试验组,同时设置空白组。试验过程采用静水药浴的方法,吡虫啉质量浓度由60%吡虫啉悬浮剂(有效成分为300 g/L)稀释配制而成。空白组分别采集肌肉、血淋巴、鳃组织、肠道、肝胰脏等组织测定吡虫啉的含量,检测值均为空白,之后开始暴露试验。暴露试验在50 cm×35 cm×30 cm水族箱中进行,每箱放10只克氏原鳌虾,设置水温在(20±1) ℃,测得水体pH 6.68±0.18,溶氧为(7.32±0.21) mg/L。
暴露后的第2、4、6、8、12、24、48、72、96、120、144小时分别从试验组随机取18只克氏原鳌虾,6只为1个平行,先用纯净水冲洗虾体表面残余药物,再用干净的纱布吸取虾体表面水分,采集肌肉、血淋巴、鳃组织、肠道、肝胰脏等组织测定吡虫啉的含量。肌肉、肝胰脏、血淋巴取样方法参考岳刚毅[12]的方法,肠道从尾部抽出[13],取出适量鳃组织,剔除附着物,用滤纸吸干表面水分。样品在正式处理之前都置于-20 ℃冰箱保存。同时在0、2、4、6、8、12、24、48、72、96、120、144 h从试验组采集水样500 mL进行前处理。
2)田间残留消除试验。 试验地点在湖北省应城市稻虾养殖示范基地,围取长宽高5 m×4 m×0.2 m种植水草的水田,四周垒梗作为试验区域。60%吡虫啉悬浮剂以0.2 mg/L(参考郑岚等[11]施药的推荐剂量)用量均匀喷雾,分别于施药后0.083、0.5、1、2、3、4、5、6、7、14、21、28 d采集样品,克氏原鳌虾样品采集方法和采集组织同本文材料与方法“1.3”中“1)”。同时采集水样,每个时间点取3个平行,每个水样不少于500 mL,装入棕色样品瓶中,-4 ℃保存。底泥按照上述时间点采集,每个时间点取3个平行,每个样品不少于200 g,贮于-20 ℃低温冰柜内保存。试验期间水温在8~26 ℃,水体pH 7.28±0.20,溶氧为(7.13±0.18) mg/L。
1.4 液相色谱-质谱条件
液相色谱柱:Symmetry C18柱(100 mm×2.1 mm×3.5 μm,美国Waters公司);柱温:40 ℃;流速为300 μL/min;流动相A:80%甲醇,B:20%水,进样量为10 μL。
质谱离子源:加热大气压电喷雾HESI;离子化模式:正离子模式;扫描方式:选择离子反应监测模式(SRM);喷雾电压:3 500 V;蒸发气温度:200 ℃;鞘气和辅助气均为高纯氮气,压力均为500 kPa;碰撞气为高纯氩气,200 Pa;离子传输毛细管温度:350 ℃;一级质谱扫描(Q1 )半峰宽: 0.7 ku,三级质谱扫描(Q3 )半峰宽: 0.7 ku。
1.5 样品提取和净化
克氏原鳌虾组织、水样、底泥样品的前处理方法参考笔者所在研究室已发表文献[10]。
1.6 标准溶液的配制
准确称取适量吡虫啉标准品,用甲醇溶解制得质量浓度为100 mg/L的标准储备液,避光贮存在4 ℃冰箱;根据需要用流动相稀释标准储备液,配制质量浓度为0.1、0.2、0.5、2.0、5.0、10.0 μg/L的一系列标准工作液。
取空白克氏原螯虾样品按照本文“1.5”进行处理,定容得到空白样品溶液,然后用空白样品溶液稀释吡虫啉标准储备液,配制吡虫啉质量浓度为0.2~50.0 μg/L一系列范围的空白基质匹配标准溶液。
2 结果与分析
2.1 线性范围和检出限
以色谱峰面积为纵坐标,对应的浓度为横坐标,绘制标准曲线。测定结果表明,吡虫啉在质量浓度为0.2~50.0 μg/L范围内线性关系良好,相关系数≥0.990 4。以信噪比S/N=3确定方法的检出限、信噪比S/N=10确定方法的定量限具体结果见表1。

表1 吡虫啉的检出限、定量限、线性范围和线性方程 Table 1 Linear range,regression equation,limit of detection(LOD) and limit of quantification(LOQ) of imidacloprid
2.2 基质效应
通过比较基质匹配标准曲线与溶剂标准曲线斜率值来评价基质效应,比值越接近1,基质效应越小,比值越远离1,基质效应越大。基质效应小,溶剂标准曲线可直接用于定量分析;基质效应较大,为了消除基质效应,采用基质标准曲线进行定量。试验结果表明,吡虫啉在克氏原螯虾肌肉、血淋巴、鳃组织、肠道、肝胰脏的基质比率分别为0.42、1.07、1.01、1.03、0.67,其中肌肉和肝胰脏基质效应较大。
2.3 回收率的测定
取已制备好的克氏原螯虾、水样和底泥的空白样品,分别在样品中添加低、中、高浓度的吡虫啉标准品各5份,按本文“1.5”方法进行样品提取和净化,测定样品回收率。结果表明,吡虫啉在克氏原鳌虾样品中的平均添加回收率为62.64%~104.79%,变异系数为1.15%~11.93%,吡虫啉在水样中的平均添加回收率为88.29%~110.42%,变异系数为2.16%~3.25%,吡虫啉在底泥中的平均添加回收率为89.38%~116.60%,变异系数为2.05%~7.51%,表明该方法的准确度和精确度能满足农药残留测定的要求。
2.4 吡虫啉在室内试验下的富集情况
1) 吡虫啉在克氏原鳌虾体内的富集情况。由表2可知,吡虫啉在推荐使用的质量浓度下,肌肉的富集曲线呈现先上升后下降的趋势,在推荐使用质量浓度下暴露的前6 h中,吡虫啉的累积含量上升速率较平缓,然后呈现上升趋势,并在24 h达到最大累积量101.09 μg/kg。肝胰脏的富集曲线与肌肉相似,推荐使用浓度下暴露12 h之前,吡虫啉在肝胰脏的富集量都呈现平稳上升状态,72 h达到最大累积量36.00 μg/kg,然后下降。克氏原鳌虾的鳃组织对吡虫啉的富集与其他组织相比要迅速很多,最大累积时间较其他器官提前许多,并且累积量也高出许多。这是因为鳃是克氏原鳌虾的重要呼吸器官,是与外界进行气体交换的重要器官。鳃组织在第2小时吡虫啉的含量为37.20 μg/kg,后面呈现阶梯式上升,并在48 h达到最大值110.97 μg/kg,随后又下降稳定在一定浓度水平。肠道和血淋巴的富集曲线较简单,暴露农药的前24 h,都呈现上升的趋势,肠道和血淋巴在24 h吡虫啉的累积量达到最大,分别是80.72 、81.43 μg/kg。但不同的是,24 h之后,吡虫啉在肠道中吡虫啉的含量出现下降趋势,而考虑到血淋巴和肠道分别作为克氏原鳌虾的循环和消化器官,肠道能将部分毒物排出,而血淋巴可将部分毒物随血液流动缓慢释放到机体其他组织。吡虫啉在克氏原鳌虾中的累积量表现为鳃组织>肌肉>血淋巴>肠道>肝胰脏。
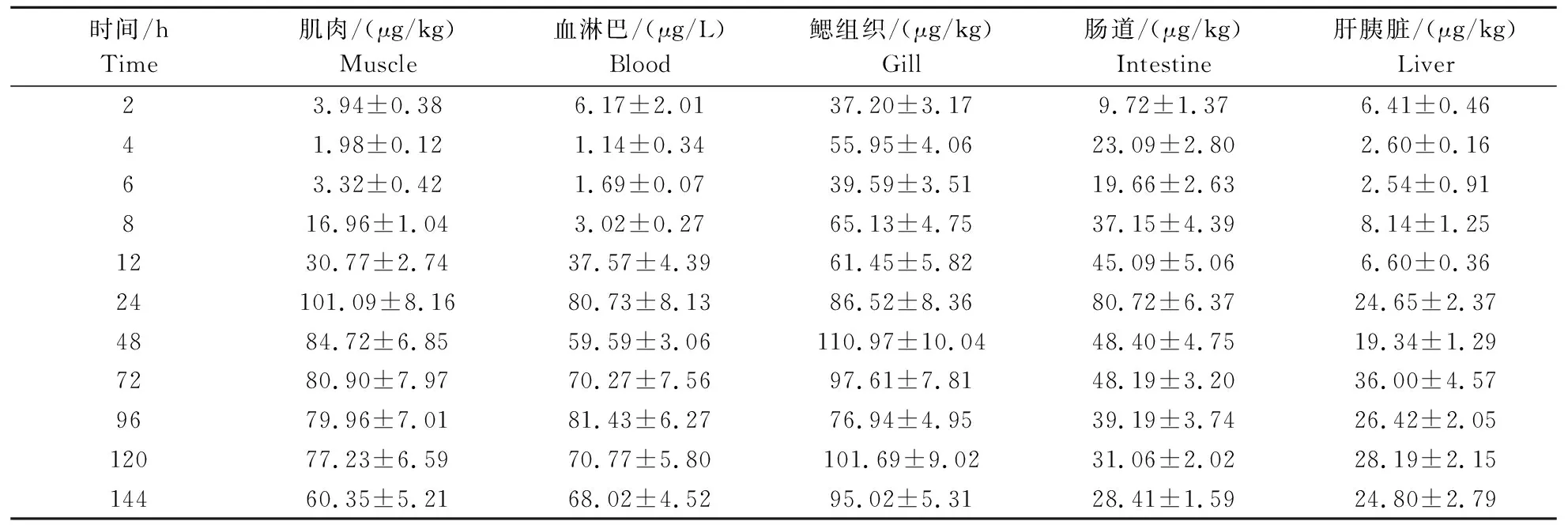
表2 吡虫啉在克氏原鳌虾体内各组织的富集情况 Table 2 Enrichment of imidacloprid in various tissues of Procambarus clarkii
2) 吡虫啉在水体中的富集消除情况。在推荐使用浓度下,水体中吡虫啉的含量随着时间的推移,呈现缓慢下降的趋势,暴露144 h,水体中吡虫啉的含量下降到103.42 μg/L。
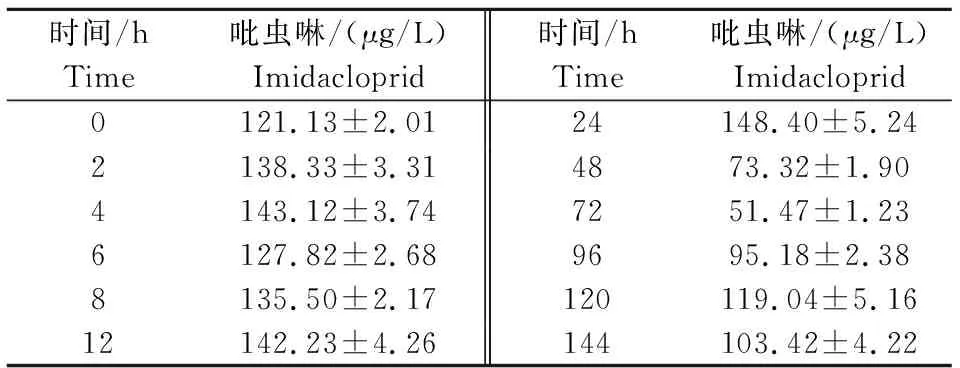
表3 吡虫啉在水体中的富集消除情况 Table 3 Enrichment and elimination of imidacloprid in water
2.5 吡虫啉在稻虾综合种养模式下的残留消除情况
1) 吡虫啉在克氏原鳌虾中的残留消除情况。如表4所示,按推荐使用浓度施药吡虫啉之后,吡虫啉在肌肉中的消解动态呈现波动式的下降趋势,施药后的2、14 d,吡虫啉在肌肉中达到了较高的累积量(84.93、74.81 μg/kg)。14 d之后随着时间的增加呈现逐步下降的趋势,28 d降至20.44 μg/kg。吡虫啉在鳃组织的消解动态,整体呈现下降趋势,28 d降至1.28 μg/kg。吡虫啉在血淋巴和肠道中的消解动态相似,施药后都呈现波动式的上升趋势,分别在6 d和4 d达到最大累积量27.64、33.13 μg/kg,之后逐步下降。而吡虫啉在肝胰脏中的累积含量一直不高,呈现波动式的轻微增长,施药28 d后肝脏中吡虫啉的含量仅为0.75 μg/kg。吡虫啉在克氏原鳌虾中的累积量表现为肌肉>肠道>鳃组织>血淋巴>肝胰脏。
2) 吡虫啉在稻田底泥和水中的残留消除情况。如表5所示,吡虫啉在稻田底泥中的降解呈现梯度式的下降趋势,在施药后的第28天,降到10.94 μg/kg。吡虫啉在稻田水中呈现逐步消解的趋势,吡虫啉在水中的降解速度较快,施药后28 d,吡虫啉降解率为97.54%。
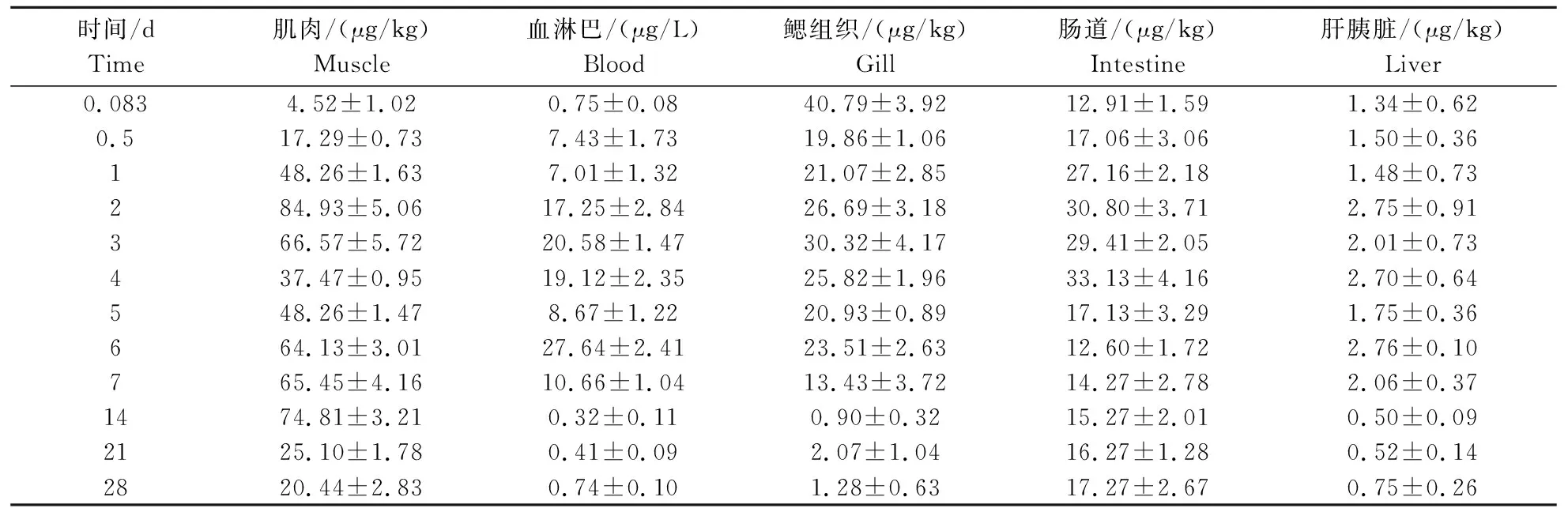
表4 吡虫啉在克氏原鳌虾中的残留消除情况 Table 4 Elimination of imidacloprid residues in Procambarus clarki
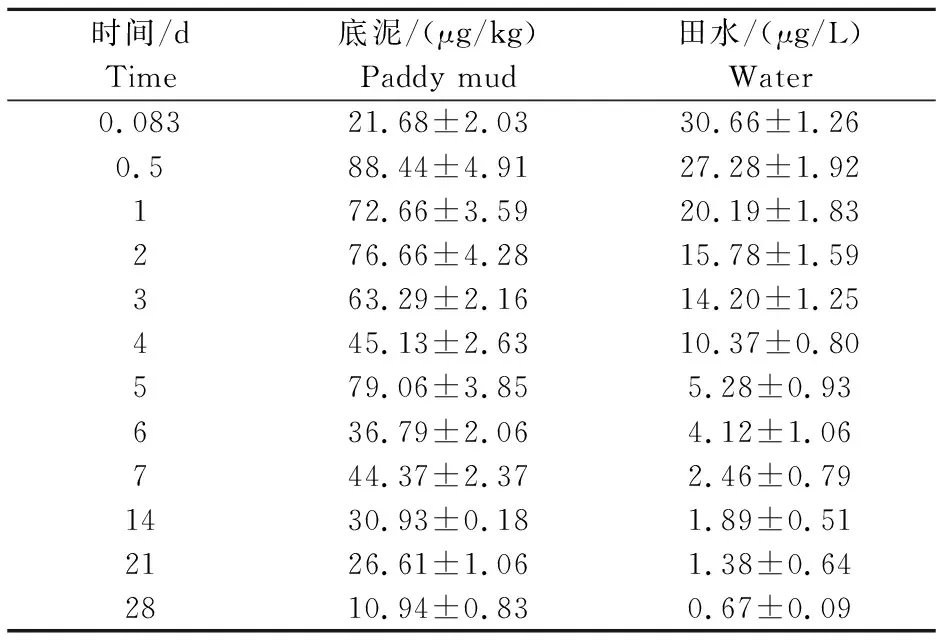
表5 吡虫啉在稻田底泥和水中的残留消除情况 Table 5 Elimination of imidacloprid residues in paddy mud and water
3 讨 论
室内暴露试验结果表明,克氏原鳌虾暴露在推荐使用浓度下,吡虫啉的浓度在水溶液中缓慢下降,而吡虫啉在克氏原鳌虾各组织的累积量表现为鳃组织>肌肉>血淋巴>肠道>肝胰脏,这与赵冬冬[14]的研究不同,其试验结果显示氯氰菊酯在鲫体内的生物富集系数为鳃>肝脏>肌肉,而有机磷农药毒死蜱在鱼、蟹组织器官中富集,富集量表现为肝脏>鳃>肌肉[15]。鱼类富集有机氯农药的主要途径之一是通过鳃膜从水中吸收[16],另一种是通过肠道摄食富集[17]。本试验证实了鳃富集途径,克氏原鳌虾的鳃组织直接暴露在水体,没有途径或方式对吡虫啉进行排泄和转化,而且密切接触农药,所以对吡虫啉的累积量最大。肝胰脏和肌肉组织表现出相似的累积趋势,是因为肝脏具有代谢功能,能够对体内外各种药物、毒物和体内某些代谢产物等非营养性物质进行生物转化。毒物经过生物转化和新陈代谢,可以转变为无毒或毒性较小易于排泄的物质排出体外。而肌肉里面含有一些种类的代谢相关酶,当吡虫啉刚刚进入肌肉组织时,就产生应激胁迫,会将吡虫啉分解为小分子物质或者低毒的其他代谢物。大量试验证明,当虾类暴露在毒液中一段时间后,对肝胰脏、鳃组织、肠道、肌肉等实质性器官都会产生毒性作用[18]。肝脏通常是受影响最大、最严重的器官;鳃则因其表面积大且与外界直接接触,易受到有毒物质的侵入和攻击,损伤的鳃组织会破坏离子调节功能,从而降低气体交换效率。所以,本试验通过室内暴露试验研究吡虫啉在克氏原鳌虾各组织的累积情况,为吡虫啉田间试验做了一定的铺垫。
而室外残留消除试验结果表明,吡虫啉在克氏原鳌虾中的累积量表现为肌肉>肠道>鳃组织>血淋巴>肝胰脏。吡虫啉在肌肉中的总累积量最大,这与室内的暴露试验结果有一定差异,一方面田间试验处于室外的大环境下,受天气温度影响比较大,另外一方面室外试验与室内试验的模拟环境不同,室外有水草底泥作为克氏原鳌虾的依附,室内试验克氏原螯虾完全暴露在吡虫啉毒液中。以推荐使用的质量浓度施洒吡虫啉后,第28天克氏原鳌虾中肌肉的残留量为20.44 μg/kg,低于美国规定吡虫啉在鱼类等水产品中的最大残留限量(0.05 mg/kg)[19]。日本规定吡虫啉在鸡、牛、猪等哺乳动物的最高残留限量为0.02~0.3 mg/kg,但是大量文献表明吡虫啉对哺乳动物低毒,而对水产品毒性较大[20-21]。所以,应当制定吡虫啉在水产品中更加严格的最高残留限量。本试验施药后,第28天在稻田水中吡虫啉降解率为97.54%,而郑岚等[11]的试验结果表明稻田水中的降解速度较快,施药后21 d,吡虫啉降解率为93.66%。施药28 d后,吡虫啉在底泥中的残留量为10.94 μg/kg。但是吴声敢等[22]的试验结果显示,10%吡虫啉可湿性粉剂在土壤中的半衰期高达5.6~15.3 d。虽然吡虫啉在田水和底泥中降解较快,但是在克氏原鳌虾组织中代谢较慢,尤其是在可食组织肌肉中。
稻虾综合种养模式是稻渔综合种养中的新兴模式。与传统的克氏原螯虾养殖模式相比,虾蟹套养效益不高、池塘精养模式高温季节起捕困难,而稻虾综合种养模式的成本投入很低,但养殖效益却与池塘精养模式不相上下[23]。但值得注意的是,稻虾综合种养也比较容易受到农药污染影响,一是稻田施药过程中对水体的污染,二是稻田施药后残留的农药污染。但是在现行的评估体系中,农药对水产品的危害评价并没有明确。
根据以上研究结果,为了避免对非靶标生物水产品-克氏原螯虾产生危害,建议适当延长吡虫啉在稻田中的施药间隔期,在靠近养殖水体的稻田尤其是在稻虾综合种养模式下应谨慎施药或建议使用其他替代药物。
