1株克氏原螯虾肺炎克雷伯菌的分离鉴定及药物敏感性分析
2021-02-02董靖张露珊刘绍春张国栋周顺杨秋红艾晓辉
董靖,张露珊,刘绍春,张国栋,周顺,杨秋红,艾晓辉
1.中国水产科学研究院长江水产研究所/湖北省水产品质量安全工程技术研究中心,武汉 430223;2.岳阳渔美康生物科技有限公司,岳阳 414100
克氏原螯虾(Procambarusclarkii)俗称小龙虾,原产于墨西哥东北部和中美洲南部地区,1929年经日本引进到中国,因其可以为人类提供丰富的优质蛋白、维生素B和矿物质等营养成分而成为风靡多个国家和地区的食品[1-2]。近年来随着国内小龙虾养殖规模的逐渐扩大,养殖的集约化程度也有所提升,但由于基础薄弱、优质种苗供应不足、病害多发和药物滥用等问题严重阻碍小龙虾产业的健康发展。尤其小龙虾养殖进入5月份后往往会大面积暴发疾病,造成小龙虾大量死亡,通常称为“五月瘟”[3]。其中,由强致病性的细菌、真菌、病毒和寄生虫等病原体导致的小龙虾各种感染性疾病尤为严重[4]。化学类抗菌药物是日常生产中用于防治小龙虾病害的主要手段,但极易导致环境中抗菌药物的污染和细菌耐药性的产生。此外,大量化学抗菌药物的使用容易造成药物在小龙虾体内的蓄积和残留,影响小龙虾产品的质量安全[5-6]。
肺炎克雷伯菌隶属于肠杆菌科克雷伯菌属,是一种常见的条件性致病菌,也是一种重要的人兽鱼共患病原菌,能导致鱼类、陆生动物和人的多种感染性疾病[7]。自1992年首次在海、淡水鱼水产品中检测到肺炎克雷伯菌后,肺炎克雷伯菌被发现能导致多种水产养殖动物的感染,如大鲵(Andriasdavidianus)、团头鲂(Megalobramaamblycephala)、中华鳖(Trionyxsinensis)等[8-10]。疫苗和化学抗菌药物是治疗肺炎克雷伯菌感染的主要手段,但目前尚无用于水产养殖源肺炎克雷伯菌感染的疫苗面世。因此,对水产养殖源肺炎克雷伯菌感染的治疗主要依赖化学抗菌药物[7,11]。而抗菌药物的广泛应用和滥用也不可避免地导致了肺炎克雷伯菌耐药菌株的产生。
2019年5月湖北省潜江市一小龙虾养殖场发生了小龙虾“五月瘟”,导致了大量的小龙虾死亡。笔者通过对患病小龙虾的病原学检查发现其存在肺炎克雷伯菌感染的情况,进一步通过回归感染试验确定了该分离菌株对小龙虾的致病力。此外,通过药敏试验和最小抑菌浓度测定等方法研究了该分离菌株的敏感性,旨在为小龙虾“五月瘟”病原分析和疾病防控提供参考和依据。
1 材料与方法
1.1 试验材料
患病小龙虾样品采集自湖北省潜江市某小龙虾养殖场;用于回归感染试验的健康小龙虾来自长江水产研究所荆州基地;抗生素标准品头孢拉定、氨曲南、氨苄西林、亚胺培南、头孢唑林、头孢吡肟、头孢噻肟、多粘菌素E、美罗培南、环丙沙星、阿莫西林、头孢他啶、氟苯尼考、四环素、苯唑西林、恩诺沙星、多西环素购自北京索莱宝科技有限公司;头孢唑肟、庆大霉素、阿奇霉素购自上海源叶生物科技有限公司;药敏纸片购自杭州微生物试剂有限公司;细菌基因组提取试剂盒、PCR Master Mix等分子生物学试剂购自TaKaRa公司;脑心浸液(BHI)培养基购自青岛海博生物有限公司。
1.2 细菌分离和纯化
取濒死小龙虾在无菌条件下用生理盐水反复冲洗体表3~5次,在超净工作台中剖取小龙虾的肝胰腺,用生理盐水冲洗后采用匀浆器将其研磨均匀。取研磨液在脑心浸液(BHI)固体培养基上划线,将平板置于30 ℃培养16~20 h。从平板中挑取单菌落反复划线纯化2~3次,将得到的纯化菌株置于4 ℃保存,标记为L20190516。
1.3 回归感染试验
从纯化好的平板无菌挑取L20190516菌株的单菌落接种至BHI液体培养基中,30 ℃振荡培养至对数生长中期。培养好的菌液用麦氏比浊管稀释成1.5×108、1.5×107、1.5×106、1.5×105、1.5×104cfu/mL的菌悬液。选取活力较好、无明显外伤的小龙虾作为试验动物,每组30尾,通过腹腔注射的方式在第2腹节和第3腹节之间注射菌液0.1 mL,阴性对照组注射0.1 mL无菌生理盐水。将注射后的虾暂养于玻璃缸内,保持水温23~25 ℃,溶氧在5.5~7.5 mg/L,期间正常换水但不投喂饲料。感染后每天观察并记录不同组别小龙虾的活动情况和死亡数,连续观察10 d。通过Bliss法计算其半数致死浓度 (LC50)[12]。取感染后濒死的小龙虾肝胰腺进行病原的分离和鉴定。
1.4 细菌生理生化鉴定
从纯化的平板上挑取L20190516菌株的单菌落进行革兰氏染色,在光学显微镜下观察细菌的形态特征。此外,将受试菌株的单菌落用无菌生理盐水重悬后加入到API20E生化鉴定试剂条上,按产品说明书操作,在28 ℃条件下培养24 h后将鉴定试剂条置于ATB 32GN细菌鉴定系统中进行生化鉴定。
1.5 细菌分子鉴定
参照细菌基因组提取试剂盒操作说明书提取菌株L20190516的全基因,以提取的全基因组作为模板,采用16S rRNA通用引物进行扩增[13]。用于鉴定的通用引物核苷酸序列:上游引物(16S rRNA-F):5′-AGAGTTTGATCATGGCTC-3′,下游引物(16S rRNA-R):5′-TACGGTTACCTTGTTACGACTT-3′, PCR产物的长度约为1 500 bp。PCR产物进行1%琼脂糖凝胶检测并测序。采用Blast软件对测序结果进行同源性比对。从Blast结果中选取与菌株L20190516同源性较高的相关已知序列,采用MEGA5.1软件进行多重序列比对分析,采用邻接法(Neighbor-Joining)构建系统发育树,校正模型为Kimura 2-parameter,通过Bootstraps法自举数集1 000次。
1.6 药物敏感性测试
L20190516菌株对常用抗菌药物的敏感性通过纸片扩散法(K-B)进行测定[14-15]。在超净工作台中无菌挑取L20190516单菌落至BHI液体培养基中,在30 ℃摇床中振荡培养至对数生长中期。培养好的菌液通过离心收集菌体并用无菌PBS重悬,通过麦氏比浊管将菌液浓度调整至1.5×108cfu/mL。将菌液充分混匀后涂布至MH琼脂培养基上,在30 ℃生化培养箱中继续培养18~24 h后用游标卡尺测定不同抗菌药物的抑菌圈直径。敏感性结果判定参照杭州微生物试剂有限公司提供的判定标准。
1.7 最小抑菌浓度测定
采用CLSI推荐的肉汤微量稀释法测定不同抗菌药物的最小抑菌浓度(minimum inhibitory concentrations,MICs)。在96孔板中将配好的抗菌药物进行倍比稀释,每孔内药物体积为100 μL,然后加入100 μL稀释好的菌悬液,使每孔中菌悬液的浓度为5×105cfu/mL。每种药物设置3次重复,不加药不加菌的孔设置为阴性对照,不加药加菌的孔设置为阳性对照。将加好的培养板放置于生化培养箱中,30 ℃条件下培养18~24 h。MICs定义为没有细菌生长的最小浓度。
2 结果与分析
2.1 分离株的培养特性
发病小龙虾活力降低,应激能力差,采食量下降,进地笼后死亡的现象较多,其中大虾死亡情况较为严重。剖检发现其肝胰腺发白,肠道内容物较少,肝胰腺积水。采取患病虾的肝胰腺进行细菌分离,得到的优势菌在平板上形成半透明、颜色灰白、中央隆起的光滑菌落。经革兰氏染色镜检发现该菌为短杆状革兰氏阴性菌。
2.2 分离株对小龙虾的毒力
健康小龙虾注射不同剂量的L20190516菌悬液后出现了一定程度的发病和死亡,高浓度攻毒组出现了急性死亡现象,在3 d内全部死亡,而阴性对照组在试验期间没有明显的发病和死亡(表1)。感染后的小龙虾表现为活动减缓、无力等症状,剖检发现其肝胰腺发白,有部分出现积水现象。采用Bliss法得到了该菌株对小龙虾的LC50为2.13×105cfu/mL。对出现典型症状及濒死小龙虾进行剖检、细菌分离得到了与L20190516菌株性状一致的菌落。
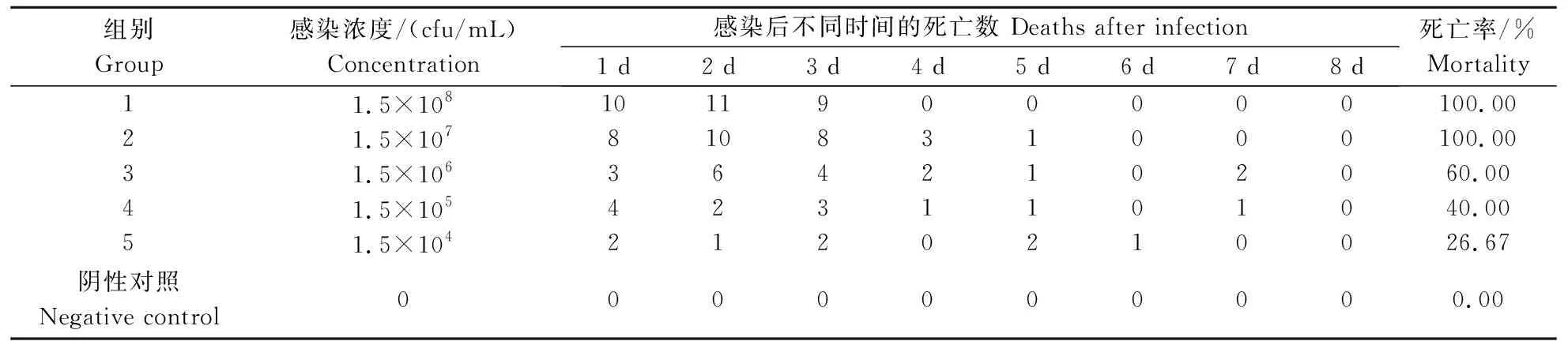
表1 分离株感染健康小龙虾后的死亡率 Table 1 Mortality of the isolate on healthy crayfish
2.3 生化鉴定结果
对分离纯化的优势菌接种于API20E生化鉴定条,经过孵育后置于ATB细菌自动鉴定系统中鉴定。结果发现该优势菌的生化特征符合肺炎克雷伯菌的特征,相似度大于98%。生化鉴定结果见表2。
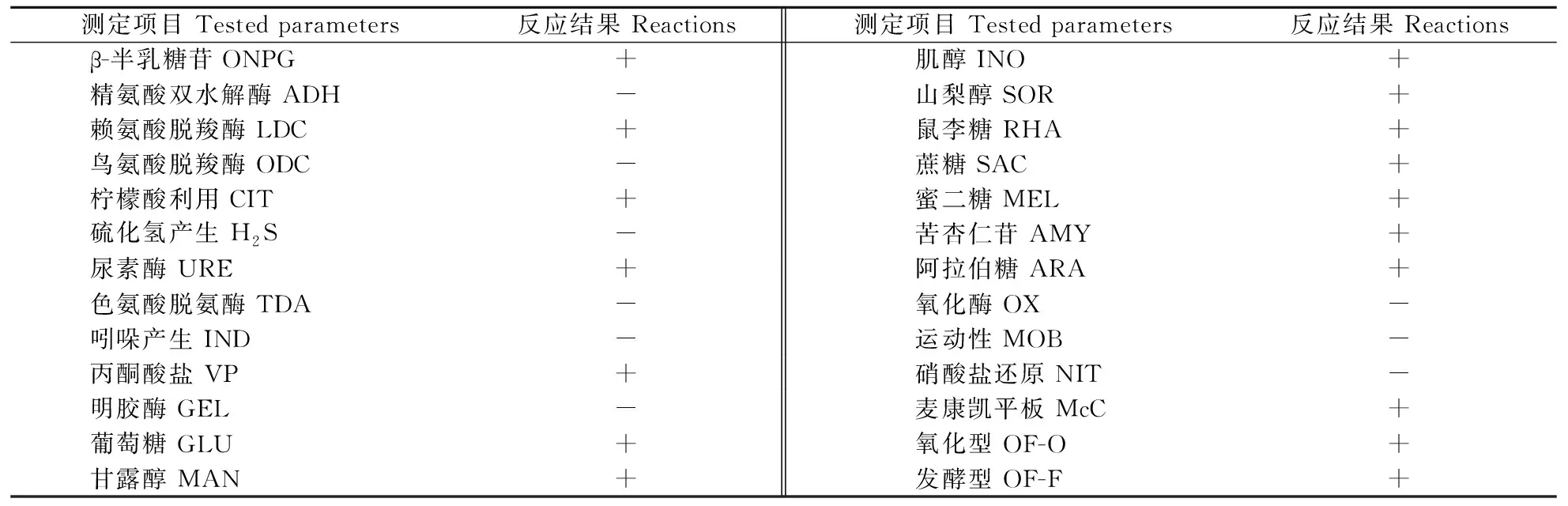
表2 分离株的生化鉴定结果 Table 2 Biochemical characterization of the isolate
2.4 16S rRNA序列分析
通过PCR扩增得到了分离株L20190516的16S rRNA片段,长度约为1 500 bp,PCR产物经纯化后直接测序。将得到的序列(MT409892)与GenBank数据库中的已知基因序列同源性比对,构建系统发育树。结果发现,分离株L20190516与肺炎克雷伯菌(KX237750.1、KU937377.1)、大肠杆菌(LR025099.1)、产气克雷伯菌(LR134254.1)聚为一支(图1),同源性为99%。结合该菌株的生理生化特征和系统发育树情况将该菌株判定为肺炎克雷伯菌。
2.5 药敏试验结果
通过K-B法测定20种化学抗菌药物的敏感性,其结果见表3。该菌株对头孢噻肟、多粘菌素B敏感,对新霉素、亚胺培南中度敏感,对恩诺沙星、多西环素、氟苯尼考等16种药物耐药。通过肉汤微量稀释法测定20种药物的最小抑菌浓度,结果如表4所示。
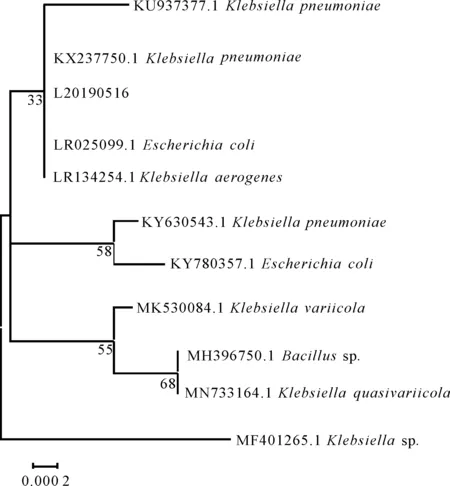
图1 L20190516菌株的系统发育树
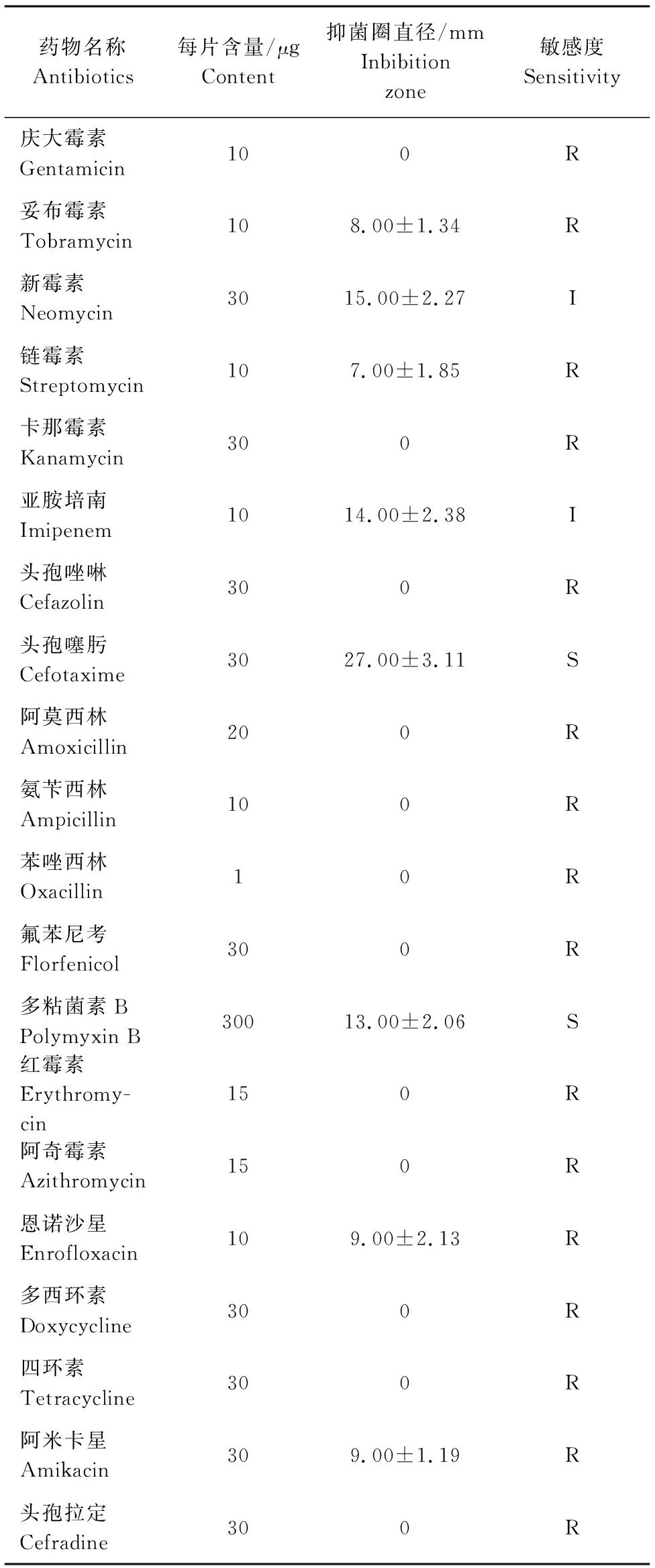
表3 L20190516分离株对20种抗菌药物敏感性 Table 3 Antibiotic susceptibility of L20190516strain to 20 kinds of antibiotics
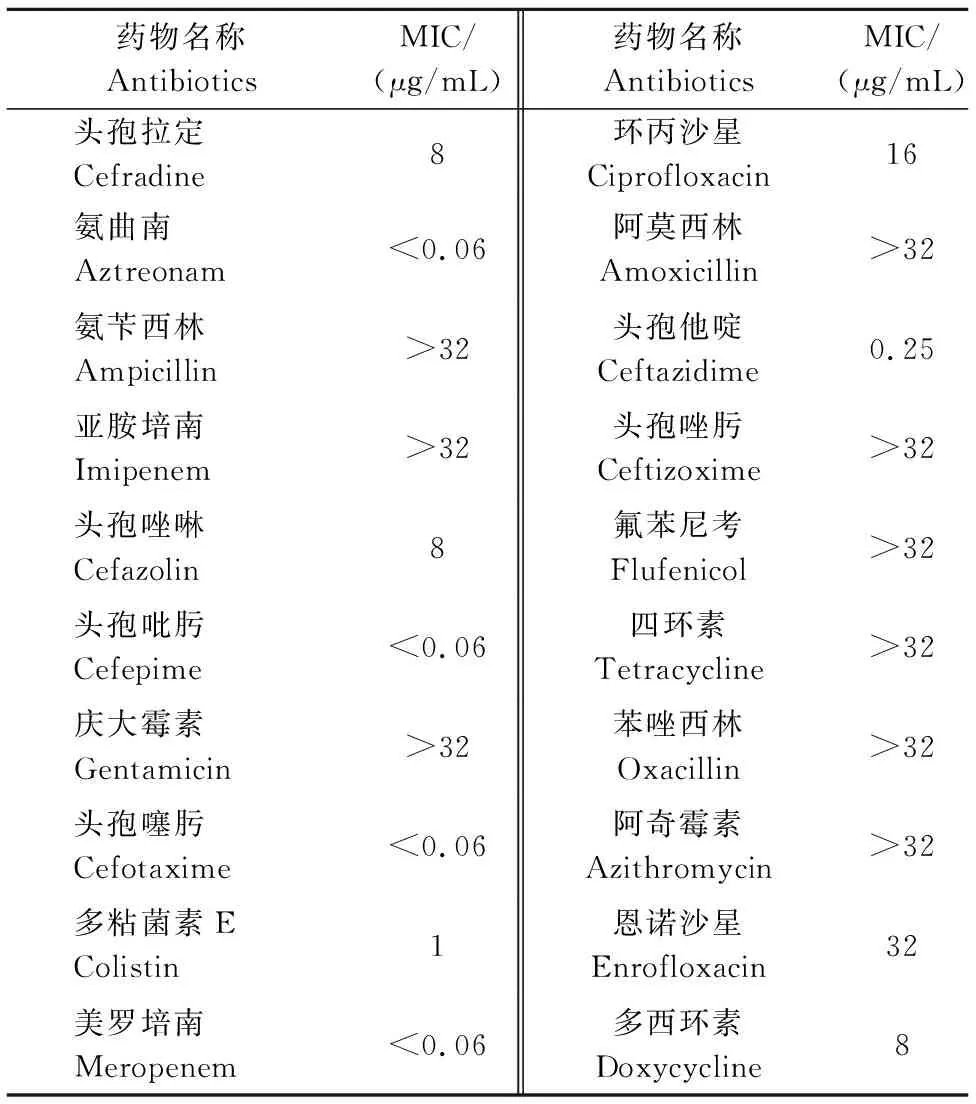
表4 抗菌药物对L20190516分离株的MICs Table 4 The MICs of antibiotics to L20190516
3 讨 论
近年来,随着水产养殖业的迅猛发展,有关水产养殖来源的致病菌的报道越来越多,病害频发对水产养殖业的发展造成了一定的影响。随着小龙虾消费市场的打开,人们养殖小龙虾的热情高涨,养殖规模不断扩大,随着养殖规模和面积的不断增加,小龙虾病害也越来越多,给小龙虾养殖造成了惨重的损失[16]。小龙虾的细菌性病害主要由柠檬酸杆菌属、气单胞菌属、假单胞菌属、弧菌属等引起[16-19]。本试验首次从湖北潜江发病小龙虾中分离到1株优势菌,经过回归感染试验发现该菌株对健康小龙虾致病,在感染小龙虾体内再次分离到该菌株,而阴性对照组未分离到;进一步通过生理生化鉴定、16S rRNA鉴定和系统发育树构建将该菌株鉴定为肺炎克雷伯菌。此外,本试验通过ELISA法(酶免生物)和镜检法分别排除了患病小龙虾感染白斑综合征病毒和寄生虫的可能。回归感染试验前将小龙虾暂养10 d后再选取健康个体入组,试验时设置了注射无菌生理盐水的阴性对照组且在试验过程中阴性对照组未发生死亡,表明各试验组小龙虾的死亡均由感染肺炎克雷伯菌引起,而非未检测到的未知病原体。
谭爱萍等[11]、卢玉婷等[20]、滕涛等[9]分别从鳗鲡、鲤、团头鲂体内分离到肺炎克雷伯菌,发现该菌主要引起养殖鱼类的腹水、内脏器官充血肿胀等症状,认为肝脏(肝胰腺)可能是肺炎克雷伯菌主要侵害的靶器官。本试验发现肺炎克雷伯菌能导致小龙虾肝胰腺发白、采食量下降和肠道内容物减少等主要症状,该菌感染主要发生于5月中旬水温在25 ℃左右时。综合以上信息可以推断肺炎克雷伯菌是小龙虾“五月瘟”的病原体之一。
自2001年首次发现了对碳青霉烯类抗菌药物耐药的肺炎克雷伯菌后,产KPC酶及耐碳青霉烯类抗菌药物的肺炎克雷伯菌不断被发现,导致临床中对肺炎克雷伯菌的治疗越来越难[21]。滕涛等[9]研究了团头鲂源肺炎克雷伯菌对27种抗菌药物的敏感性,发现仅对磷霉素、复方新诺明和氨曲南3种药物敏感。谭爱萍等[11]发现鳗源肺炎克雷伯菌仅对亚胺培南、链霉素和阿米卡星3种药物敏感,对其余17种受试药物均耐药。童桂香等[22]分析了山瑞鳖(Paleasteindachneri)肺炎克雷伯菌的耐药性,发现该菌对受试的30种药物中的头孢西叮、舒普深(头孢哌酮、舒巴坦)和阿米卡星敏感,对特治星(哌拉西林、他唑巴坦)中度敏感,对其余26种药物耐药。从以上研究可以推断出水产源肺炎克雷伯菌耐药性较为严重,且大部分分离菌株具有多重耐药性。本试验所分离的肺炎克雷伯菌仅对受试的20种抗菌药物中的头孢噻肟和多粘菌素B敏感,该结果提示本次分离的菌株为多重耐药肺炎克雷伯菌。
