钾离子通道蛋白Shaker对果蝇心脏衰老的保护作用
2021-02-02刘学文吴红梅白瑛曾群曹泽民吴秀山唐旻
刘学文,吴红梅,白瑛,曾群,曹泽民,吴秀山,唐旻
钾离子通道蛋白Shaker对果蝇心脏衰老的保护作用
刘学文1,吴红梅1,白瑛1,曾群1,曹泽民1,吴秀山2,唐旻1
1. 南华大学衡阳医学院生物化学与分子生物学教研室,衡阳 421001 2. 湖南师范大学心脏发育研究中心, 发育生物学与蛋白质组学教育部重点实验室,长沙 410081
钾离子通道在心肌细胞动作电位复极过程中起着重要作用。钾离子通道蛋白种类繁多,已知钾离子通道蛋白KCNQ和HERG/eag参与心脏动作电位的形成,调节心脏收缩节律。钾离子通道蛋白Shaker是果蝇()体内发现的第一个电压门控钾离子通道,维持神经元和肌肉细胞的电兴奋性,但是目前其在成人心脏功能中的作用仍不清楚。本研究以果蝇为模型,高频电刺激模拟心脏应激状态,观察钾离子通道蛋白基因突变体的心衰发生率。同时,利用心脏特异性启动子Gal4特异性敲低钾离子通道蛋白Shaker的表达;果蝇成体心脏生理学功能分析系统分析了1、3、5周龄特异性敲低钾离子通道蛋白Shaker的心脏表型。结果表明,基因突变将严重影响果蝇心脏抗应激能力,表现在高频电刺激后的心力衰竭发生率显著性升高;心脏特异性敲低基因导致5周龄果蝇心律失常发生率显著性增加;心脏特异性敲低将显著降低果蝇寿命。综上所述,本研究推测钾离子通道蛋白Shaker在衰老过程中维护果蝇正常的心脏功能。
钾离子通道;心律失常;Shaker;心脏衰老;果蝇
心律失常是一种常见的心脏疾病,其患病率和死亡率随着年龄的增长而显著增加[1]。年龄相关性心律失常的发病机制一直是研究的热点。心脏结构和离子通道的重构是老年性心律失常发生的主要病理基础,但其发生的分子机制仍不清楚。
钾离子通道在心脏动作电位复极中起着重要作用[2~5]。钾离子通道家族作为心脏离子通道中种类最多的家族,由结构相似但功能不同的亚型组成,每一种钾离子通道都具有特定的动力学和电压依赖性[3]。在果蝇()和脊椎动物中,/和钾离子通道基因突变会导致心脏复极能力减弱和心脏动作电位延长,从而增加心律失常的发生率;且其基因表达水平在衰老心脏中也显著减少,这可能是年龄依赖性心脏功能障碍的重要标志之一[6~9]。钾离子通道蛋白Shaker是果蝇体内发现的第一个电压门控钾离子通道,维持神经元和肌肉细胞的电兴奋性[10,11],但其在衰老心脏中的作用仍不清楚。因此,本研究利用果蝇作为模型,研究钾离子通道蛋白Shaker在年龄依赖性心率失常发生发展中的功能。
1 材料与方法
1.1 果蝇品系
野生型果蝇w、突变体果蝇shaker、突变体果蝇KCNQ和基因缺失系均来自于Bloomington果蝇品系中心。的RNAi品系(v23673)来自于维也纳果蝇RNAi中心(VDRC)。心脏特异性表达的Gal4果蝇品系由美国Sanford Burnham医学研究所Rolf Bodmer实验室提供,Gal4与RNAi品系中的UAS序列结合启动下游RNA干扰序列的表达,在心脏中特异性敲低基因的表达。
1.2 电刺激实验
利用高频电刺激实验模拟人类心脏的应激状态,构建果蝇心衰模型,具体方法请参考文献[12,13]。利用脉冲电激仪循环交流电(6 Hz、40 V)刺激30 s,电刺激停止后的2 min内评估心脏功能,存在如下3种情况:(1)正常:心脏恢复正常而有节律的收缩跳动;(2)心脏纤颤:心脏表现为剧烈的收缩、回旋或者缓慢的蠕动等不正常行为;(3)心脏停搏:心脏停止跳动。心衰率是指果蝇发生心脏纤颤或心脏停搏的百分比。每个基因型检测150只以上,卡方检验进行统计学分析。
1.3 果蝇成体心脏功能分析
在模拟果蝇生理缓冲液(108 mmol/L NaCl、5 mmol/L KCl、2 mmol/L CaCl2、8 mmol/L MgCl2、15 mmol/L HEPES、1 mmol/L NaH2PO4、4 mmol/L NaHCO3、10 mmol/L Sucrose、5 mmol/L Trehalose,pH 7.1)中解剖果蝇,剪去果蝇的大脑和胸部的腹神经节,排除神经对果蝇心跳的影响。暴露于模拟生理缓冲液中的心脏仍可以处于有节律的跳动,方法详见文献[14]。1周龄、3周龄和5周龄果蝇相当于人类的青年、中年和老年[15]。用高速EM-CCD摄像机(Hamamatsu C9300,日本)以130帧/秒的速度拍摄1周龄、3周龄和5周龄的果蝇心跳30 s,利用果蝇成体心脏功能分析软件分析获得M-mode心跳图谱,并测得心跳周期、收缩期和舒张期、收缩直径和舒张直径、缩短分数,以及心律失常指数等参数。心率失常指数是指果蝇心脏每个心跳周期与整个心跳周期中值的差异大小,代表果蝇不规律心跳的程度[7,14,16]。
1.4 生存曲线分析
果蝇在25℃环境下培养,每管不超过25只。每隔3 d换一次果蝇食物管,并记录每管果蝇中的死亡数。根据每个时间点上果蝇死亡的数量,绘制生存曲线,分析果蝇的平均寿命。每个杂交组收集大约250只F1子代果蝇,并进行3次重复实验,以确保实验的可重复性。利用Graphpad Prism 8.0软件对数据进行Mantel-Cox统计学分析,结果呈现的是1次重复实验结果。
2 结果与分析
2.1 shaker突变体心脏抗应激能力下降
老龄心脏在静息时表现功能正常,但由于生理储备下降在应激状态下表现为心衰。为了模拟人类心脏在应激状态下的生理表现,本研究利用脉冲电激仪对果蝇心脏进行高频电刺激30 s[12,15]。野生型w果蝇心脏出现心脏纤颤或心脏停搏的比例相对较低,心衰率为24%;钾离子通道蛋白纯和突变体KCNQ果蝇的心衰率为75% (图1),与Ocorr等[7]研究数据相近。shaker突变破坏了钾离子通道S5-S6跨膜区域,钾离子不能通过[17]。电刺激实验显示,缺失系的杂合体(Df/+)和纯合突变体(shakerhomo)的心衰率分别为50%和56% (图1),具有显著性差异,表明Shaker钾离子通道功能的丧失或降低使电刺激诱发心衰的易感性显著增加,标志着心脏抗应激能力的下降。
2.2 钾离子通道蛋白Shaker维护老龄果蝇心脏的生理功能
为了进一步阐明钾离子通道蛋白Shaker在调节老龄心脏的生理学功能,本研究利用心脏特异性驱动子Gal4品系与基因的RNAi品系杂交,获得F1代,在心脏中特异性敲低(KD)。利用高速EM-CCD摄像机拍摄果蝇心跳,获得M-mode心跳图,显示果蝇心脏壁随着心脏收缩和舒张的运动轨迹。与对照组相比,5周龄心脏特异性KD果蝇的收缩期和舒张期延长,出现纤维性震颤(图2)。

图1 Shaker钾离子通道功能的丧失或降低增加电刺激诱发的心衰发生率
样本量分别标记在柱形图内,****:<0.0001。

图2 心脏特异性敲低shaker基因的果蝇M-mode心跳图
M-mode图揭示了对照组(control,/+)和心脏特异性敲低shaker组(KD,4.2>shaker RNAi) 5周龄果蝇心脏壁在10 s内的运动轨迹。绿色代表舒张期,红色线条代表收缩期,蓝色线条代表心跳周期。
基于M-mode心跳图谱分析测得心跳周期、收缩期和舒张期、收缩直径和舒张直径、缩短分数,以及心律失常指数等参数。结果发现,与对照组相比,1周龄和3周龄心脏特异性KD果蝇心脏收缩期、舒张期以及心率不齐指数没有明显的异常;5周龄心脏特异性KD果蝇心脏虽然代表收缩功能的缩短分数没有显著差异(图3G),但是心跳周期明显延长,包括收缩期和舒张期的延长,心律失常指数明显增加(图3:A~D),表明钾离子通道蛋白Shaker参与了老龄而非低龄果蝇心脏功能的维持。
正常果蝇的收缩期在0.15~0.25 s之间,舒张期在0.3~0.5 s之间。鉴于5周龄心脏特异性r KD果蝇出现了心脏纤颤和心脏短暂停搏,本研究记录了收缩期大于0.4 s和舒张期大于1 s的心跳为异常长收缩期(long systolic interval)和异常长舒张期(long diastolic interval)[18,19]。与对照组相比,心脏特异性KD果蝇心脏从3周龄开始出现长时间的收缩或者舒张的发生率增加,并且随着年龄的增长,这种异常的表型会进一步加重(图3:E~F)。为了排除个别果蝇出现异常表型引起的实验误差,本研究对出现长收缩期的果蝇或者长舒张期的果蝇数量进行了统计,结果也显示出了相似的趋势(图3:H~I)。综上所述,钾离子通道蛋白Shaker在维持老龄果蝇心脏功能中具有非常重要作用。
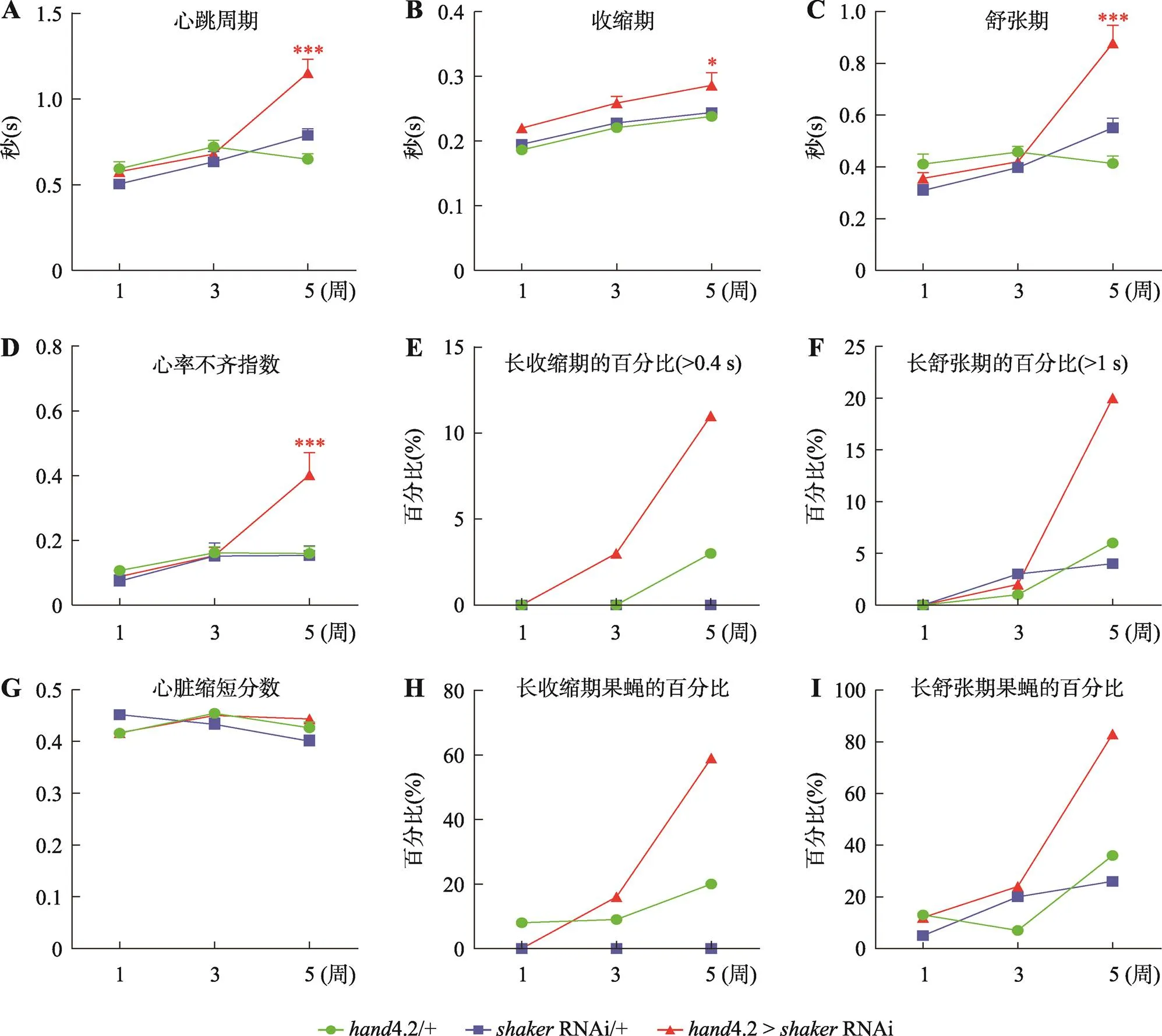
图3 心脏特异性敲低shaker基因导致年龄依赖性心衰
A~D、G:1周龄、3周龄和5周龄果蝇心脏特异性KD (4.2>RNAi)和对照组果蝇(4.2/+和RNAi/+)的心脏生理功能参数,包括心跳周期、收缩期、舒张期、心律不齐指数和缩短分数。E, F:异常长收缩期(收缩期大于0.4 s)或者异常长舒张期(舒张期大于1 s)的百分比。H、I:含有长收缩期或者长舒张期的果蝇数量百分比所有数据均采用单因素方差分析。*:<0.5;***:<0.01。每个样本量为20~30个果蝇,error bar为SEM。
2.3 心脏特异性敲低shaker基因影响果蝇寿命
鉴于钾离子通道蛋白Shaker在维持衰老心脏功能方面的显著作用,本研究检测了心脏特异性KD对果蝇寿命的影响。与对照组果蝇(51 d)相比,心脏特异性KD果蝇的中位生存期(42 d)显著降低(图4),中位生存期缩短了17.6%,具有统计学显著意义,表明心脏特异性敲低钾离子通道蛋白Shaker缩短果蝇寿命,而心脏功能的衰退可能是决定寿命的重要因素。
3 讨论
随着人类寿命的不断增加,对年龄相关性心脏功能障碍的研究越来越被关注。然而,对脊椎动物心脏衰老的研究存在着一些局限性。首先,在哺乳动物中与心衰发生相关的基因突变通常具有致死性;其次,哺乳动物寿命相对较长,不利于研究年龄相关性疾病的发病机制。果蝇是唯一具有心脏的无脊椎动物模型,其氧气供给不受心脏功能影响,心脏特异性敲低心衰发生相关基因的表达可能不致死;果蝇的生命周期短暂,有利于年龄相关性疾病的研究[18,20]。此外,果蝇具有与人类相似的心脏功能障碍,如扩张型心肌病、心律失常等;与人类心律失常相关的基因在果蝇中具有同样的功能。因此,果蝇是研究心衰的理想模型[18]。

图4 心脏特异性敲低shaker基因会影响果蝇生存
X轴为成体果蝇的存活时间(d),Y轴为存活果蝇的百分数。黑线和红线分别代表对照组(4.2/+)和KD (4.2 >RNAi)的生存曲线。样本量为250只果蝇,Mandel-Cox对数秩检验,****:<0.0001。
钾离子通道负责心脏动作电位的复极相,从而保证心脏节律性收缩;钾离子通道功能丧失,如和/,会导致果蝇或人类的年龄依赖性心律失常[7~9]。突变体果蝇在1周龄时已经出现明显的心率失常,并且呈现年龄依赖性恶化。而心脏特异性KD果蝇在1周龄和3周龄时表现正常,只有在5周龄时才表现出异常的生理功能,表明钾离子通道蛋白Shaker对低龄果蝇心脏功能不是必须的,但是参与了老龄果蝇心脏功能的维持。5周龄KD果蝇心脏的收缩力没有受损,表明KD不影响心脏结构的重塑。
心脏衰老的特征之一是心脏抗应激能力下降。本研究利用电刺激实验,发现突变体对应激刺激诱发心衰的易感性较高,类似于人类心脏衰老。同时,心脏特异性KD会显著提高老龄果蝇心律失常的发生率。我们推测心律失常发生率的增加和抗应激刺激能力的降低很可能是由于老龄果蝇心脏中基因表达下调,心肌电位复极异常引起的。钾离子通道蛋白Shaker的研究可能为年龄依赖性心衰的治疗提供新的靶标。
致谢
感谢美国Sanford Burnham医学研究所Rolf Bodmer教授和湖南师范大学吴秀山教授提供果蝇成体心脏功能分析平台和心脏特异性驱动子4.2 Gal4;感谢瑞典斯德哥尔摩大学Mattias Mannervik教授对本论文的指导。
[1] Curtis AB, Karki R, Hattoum A, Sharma UC. Arrhythmias in patients ≥80 years of age: pathophysiology, management, and outcomes., 2018, 71(18): 2041–2057.
[2] Jeevaratnam K, Chadda KR, Huang CLH, Camm AJ. Cardiac potassium channels: physiological insights for targeted therapy., 2018, 23(2): 119–129.
[3] Schmitt N, Grunnet M, Olesen SP. Cardiac potassium channel subtypes: new roles in repolarization and arrhythmia., 2014, 94(2): 609–653.
[4] Giudicessi JR, Ackerman MJ. Potassium-channel mutations and cardiac arrhythmias--diagnosis and therapy., 2012, 9(6): 319–332.
[5] Tomson TT, Arora R. Modulation of cardiac potassium current by neural tone and ischemia., 2016, 8(2): 349–360.
[6] Grunnet M, Behr ER, Calloe K, Hofman-Bang J, Till J, Christiansen M, McKenna WJ, Olesen SP, Schmitt N. Functional assessment of compound mutations in the KCNQ1 and KCNH2 genes associated with long QT syndrome., 2005, 2(11): 1238–1249.
[7] Ocorr K, Reeves NL, Wessells RJ, Fink M, Chen HSV, Akasaka T, Yasuda S, Metzger JM, Giles W, Posakony JW, Bodmer R. KCNQ potassium channel mutations cause cardiac arrhythmias inthat mimic the effects of aging., 2007, 104(10): 3943– 3948.
[8] Sanguinetti MC, Tristani-Firouzi M. hERG potassium channels and cardiac arrhythmia., 2006, 440(7083): 463–469.
[9] Ocorr K, Zambon A, Nudell Y, Pineda S, Diop S, Tang M, Akasaka T, Taylor E. Age-dependent electrical and morphological remodeling of theheart caused by hERG/seizure mutations., 2017, 13(5): e1006786.
[10] Rivlin PK, St Clair RM, Vilinsky I, Deitcher DL. Morphology and molecular organization of the adult neuromuscular junction of., 2004, 468(4): 596–613.
[11] Ruiz-Cañada C, Koh YH, Budnik V, Tejedor FJ. DLG differentially localizes Shaker K+-channels in the central nervous system and retina of., 2002, 82(6): 1490–1501.
[12] Wessells RJ, Bodmer R. Screening assays for heart function mutants in, 2004, 37(1): 58–60.
[13] Zhang YY, Tang M, Xia Q, Li RL, Deng ZW, Peng XW, Yuan WZ, Wu XS. Thepacing model for screening the 2nd chromsome deficiency lines related to heart failure., 2010, 14(3):4. 张艳阳, 唐旻, 夏琼, 李冉林, 邓志伟, 彭向文, 袁婺洲, 吴秀山. 利用果蝇心力衰竭模型筛选果蝇第2号染色体缺失系. 生命科学研究, 2010, 14(3): 4.
[14] Fink M, Callol-Massot C, Chu A, Ruiz-Lozano P, Izpisua Belmonte JC, Giles W, Bodmer R, Ocorr K. A new method for detection and quantification of heartbeat parameters in, zebrafish, and embryonic mouse hearts., 2009, 46(2): 101–113.
[15] Wessells RJ, Fitzgerald E, Cypser JR, Tatar M, Bodmer R. Insulin regulation of heart function in aging fruit flies., 2004, 36(12): 1275–1281.
[16] Ocorr K, Fink M, Cammarato A, Bernstein S, Bodmer R. Semi-automated optical heartbeat analysis of small hearts., 2009, 31(31): e1435.
[17] Lichtinghagen R, Stocker M, Wittka R, Boheim G, Stühmer W, Ferrus A, Pongs O. Molecular basis of altered excitability in Shaker mutants ofmelanogaster., 1990, 9(13): 4399–4407.
[18] Nishimura M, Ocorr K, Bodmer R, Cartry J.as a model to study cardiac aging., 2011, 46(5): 326–330.
[19] Horn MA. Cardiac physiology of aging: extracellular considerations., 2015, 5(3): 1069–1121.
[20] Hughes CJR, Jacobs JR. Dissecting the role of the extracellular matrix in heart disease: lessons from thegenetic model., 2017, 4(2): 24.
Potassium channel Shaker play a protective role against cardiac aging in
Xuewen Liu1, Hongmei Wu1, Ying Bai1, Qun Zeng1, Zemin Cao1, Xiushan Wu2, Min Tang1
Potassium channels, which are the most diverse group of the ion channel family, play an important role in the repolarization of cardiomyocytes. Recent studies showed that potassium channels, such as KCNQ and HERG/eag, play an important role in regulating adult heart function through shaping the action potential and maintaining the rhythm of cardiac contraction. The potassium channel protein Shaker is the first voltage-gated potassium channel found into maintain the electrical excitability of neurons and muscle cells, but its role in adult cardiac function is still unclear. In this study,was used as a model to study the role of Shakerchannel in the maintenance of cardiac function under stress and aging. The incidence of heart failure was observed in smutant after external electrical pacing, which simulates cardiac stress. Additionally, The cardiac-specific driverGal4 was used to specifically knock down the expression of the potassium channelin. The cardiac parameter was analyzed at 1, 3, 5 weeks of age on cardiac specific knockdown of susingadult cardiac physiological assay. The results showed that the mutation ofgene seriously affect the cardiac function under stress, demonstrated by significant increase in heart failure rate under electrical stimulation. In addition, cardiac specific knockdown ofincreased the incidence of arrhythmias inat the age of 5 weeks. Cardiac-specific knockdown ofreduces life span. Therefore, the results of this study suggest a vital role of the potassium channelin maintaining normal cardiac function during aging.
potassium channel; arrhythmias;; cardiac aging;
2020-08-11;
2020-12-14
国家自然科学基金项目(编号:81500311,81711530050)和湖南省科技厅课题(编号:2015JC3080)资助[Supported by the National Natural Science Foundation of China (Nos.81500311,81711530050),and Key Program of Hunan Provincial Department of Science and Technology (No.2015JC3080)]
刘学文,在读硕士研究生,专业方向:果蝇心衰的表观遗传调控。E-mail: 1547962520@qq.com
唐旻,博士,副教授,硕士生导师,研究方向:果蝇心衰的分子机制研究。E-mail: mtang2014@163.com
10.16288/j.yczz.20-253
2020/12/31 11:23:00
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20201231.0954.001.html
(责任编委: 韩俊海)
