PD-L1表达与胰腺癌发生发展的相关性meta分析
2021-02-01周旭林严永敏夏秋燕
周旭林 严永敏 夏秋燕 徐 岷
胰腺导管腺癌(PDAC)是高死亡率的恶性肿瘤之一,手术后复发率高、进展迅速、以及治疗效果欠佳等原因[1],导致胰腺导管癌患者预后极差。肿瘤免疫治疗作为新型治疗手段已成为研究热点之一。程序死亡性因子1(PD-1)/ PD-1 配体(PD-L1)免疫疗法是通过阻断PD-1/ PD-L1 信号通路使癌细胞死亡[2]。但是关于PD-L1在胰腺导管癌中的表达及其预后的相关性的临床与基础研究尚有限,并且存在部分的争论。Birnbaum等[3]学者研究发现,PD-L1高表达与胰腺导管癌患者的总生存期有着密切关系,系独立不良预后因素;而Li[4]却认为PD-L1高表达是胰腺癌患者预后的良好指标。因此,本研究采用Meta分析方法,对既往研究综合分析处理,探讨PD-L1表达与胰腺癌发生发展的相关性。
1 资料与方法
1.1 文献检索
2名作者分别独立对Medline/PubMed、Embase、EBSCO、The Cochrane Library、Springerlink、Web of Science、Wiley OnlineLibary以及中国知网、万方数据资源等数据库和Cochrane临床对照试验中心注册数据库(CENTRAL)进行文献检索,搜集国内外公开发表的关于PD-L1与胰腺导管癌的中英文文献。文献检索的截止时间至2019年4月1日止。英文的检索单词包括:pancreatic cancer,antigens,CD274;B7-H1,PD-L1;programmed cell death-ligand 1;中文的检索单词包括:胰腺导管癌、胰腺癌、程序死亡性因子配体1、B7-H1、PD-L1/PD-1。
1.2 文献选入标准
文献中所研究病例的临床病理资料均完整,并且经病理学检查确诊为胰腺导管腺癌;应用聚合酶链式反应(PCR)或免疫组织化学染色法(IHC)检测法检测胰腺癌组织中PD-L1的表达;文献需要提供足够的资料用以估算风险比(HR);文献中需要提供PD-L1表达与胰腺癌患者总生存期(OS)之间的研究资料;文献中包含PD-L1表达与临床病理特征的研究资料,如年龄、性别、肿瘤浸润程度、淋巴结转移、组织分化程度、临床分期(T分期)、糖尿病史、吸烟史等。
1.3 排除标准
非中、英文文献;重复的临床研究;个案报道、文献回顾、期刊社论及综述性文献;学位论文等灰色文献;动物实验研究;检测样本为血液、腔膜液标本的研究;PD-L1阳性判断标准不清的研究文献;应用纽卡斯尔-渥太华(newcastle-ottawa scale,NOS)队列分析量表评分,小于5分等无法利用的文献。
1.4 文献筛选、数据提取和质量评价
2名作者根据纳入与排除标准,对研究文献进行独立筛选、提取研究资料并评价质量;如遇有分歧则通过讨论解决,或与第3名研究者商议解决。对于文献中缺乏的资料,尽可能与原作者通过电子邮件方式联系加以补充。文献中提取的信息包括:一般信息(文献题目、第一作者、发表年份等)、病例来源、样本数量、PD-L1的阳性表达及其检测方法、患者的临床病理特征、总生存期、估计风险比(HR)、以及95%置信区间(CI)等信息。如果研究文献中没有直接给出风险比(HR),则需要用Engauge Digitizer Version4.1软件从生存曲线中提取计算。
研究文献采用对照研究偏倚风险评估量表(newcastle-ottawa scale,NOS) 对纳入研究进行质量评估。NOS量表主要从以下3方面进行评价:队列研究的选择、可比性和结果测量;8项评价标准全部满足给予9分的最高分,得分小于5分则视为质量较差[5]。
1.5 统计学方法
应用Review Manager 5.3软件进行Meta分析。合并汇总研究文献中的HR以及95%CI来评估PD-L1与胰腺癌患者总生存期之间的关系。若研究文献中没有给出明确的HR,依据Parmar等[6]和周支瑞等[7]报道的方法,从研究文献给出的K-M生存曲线中提取资料计算估出。关于PD-L1表达与胰腺癌患者临床病理特征之间关系的评价,采用合并值及其95%置信区间(CI)描述关联强度。采用I2检验进行meta研究结果的异质性检验。若I2≤50%,说明各研究结果间存在的异质性较弱,应采用固定效应模型进行meta分析;若I2>50%,说明各研究结果间具有较强异质性,则采用随机效应模型进行meta分析,减少异质性对研究结果的影响;若异质性过大,需行描述性分析。以P<0.05为差异有统计学意义。所有的P值和95%CI均是双侧检验结果。纳入文献数≥9个的文献采用漏斗图评估其发表偏倚,漏斗图对称则表示发表偏倚可能性较小。
2 结果
2.1 研究文献收集情况及质量评价
根据筛选和排除标准,首先检索出相关研究文献507篇,再经逐级选排后,最终纳入16篇文献[3-4,8-21],共计2085例病例,其中来自法国、美国、德国、英国的研究文献各1项,来自日本的研究文献4项,来自中国的研究文献共计8项。纳入研究文献的基本临床特征和方法学质量评价(表1)。根据NOS评估量表对16项研究文献进行质量评价,研究文献的质量评分为6~9分,研究的质量相对较高。
2.2 meta分析结果
2.2.1 总生存期 16篇研究文献中有15篇(共2045例患者)报道了胰腺导管腺癌患者的生存曲线或风险比,对其进行meta分析后发现,PD-L1的表达与PDAC患者的不良预后有显著相关性(HR=1.61,95%CI:1.37~1.89,P<0.00001),死亡风险增加61%,见图1。
2.2.2 PD-L1表达与胰腺癌临床病理特征的关系 PDAC患者胰腺癌肿瘤组织中PD-L1的阳性表达与肿瘤浸润程度(RD=0.12,95%CI:0.01~0.23,P=0.04)、肿瘤组织分化程度(OR=2.07,95%CI:1.45~2.95,P<0.001)、神经侵润(OR=3.29,95%CI:1.90~5.69,P<0.001)、淋巴转移(OR=1.44,95%CI=1.09~1.90,P=0.01)、吸烟(OR=2.94,95%CI:1.42~6.09,P=0.004)有关;与患者性别(OR=0.97,95%CI:0.75~1.25,P=0.81)、肿瘤部位(OR=1.63,95%CI:0.99~2.70,P=0.06)、肿瘤远处转移(OR=1.06,95%CI:0.66~1.69,P=0.82)、是否并发糖尿病(OR=1.34,95%CI:0.59~3.03,P=0.48)均无关,见表2。

表1 研究文献的基本临床特征和质量评分
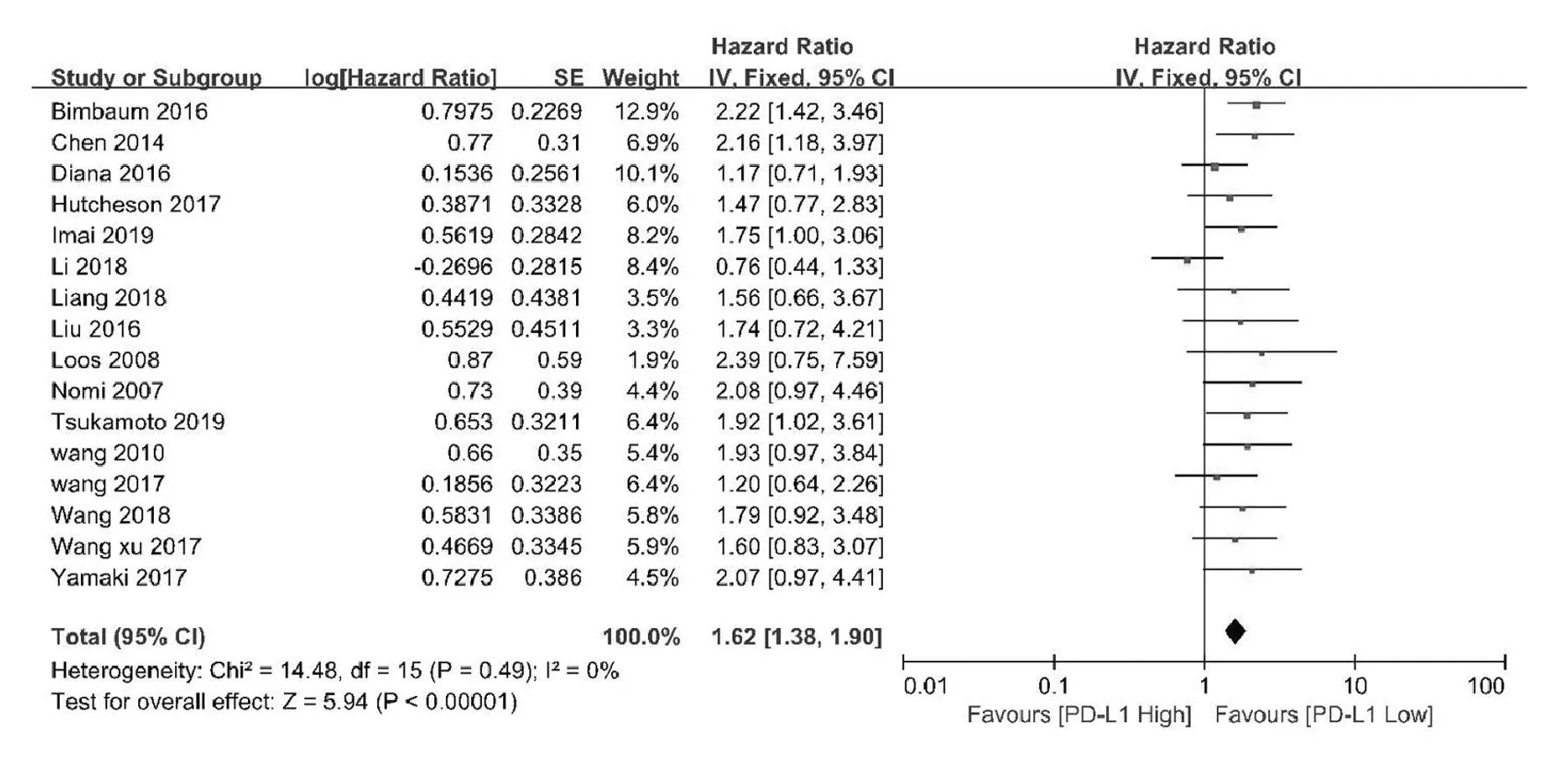
图1 胰腺癌患者PD-L1表达与总生存期关系的森林图
2.3 异质性分析
采用χ2检验和I2检验分析了各研究之间的异质性,其中,PD-L1表达与肿瘤浸润程度(P<0.001;I2=81%)的相关性分析之间存在异质性,因此这项分析应用随机效应模式;其他相关性分析使用固定效应模式。
2.4 发表偏倚和敏感性分析
纳入研究的胰腺癌患者PD-L1表达与总生存率、性别、肿瘤浸润程度、肿瘤组织分化程度、淋巴转移等5个因素均在9篇文献以上,漏斗图显示各因素的发表偏倚均较小,PD-L1与胰腺癌患者总生存期关系的漏斗图见图2。
3 讨论
程序性死亡受体1(programmed death 1,PD-1)属于CD28家族,表达于活化的T细胞表面,调节T细胞的增殖与活化[22]。PD-L1(亦被称作B7-H1)是PD-1的主要配体,表达于一些肿瘤细胞、活化的T细胞和B细胞、树突状细胞、巨噬细胞和内皮细胞[23]。PD-L1和PD-1结合可导致活化T细胞的凋亡或耗竭[24]。肿瘤细胞通过多种机制诱导PD-L1表达,从而帮助肿瘤细胞逃避宿主的免疫监视[25]。上述研究均提示PD-L1或许是一个潜在的预后标志物。现有研究报道,胰腺癌组织中PD-L1表达增高,但总体表达的阳性率低于其他实体肿瘤。如Herbst等[26]对胰腺导管腺癌石蜡切片行免疫组化染色后发现,PD-L1阳性率(阳性细胞>5%细胞总数)较低;本研究对15篇文献中1862例胰腺癌患者进行分析,PD-L1高表达阳性率仅为29.6%(550/1862)。这一研究和Taube等的报道相一致,胰腺导管腺癌肿瘤细胞中PD-L1的表达阳性率,远低于非小细胞肺癌、黑色素瘤、肾细胞癌肿瘤组织中PD-L1肿瘤细胞53%~89%、肿瘤浸润淋巴细胞(TILs)50%~100%的阳性率[27]。

表2 胰腺癌临床病理特征与PD-L1表达的关系

图2 胰腺癌患者PD-L1与总生存期关系的漏斗图
本研究通过对16篇公开发表的文献中的临床特征资料进行归纳汇总,以期全面评价PD-L1表达与PDCA患者预后的相关性。结果显示:PD-L1高表达与PDCA患者的不良预后有显著相关性,这一研究和Zhuan-Sun[28]、Gao[29]的meta分析结果相一致,本研究的死亡风险增加61%。而在临床病理特征方面,本研究与Zhuan-Sun、Gao究有所差异。本研究中,PDCA患者肿瘤组织中PD-L1表达与肿瘤浸润程度(P=0.04)、肿瘤组织分化程度(P<0.001)、神经浸润(P<0.001)、淋巴转移(P=0.01)、吸烟(P=0.004)显著相关;而与患者性别、肿瘤部位、肿瘤远处转移、是否并发糖尿病之间的关系不明显。分析原因,本研究的文献(16项,2085例患者)多于Zhuan-Sun(10项,1058例患者)和Gao(9项,989例患者)的研究,因而我们的研究分析更为全面和概括。
现有研究发现,在某些实体肿瘤中,PD-L1在肿瘤组织中的异常表达,为独立的不良预后指标。学者Li等[30]在原发性肝癌的研究中发现,PD-L1高表达与肝癌患者的总体生存率有着密切相关性。Chen等[31]也发现PD-L1的高表达提示食管癌患者不良预后。同时,Karim[32]研究却发现,宫颈癌肿瘤组织中PD-L1高表达,与宫颈癌患者的总体生存率并无显著相关性。因此,肿瘤组织PD-L1的异常表达,不能肯定是某一种实体肿瘤的预后标志物,而是和相关肿瘤的组织病理学类型有关。这提示我们,应该根据肿瘤患者的具体病理学特征,有针对性地采取PD-1免疫靶向治疗,从而提高临床治疗的有效性。
现有研究发现,阻断PD-L1能够增强肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)对肿瘤细胞的作用。将应用中和抗体阻断PD-L1的活化T细胞移植入患者机体内,可以延缓头颈部鳞癌的发展,相比仅移植活化T细胞的机体生存率要明显提高[33]。基础研究发现,程序性死亡受体1(PD-L1)阻断剂通过抑制肿瘤细胞PD-L1与T淋巴细胞表面的PD-1通路,解除后两者介导的T细胞免疫抑制作用,进而诱导T细胞活化,重建机体对肿瘤细胞的监测和攻击能力,从而消灭癌细胞,由此预测PD-1/PD-L1信号通路是未来药物治疗的目标之一。现有临床研究已证实[34],PD-1阻断剂单药治疗或联合化疗有临床获益,肿瘤客观应答率得到提升,应答持续时间明显延长;同时患者也表现出良好的耐受性和安全性。若就PD-L1表达而言,高表达的肿瘤患者接受抗PD-1治疗,其临床疗效比低表达者更为优异[34-36]。
但是现有资料提示,单用PD-1/PD-L1抑制剂治疗PDCA效果不佳,客观缓解率为0[37]。然而最新临床研究又发现,与单纯化疗药物相比,索拉非尼(sorafenib)联合伏立诺他(vorinostat)与抗PD-L1抑制剂联用,可明显抑制PDCA肿瘤细胞的进一步生长[38]。这为PDCA患者的治疗提供了新的思路。
本文综合研究了PD-L1表达与PDCA发生发展的关系,分析各种临床因素与PD-L1的相关性,并通过统计学的分析,更加直观地了解到PDCA发生发展中PD-L1表达与影响的关系。但本研究在一定程度上仍有着无法避免的混杂因素、选择性偏倚及发表性偏倚。因此未来尚待更大样本的研究予以验证。
