杞黄颗粒对H2O2诱导的人视网膜色素上皮细胞炎症损伤的保护作用△
2021-01-29王燕袁远吕佳庞龙邱波苏冬莹关晓莹乡晓岚李坚昊
王燕 袁远 吕佳 庞龙 邱波 苏冬莹 关晓莹 乡晓岚 李坚昊
年龄相关性黄斑变性(AMD)是老年人首要的致盲性眼病[1]。AMD根据临床表现和病理改变的不同分为湿性AMD和干性AMD,其中干性AMD是最常见的临床类型[2]。干性AMD早期以玻璃膜疣为主,晚期可发展至地图样萎缩而严重损害患者视力。干性AMD发病机制复杂,既往研究表明,氧化应激与炎症改变可对视网膜色素上皮(RPE)细胞造成损害,从而导致AMD发生发展[3-5]。另外,很多细胞因子参与RPE细胞的炎症反应,如β淀粉样蛋白(Aβ)、补体因子H(CFH)、C3、C5等[5-7]。由于干性AMD发病机制不明,故迄今尚无有效的治疗方法[3]。
补肾益气活血方——中药制剂为杞黄颗粒(QHG),是我们医院治疗AMD 的经验方。我们的前期研究发现,QHG对AMD患者有一定的临床疗效,有助于稳定及改善患者的视力和眼底改变[8],对AMD患者的血清CFH也有一定的上调作用[9]。但该方对RPE细胞的保护作用未知。本课题拟在前期研究基础上探讨QHG对人RPE细胞氧化损伤的保护作用,以及对Aβ及补体替代通路终末产物攻膜复合物(MAC)的影响,以探明其作用机制,为临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 实验对象人RPE细胞系ARPE-19购自ATCC公司,使用含体积分数10%胎牛血清、100 U·mL-1青霉素和100 g·L-1链霉素的DMEM/F12完全培养基培养,放置于含体积分数5%CO2、37 ℃恒温恒湿的培养箱中孵育。
1.1.2 实验药物QHG主要成分为丹参、枸杞、褚实子、茺蔚子,由江苏江阴天江药业有限公司提供,药品批号:1612350。
1.1.3 主要试剂及仪器DMEM(美国Hyelon公司),DMSO(广州威佳科技有限公司),2.5 g·L-1胰蛋白酶、胎牛血清(美国Gibco公司),Muse Oxidative stress Kit、Muse Multicaspase Kit(美国Millipore公司),Aβ和 MAC ELISA试剂盒(武汉纯度生物科技有限公司),RNA 提取试剂盒(美国 Invitrogen 公司),qPCR 试剂盒[宝生物工程(大连)有限公司]。高速离心机(香港力康生物医疗科技控股有限公司),涡旋振荡器(武汉赛维尔生物科技有限公司),纯水仪(青岛富勒姆科技有限公司),流式细胞仪(美国Milipore公司),酶标检测仪(深圳雷杜生命科学股份有限公司),Real-time PCR 仪(瑞士Roche公司LightCycler 96型)。
1.2 方法
1.2.1 MTT法筛选QHG最佳药物浓度将ARPE-19细胞按每孔4×103个接种于96孔板,细胞贴壁后分别加入1 g·L-1、2 g·L-1、4 g·L-1、8 g·L-1QHG溶解液,作用24 h 后弃去培养液,每孔加入含有5 g·L-1MTT的无血清培养液20 μL,37 ℃ 培养4 h后弃去培养液,每孔加入150 μL DMSO 溶液,置摇床使甲瓒完全溶解后,在490 nm波长下测定吸光度值,根据吸光度值计算细胞增殖率。
1.2.2 细胞分组根据预实验对H2O2作用ARPE-19细胞半数致死量浓度的筛选,选择200 μmol·L-1作为H2O2造模加药浓度;根据MTT实验结果,选择1 g·L-1和2 g·L-1的QHG作为可实验浓度。ARPE-19细胞随机分成 4 组,对照组:常规培养,不做特殊处理;H2O2损伤组:200 μmol·L-1H2O2作用ARPE-19细胞24 h;QHG 低剂量组:1 g·L-1QHG作用ARPE-19细胞 24 h后,再加入200 μmol·L-1H2O2作用24 h;QHG高剂量组:2 g·L-1QHG作用ARPE-19细胞 24 h后,再加入200 μmol·L-1H2O2作用24 h。
1.2.3 细胞凋亡的形态学观察将ARPE-19细胞按每孔 4×103个接种于6孔板内,细胞分组处理后,弃去完全培养基,磷酸盐缓冲液(PBS)洗涤2次后加入40 g·L-1多聚甲醛固定细胞10 min,PBS充分冲洗固定液,相差显微镜下观察并拍照。
1.2.4 流式细胞仪测定细胞凋亡率将各组ARPE-19细胞收集离心后加入1×PBS 100 μL重悬细胞。将1×Caspase Buffer 50 μL和Multicaspase Reagent 5 μL在1.5 mL离心管中混匀,混和液分别加入各组细胞悬液10 μL再混匀,然后将含混和液的离心管置于37 ℃培养箱避光孵育 30 min。剩余的1×Caspase Buffer加入7-AAD原液5 μL配制成7-AAD工作液。从37 ℃培养箱中取出离心管,避光条件下各加入150 μL 7-AAD工作液,室温避光孵育5 min。流式细胞仪检测各组细胞凋亡率。
1.2.5 Real-time PCR检测Aβ mRNA的相对表达量参照 TRIzol 法提取各组ARPE-19细胞总 RNA,按照逆转录试剂盒说明书操作步骤反转录合成cDNA。以 cDNA 为模板,用LightCycler 96型Real-time PCR 仪进行 PCR 扩增,检测Aβ mRNA的表达。Aβ上游引物序列为5’-TGTCCAGAATGGGAAGTGGG-3’,下游引物序列为5’-GTTCAGGGTAGACTTCTTGGC-3’;GAPDH上游引物序列为5’-CCTCAAGATCATCAGCAAT-3’,下游引物序列为5’-CCATCCACAGTCTTCTGGGT-3’。实验独立重复3次,最后数据以2-△△Ct进行统计学分析。
1.2.6 ELISA检测Aβ和MAC的蛋白表达水平4组细胞分别处理结束后,将上清液移至EP管中,通过ELISA试剂盒检测Aβ和MAC的蛋白表达水平。实验步骤按照试剂盒说明书进行,空白孔加通用稀释液,其余相应孔加不同浓度标准品和标本(每孔100 μL),酶标板用封口胶密封后,37 ℃温育 60 min后弃去液体,充分清洗酶标板5次,将水分彻底吸干。在各孔中依次加入显色液 A 50 μL和显色液 B 50 μL。37 ℃ 避光显色15 min后,每孔加终止液50 μL,终止反应。酶标仪450 nm 波长处检测各孔吸光度值。使用标准曲线法分别计算Aβ和MAC的蛋白浓度。

2 结果
2.1 QHG对RPE细胞形态的影响相差显微镜下可见,对照组:ARPE-19细胞形态规则,呈梭形,细胞间连接紧密,融合度良好(图 1A);H2O2损伤组:ARPE-19细胞由梭形变成圆形,细胞间连接疏松,融合不佳,凋亡细胞数增加(图 1B);QHG低剂量组:细胞形态较H2O2损伤组好转,部分细胞恢复梭形(图1C);QHG高剂量组:大部分细胞恢复梭形,凋亡细胞数明显减少(图 1D)。对照组、H2O2损伤组、QHG低剂量组、QHG高剂量组每高倍视野下细胞数分别为(150.00±20.00)×104个、(25.00±4.00)×104个、(79.30±3.05)×104个、(92.00±7.21)×104个。H2O2损伤组ARPE-19细胞数较对照组显著降低,差异有统计学意义(t=10.62,P<0.01);QHG低剂量组、QHG高剂量组ARPE-19细胞数均较H2O2损伤组明显增加,差异均有统计学意义(t=18.70、14.07,均为P<0.01),但QHG高剂量组与QHG低剂量组间ARPE-19细胞数差异无统计学意义(P>0.05)。

图1 相差显微镜下各组ARPE-19细胞形态(×100) A:对照组;B:H2O2损伤组;C:QHG低剂量组;D:QHG高剂量组。
2.2 QHG对RPE细胞凋亡率的影响对照组、H2O2损伤组、QHG低剂量组、QHG高剂量组ARPE-19细胞凋亡率分别为(6.85±0.14)%、(43.60±1.80)%、(23.23±1.43)%、(17.90±0.78)%。H2O2损伤组ARPE-19细胞凋亡率较对照组明显增加(t=20.34,P<0.001);QHG低剂量组、QHG高剂量组ARPE-19细胞凋亡率均较H2O2损伤组明显降低,差异均有统计学意义(t=8.86、13.10,均为P<0.01),且QHG高剂量组ARPE-19细胞凋亡率较QHG低剂量组降低更明显,差异有统计学意义(t=3.27,P<0.05)(见图2)。
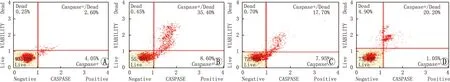
图2 流式细胞仪检测各组ARPE-19细胞凋亡率 A:对照组;B:H2O2损伤组;C:QHG低剂量组;D:QHG高剂量组。
2.3 QHG对Aβ mRNA表达的影响Real-time PCR 检测结果显示,H2O2损伤组Aβ mRNA相对表达量较对照组上调,差异有显著统计学意义(t=14.38,P<0.01)。QHG低剂量及QHG高剂量组Aβ mRNA表达水平均较H2O2损伤组降低,差异均有显著统计学意义(t=7.52、10.00,均为P<0.01),但QHG高剂量组与QHG低剂量组Aβ mRNA表达间差异无统计学意义(P>0.05)(见图3)。
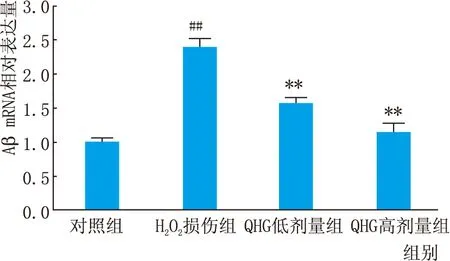
图3 Real-time PCR检测各组ARPE-19细胞Aβ mRNA相对表达量 与对照组比较,##P<0.01;与H2O2损伤组比较,**P<0.01。
2.4 QHG对Aβ及MAC的蛋白表达的影响ELISA检测结果显示,与对照组相比,H2O2损伤组Aβ及MAC的蛋白表达水平均显著升高,差异均有显著统计学意义(t=12.88、4.99,均为P<0.01)。与H2O2损伤组比较,QHG低剂量组、QHG 高剂量组均可明显下调Aβ及MAC的蛋白表达水平,差异均有显著统计学意义(Aβ蛋白:t=7.51、10.00,均为P<0.01;MAC蛋白:t=4.83、6.83,均为P<0.01),但QHG高剂量组与QHG低剂量组间Aβ及MAC的蛋白表达水平差异均无统计学意义(均为P>0.05)(见表1)。

表1 各组ARPE-19细胞上清液Aβ 及MAC蛋白表达水平
3 讨论
在我国,随着人口老龄化程度增加和人们寿命延长,AMD成为导致失明的重要原因之一。干性AMD占AMD的80%~90%[10],是AMD最常见的类型。干性AMD发病机制不明,至今尚无有效药物治疗方法,中药治疗AMD在我国应用广泛,但其具体作用机制尚不明确。我们前期研究发现,QHG具有改善或稳定AMD患者视力的作用,并具有上调人血清CFH的作用[8-9]。本研究即在前期研究基础上进一步探讨QHG对人RPE细胞的保护机制。
大量研究表明,氧化应激损伤是 AMD 最为重要的发病机制,氧化应激可诱导RPE细胞内活性氧堆积,造成细胞凋亡,最终导致视网膜功能障碍及结构失调[11]。H2O2作为一种强氧化剂,多用于诱导细胞发生氧化应激损伤[11]。本研究采用H2O2诱导的 ARPE-19 细胞来建立氧化应激AMD模型,结果显示,APRE-19细胞在给予200 μmol·L-1H2O2处理后,相差显微镜下可见凋亡细胞明显增多,流式细胞仪检测细胞凋亡率达(43.60±1.80)%,较对照组的(6.85±0.14)%明显增高;而在给予1 g·L-1及2 g·L-1QHG预处理后,相差显微镜下正常细胞数明显增多,细胞凋亡率分别降低到(23.23±1.43)%和(17.90±0.78)%。说明QHG能显著减少H2O2诱导的ARPE-19细胞的凋亡。
近年来研究发现,Aβ是干性AMD发病机制中的重要启动因子[12]。Aβ可在人RPE细胞和视网膜神经节细胞上表达[13]。生理情况下Aβ的生成和降解处于动态平衡中,某些病理情况下这一平衡被破坏,导致Aβ在眼内大量聚集,Aβ在眼内具有毒性作用,其可直接损伤RPE细胞和视网膜神经节细胞;也可激活细胞及视网膜内的补体替代途径,诱导眼内免疫炎症反应;还可参与玻璃膜疣的形成[12-14]。本研究结果显示,H2O2可明显升高ARPE-19细胞的Aβ mRNA和蛋白的表达,QHG可降低ARPE-19细胞Aβ mRNA和蛋白表达水平,提示QHG通过降低Aβ的表达而保护ARPE-19细胞免受H2O2诱导的炎症损伤。
2005年,遗传基因学发现CFH的多态性与AMD相关[15],随后研究发现,补体替代途径异常激活引起的视网膜局部亚炎症反应是AMD发生发展的重要因素[16]。补体C5b-9复合物是该通路的终末产物,又称作MAC,其作用于RPE细胞的细胞膜,可使RPE细胞溶解[17]。正常生理情况下,该通路处于低活化状态;在病理状态下,该通路会被异常激活而发生补体级联反应,引起炎症因子释放及MAC生成,导致视网膜组织持续性亚炎症反应,自身正常的RPE细胞及脉络膜内皮细胞受到攻击,造成组织受损[17]。近年来研究发现,Aβ可激活补体替代途径而导致视网膜炎症反应[18]。Kumar等[18]在小鼠体内研究发现,随着小鼠年龄的增长,Aβ在RPE层的表达增多,随之诱导MAC表达增多而使小鼠视网膜萎缩。本研究发现,QHG可降低ARPE-19细胞MAC蛋白表达水平,提示QHG可通过下调MAC的表达而起到抑制炎症、减少ARPE-19细胞凋亡的作用。
QHG是一种复方制剂,由丹参、枸杞、褚实子、茺蔚子等组成,其中丹参和枸杞是该药最主要的成分。现代中药药理学研究显示,QHG中的很多中药单体都具有抗炎及免疫调节的作用。Mao等[19]研究发现,在氧化损伤条件下,丹参通过降低RPE细胞白细胞介素-18 和肿瘤坏死因子-α等炎症因子的表达而起到抗炎作用;Wang等[20]研究发现,丹参的活性成分之一丹参酮在急性心肌损伤模型大鼠中具有调节补体级联反应的作用。曹秀朋等[21]报道,枸杞子提取物能有效抑制光诱导所致小鼠RPE细胞的损伤,并能提高血清的抗氧化能力。宋宇等[22]研究发现,茺蔚子具有较强的体外抗氧化活性。本研究发现,QHG具有降低Aβ及MAC表达的作用,对ARPE-19细胞炎症损伤有保护作用,结合上述中药单体的药理学研究我们推测,QHG对RPE细胞的抗炎作用与这些中药单体药理学作用相关。
综上所述,QHG能有效抑制H2O2损伤所致ARPE-19细胞凋亡,减少细胞Aβ及MAC表达量,从而起到保护人RPE细胞的作用。本研究为QHG临床运用提供了理论基础,但还需要更多的临床及分子生物学研究深入地探讨其作用机制。
