电解质溶液中离子浓度关系巧突破
2021-01-29甘肃张世华
◇ 甘肃 张世华
在教学过程中,我们发现学生总是存在一些问题,其中突出的问题有:1)思维无序.这是导致学生失分的主要原因.2)思维僵化.对所学知识掌握不到位,接受新信息的能力差.3)数学计算能力差.对于这些问题,主要的解决步骤是:1)理清考点.2)分析步骤.根据题意,先找出溶液中溶质成分以及量的关系;再写出溶质、溶剂的电离方程式以及可水解的盐提供的弱离子的水解方程式.3)吸收精华,快速解答.
1 以文字叙述展示信息
例1(2019年江苏卷)室温下,反应HCO-3+H2O⇌H2CO3+OH-的平衡常数K=2.2×10-8.将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的Zn O.若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( ).
A.0.2mol·L-1氨水:
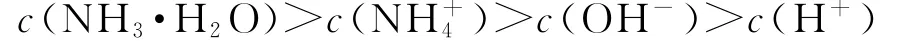
B.0.2 mol·L-1NH4HCO3溶液 (p H>7):c(NH+4)>c(HCO-3)>c(H2CO3)>c(NH3·H2O)
C.0.2mol·L-1氨水和0.2mol·L-1NH4HCO3溶液等体积混合:c(NH+4)+c(NH3·H2O)=c(H2CO3)+c(HCO-3)+c(CO2-3)
D.0.6mol·L-1氨水和0.2mol·L-1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(CO2-3)+c(OH-)=0.3mol·L-1+c(H2CO3)+c(H+)
分析选项A溶质为 NH3·H2O,属于弱碱,部分电离,氨水中存在的电离平衡有NH3·H2O⇌NH+4+OH-,H2O⇌H++OH-,所以c(OH-)>c(NH+4),选项A错误;选项B溶质属于可水解的盐,溶液中既存在溶质溶剂的电离,又存在HCO-3和NH+4的水解,其溶液显碱性,说明HCO-3的水解大于NH+4的水解,但水解是微弱的,所以c(NH+4)>c(HCO-3)>c(H2CO3)>c(NH3·H2O),选项B正确;选项C、D属于混合溶液的问题,但两溶质不反应,根据物料守恒,n(N)∶n(C)=2∶1,则有c(NH+4)+c(NH3·H2O)=2[c(H2CO3)+c(HCO-3)+c(C)],选项C错误;根据物料守恒,n(N)∶n(C)=4∶1,则有c(NH+4)+c(NH3·H2O)=4[c(H2CO3)+c(HCO-3)+c(CO)],学生在此受思维僵化和运算能力的限制,就止步不前了.实际上,此处还隐含另外两个物料守恒的变形:c(H2CO3)+c(HCO-3)+c(CO)=0.1mol·L-1和c(NH+4)+c(NH3·H2O)=0.4mol·L-1,分别变形得c(HCO-3)=0.1mol·L-1-c(H2CO3)-c(CO);c(NH+4)=0.4 mol·L-1-c(NH3·H2O),将其代入电荷守恒式c(NH+4)+c(H+)=c(HCO-3)+2c(CO2-3)+c(OH-)就可得c(NH3·H2O)+c(OH-)+c(CO)=c(H+)+c(H2CO3)+0.3mol·L-1,选项D正确.
2 结合图象考查离子浓度
例2常温下,向20m L0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出的c(H+)随滴入氨水体积变化如图1所示,下列分析正确的是( ).

图1
A.F点溶液中c(NH+4)=2c(B2-)
B.Na HB溶液可能为酸性,也可能为碱性

C.E点溶液中离子浓度大小关系为D.A、B、C三点溶液的p H逐渐减小,D、E、F三点溶液的p H逐渐增大
分析从起点A分析可知,此时溶液中溶质只有H2B,故溶液中OH-只由水提供,此时c水(OH-)=c水(H+)=c溶液(OH-)=10-13mol·L-1,故c溶液(H+)=10-1mol·L-1=0.05×2 mol·L-1,由此可判断出H2B为二元强酸,Na HB为二元强酸的酸式盐,其水溶液显酸性,选项B错误.D点水的电离程度最大,故该点酸碱刚好完全中和,溶质为(NH4)2B;F点溶液中溶质为(NH4)2B和NH3·H2O,溶液中的H+只由水提供,由图可见,此时c水(H+)=10-7mol·L-1=c溶液(H+),溶液呈中性,据电荷守恒,有c(NH+4)+c(H+)=2c(B2-)+c(OH-),选项A正确.E点溶液呈酸性,c(H+)>c(OH-),选项C错误.从A点到F点,一直在加碱,故p H一直呈增大趋势,选项D错误.
