奥司他韦对流感病毒肺炎模型幼鼠的治疗效果及其对血清免疫球蛋白水平的影响
2021-01-28任春梅范贵荣陶永进
许 斌,任春梅,范贵荣,刘 冰,陶永进
(四川绵阳四○四医院:1.感染科;2.消化内科;3.检验科 621000)
小儿肺炎是婴幼儿时期的常见病,主要特点是多发并且四季都可能发生,常见症状为发热、咳嗽、气促、呼吸困难及肺部出现啰音等。甲型流感引发肺炎的发生率为5%~38%[1]。流感病毒传染性强,容易变异。奥司他韦属于一种特异性抑制剂,对神经氨酸酶有显著的抑制效果,可促进成熟的流感病毒脱离宿主细胞,从而抑制流感病毒传播[2]。免疫球蛋白主要包括抗体免疫球蛋白和膜免疫球蛋白,可与不同的细胞表面受体结合,从而表现出不同的生物学活性[3]。研究显示,肺炎的发病机制与免疫球蛋白的免疫反应存在着密切联系[4]。本文主要研究奥司他韦对流感病毒肺炎模型幼鼠的治疗效果及其对血清免疫球蛋白(Ig)G、IgM、IgA水平的影响,现报道如下。
1 材料与方法
1.1 材料
30只雄性、健康、清洁昆明幼鼠,3~4周龄,平均(3.5±0.3)周,体质量12~14 g,平均(13.5±1.5)g,由河北医科大学实验动物中心提供,所有幼鼠在无病原菌的清洁笼子里喂养,所饮用的水和食物均经过高温、高压消毒。甲型流感病毒(H1N1)株A/FM1/47由中国预防医学科学研究院病毒研究所提供,在本院病毒实验室冻存。奥司他韦(磷酸奥司他韦颗粒,宜昌东阳光长江药业股份有限公司,规格:每袋15 mg,每盒10袋);一抗和二抗购自武汉博士德生物工程有限公司。本研究经过本院伦理委员会批准通过[审批件(2018)伦审第(21)号]。
1.2 方法
1.2.1肺炎模型建立
从30只幼鼠中随机选取25只建立病毒性肺炎模型。H1N1解冻之后在9 d龄鸡胚的尿囊腔中进行接种并培养、传代。H1N1肺炎模型建立参考文献[5],将流感病毒增毒之后的新鲜尿囊液(血凝滴度为1∶1 280)按照10倍系数稀释6个浓度,用乙醚麻醉幼鼠后,鼻腔内接种H1N1,每只幼鼠接种0.05 mL,连续观察幼鼠14 d,幼鼠出现惊厥、昏迷、腹泻、严重喘息说明建模成功。
1.2.2分组及给药
将肺炎模型建模成功的16只幼鼠随机分为模型组、奥司他韦组,每组各8只,设立对照组幼鼠5只。奥司他韦组幼鼠均采取灌胃的形式灌注10 mg/kg奥司他韦,每天1次。模型组和对照组幼鼠采用等体积的无菌蒸馏水灌胃,连续治疗5 d。
1.2.3肺功能相关指标检测
3组幼鼠治疗5 d后,采用5 mL 10%水合氯醛进行腹腔麻醉,气管切开后进行气管插管,幼鼠放置在体描箱中,头保持低位,与呼吸机管路相连,采用小动物肺功能仪进行检测。外加压力使幼鼠进行深呼吸,给予机械通气,检测肺功能指标:50%用力呼气流量(FEF50)、75%用力呼气流量(FEF75)、最大呼气中段流量(MMF)、呼气峰流速值(PEF)。将幼鼠麻醉后间隔30 min,在手术台上固定,抽取股动脉血,保存在肝素钠抗凝管中,每管2 mL,-20 ℃环境下保存、待测。处死幼鼠,全肺摘除后称质量,肺系数=肺湿重/处死时体质量×100%。
1.2.4病理形态学观察
处死所有幼鼠后将其肺部组织取出,在10%甲醛溶液中保持48 h,脱水、浸蜡、包埋、切片、脱蜡处理后,采用苏木素-伊红(HE)进行染色,在显微镜下(×100)观察幼鼠病理学特征。
1.2.5双抗体夹心法检测血清免疫球蛋白
将抽取的股动脉血3 mL以1 000 r/min离心20 min,分离上层血清,吸附在微量滴板的小孔里进行洗涤,加入待测抗原,如果二者是特异的,则会产生结合反应,洗去多余抗体,加入与待测抗原呈现出特异反应的酶联抗体,使其形成“夹心”现象,加入该酶的底物,如果能看到有色的酶解产物产生,则说明在孔壁上存在相对应的抗原,从而通过显色后读取的具体浓度数据计算IgG、IgM及IgA表达水平。
1.2.6Western blot检测Notch1、Notch胞内结构域(NICD)及Notch配体(Jagged1)
将采集到的标本使用磷酸盐缓冲溶液(PBS)清洗3遍以上,分离缓冲液,加入细胞裂解液,裂解35 min,提取总蛋白,用二喹啉甲酸(BCA)测定蛋白水平。每孔取20 μg总蛋白,通过10%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)凝胶进行电泳,加入适量浓缩的SDS-PAGE蛋白缓冲液15 min;100 V电泳10 min,将电转膜放在冰浴中转膜,在37 ℃环境下摇床上封闭1.5 h;与一抗结合,加入TBST(1∶1 000)稀释一抗Tubulin(内参照),在4 ℃环境下孵育过夜、保存;次日用TBST缓冲液清洗,与二抗结合在室温下孵育1 h,再次用TBST缓冲液反复清洗。最后加入显影剂将其在底物溶液中进行显色,分析Notch1、NICD、Jagged1灰度值,目的蛋白相对表达水平=目的蛋白条带灰度值/内参条带灰度值。
1.3 统计学处理

2 结 果
2.1 各组幼鼠肺功能指标比较
模型组和奥司他韦组FEF50、FEF75、MMF、PEF均低于对照组,肺系数均高于对照组(P<0.05);奥司他韦组FEF50、FEF75、MMF、PEF均高于模型组,肺系数低于模型组(P<0.05),见表1。
2.2 各组幼鼠肺组织病理学观察
正常幼鼠肺部组织结构完整,未见炎性细胞浸润;模型组出现炎性细胞浸润,肺泡的细胞壁变宽,出现水肿现象,肺泡间间隔变宽,在肺间质和毛细血管壁之间出现充血,并且出现大量的巨噬细胞及淋巴细胞浸润,渗出纤维素样物,纤维结缔组织出现增生现象;奥司他韦组炎性细胞浸润明显减轻,支气管平滑肌厚度降低,见图1。
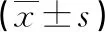
表1各组幼鼠肺功能指标比较

图1 各组幼鼠肺组织病理学观察(HE染色,×200)
2.3 各组幼鼠血清免疫球蛋白水平比较
模型组和奥司他韦组血清IgG、IgM及IgA水平均明显低于对照组(P<0.05),奥司他韦组血清IgG、IgM及IgA水平均明显高于模型组(P<0.05),见表2。
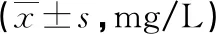
表2 各组幼鼠血清IgG、IgM及IgA水平 比较
2.4 奥司他韦对肺炎模型幼鼠Notch1、NICD及Jagged1蛋白的影响
模型组和奥司他韦组Notch1、NICD、Jagged1蛋白水平均明显高于对照组(P<0.05),奥司他韦组Notch1、NICD、Jagged1蛋白水平均明显低于模型组(P<0.05),见表3、图2。

图2 Notch1、NICD及Jagged1蛋白Western blot条带
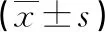
表3 奥司他韦对肺炎模型幼鼠Notch1、NICD及Jagged1蛋白的影响
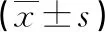
续表3 奥司他韦对肺炎模型幼鼠Notch1、NICD及 Jagged1蛋白的影响
3 讨 论
导致病毒性肺炎的原因很多,主要和免疫因素有关,患儿年龄小,免疫功能低下,容易感染,治疗也相对困难[6-7]。小儿流感病毒性肺炎初期的临床症状是突发高热、头痛、全身肌肉和关节疼痛等,与其他病毒性肺炎有明显的区别[8]。随着病情进展,婴幼儿会出现咳嗽、咳痰、吸气性凹陷、呼吸频率增加等症状[9]。如果婴幼儿发生病毒感染后不能及时进行治疗,会进一步发生继发性感染。因此,寻求有效的治疗方式对病毒性肺炎患儿至关重要。本研究主要通过建立流感病毒肺炎幼鼠模型,探讨奥司他韦治疗流感病毒肺炎的效果。
袁冕等[10]研究显示,磷酸奥司他韦颗粒在治疗儿童病毒性肺炎中效果显著,可以有效抑制病毒在患儿体内传播。奥司他韦的主要特点是具有较高的特异性,对其他类型的病毒、细菌及人体中的神经氨酸酶没有抑制效果,而机体对流感病毒感染后的免疫应答不具有抑制作用[11-12]。本研究显示,与模型组比较,奥司他韦组FEF50、FEF75、MMF、PEF均升高,肺系数降低,表明奥司他韦可以改善幼鼠肺功能,降低幼鼠的气管反应,有助于幼鼠恢复。相关研究显示,口服奥司他韦肠道易吸收,其通过肝、肠酯酶转化为羧酸奥司他韦,可作用于肺、气管、支气管及肺泡中病毒感染处[13-14]。本研究结果显示,奥司他韦组幼鼠肺组织中炎性细胞浸润较模型组明显改善,表明奥司他韦可以减轻幼鼠体内的炎性反应,促进肺功能恢复。
免疫球蛋白有激活补体的作用,可与细胞表面的Fc受体结合,表现出不同的生物学作用。近年来有研究表明,病毒性肺炎的发病机制与免疫球蛋白的免疫反应也存在着密切的关系,其中IgA就是关联性较强的指标,活性增强后的辅助性T淋巴细胞产生大量IgA,可形成免疫复合物沉积在全身小血管壁上[15]。在患儿发病的同时,其他免疫指标IgM、IgG及IgE等也会发生不同的特异性反应,这些指标水平的变化对疾病的诊疗也具有重要的参考价值[16]。本研究结果显示,与模型组比较,奥司他韦组IgG、IgM及IgA水平明显提高,表明奥司他韦可以有效改善幼鼠免疫球蛋白水平,对病毒复制有干扰作用,影响病毒在机体内的表达。
Notch属于一种高度保守的信号,其主要的受体是Notch1蛋白,在调控细胞分化过程中发挥着关键性的作用,同时在肺炎的发生、发展过程中发挥着重要作用。Notch1蛋白在炎症、免疫反应中,以及微血管的形成中起到重要作用[17]。研究显示,Notch信号在肺纤维化病变的上皮干细胞中起决定性作用,Notch1促进白细胞介素分泌,与肺炎的发病有紧密的联系[18]。研究认为,通过对Notch信号进行干预,可以减轻肺炎的发展进程,减少肺功能的损伤[19]。Jagged1是Notch信号通路中的最主要的配体,对Notch1信号激活有帮助。NICD是Notch1活性形式的存在,NICD表达水平可有效反映Jagged1/Notch1的活化情况[20]。肺纤维化的发生与Notch信号通路有紧密的联系。本研究结果显示,与模型组比较,奥司他韦组Notch1、NICD及Jagged1蛋白水平下调。
综上所述,奥司他韦有助于激活Notch1/Jagged1通路,促进IgG、IgM、IgA水平升高,下调Notch1、NICD、Jagged1表达,促进幼鼠肺功能恢复,达到治疗流感病毒性肺炎的作用。
