反复种植失败患者宫腔镜内膜活检术后妊娠结局相关因素分析
2021-01-28张奕文李蓉
张奕文,李蓉
体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)技术发展40年至今,成为治疗不孕症的主要方式。随着促排卵、IVF-ET技术的日益成熟,不孕症患者临床妊娠率有了一定程度的提高。但仍有5%~10%的患者在多次接受优质胚胎移植后仍不能获得临床妊娠,即反复种植失败(repeated implantation failure,RIF)[1]。根据目前研究,RIF的主要原因为胚胎异常、子宫解剖结构异常(宫腔病变、子宫畸形等)、子宫内膜容受性降低及多因素作用(如输卵管积水、子宫内膜异位症及卵巢刺激不当等)[2]。其中,改善子宫内膜容受性是提高胚胎着床率的关键因素。
宫腔镜内膜活检术可发现、处理宫腔病变,同时对子宫内膜形成机械损伤,改善子宫内膜容受性,提高临床妊娠率。系统性回顾研究表明,不论宫腔镜检查有无发现宫腔病变,行宫腔镜检查的RIF患者临床妊娠率显著提高,即使宫腔镜检查显示宫腔形态正常,同时行内膜活检能提高RIF患者再次移植后的临床妊娠率[3-4]。本研究通过回顾性分析136例接受宫腔镜内膜活检术的RIF患者临床资料,旨在探讨影响RIF患者宫腔镜内膜活检术后第1次ET临床妊娠的相关因素,为改善RIF患者临床妊娠率提供理论依据。
1 对象与方法
1.1 研究对象 本研究为回顾性病例对照研究,通过我院的电子病历系统检索和收集资料,选取2015年9月—2017年9月在我院生殖医学中心进行宫腔镜内膜活检术的RIF患者136例为研究对象,平均年龄为33.4岁(25~44岁),依据宫腔镜内膜活检术后第1次移植的临床妊娠结局(是否有临床妊娠)分为妊娠组及非妊娠组。RIF诊断标准:3次及以上ET,且每次移植均有1~2枚优质胚胎均未能妊娠。排除标准:子宫畸形(如子宫纵隔、双角子宫、单角子宫等)及子宫畸形手术治疗后;未经治疗的输卵管积水、子宫内膜异位症、宫腔镜检查发现宫腔粘连、子宫内膜息肉、黏膜下肌瘤及子宫内膜炎;严重男性因素性不孕(如无精子症,重度少、弱精子症等)。
1.2 观察指标 根据临床观察结果及文献报道,选取12个可能影响宫腔镜内膜活检术后临床妊娠率的因素作为观察指标,并予以量化性赋值,包括年龄、身高、体质量、不孕年限、不孕类型(原发性不孕=1、继发性不孕=2)、宫腔镜检查时期(增殖期=1、分泌期=2)、移植失败次数、移植前子宫内膜厚度、移植周期(冻融周期=1、新鲜周期=2)、移植距宫腔镜时间(<1个月=1、1~3个月=2、3~6个月=3、≥6个月=4)、移植胚胎类型(卵裂期胚胎=1、囊胚=2)及移植胚胎数量(1个=1、2个=2)。
1.3 宫腔镜手术及术后处理 宫腔镜手术均在门诊完成,采用丙泊酚静脉麻醉。手术选择在非月经期进行(增殖期或分泌期),选用的是STORZ宫腔镜,该宫腔镜具有30°视野,2.9 mm连续流鞘,膨宫介质为生理盐水(0.9%氯化钠溶液),膨宫压力为20 kPa,宫腔镜内膜活检术术中图像均由高敏感度冷光源光纤电视摄像机采集。患者采取膀胱截石位,用扩宫棒逐号扩张宫口至7号,将宫腔镜置入宫腔内,观察宫腔形态,包括双侧输卵管开口、双侧宫角及子宫四壁,最后在检查宫颈管的同时逐渐收回宫腔镜。如果检测到子宫内膜息肉、宫腔粘连及黏膜下肌瘤,则去除相应病变,恢复正常宫腔形态,不论有无宫腔病变均用Pipelle管于宫底及宫腔四壁取子宫内膜行活检术,术中所有标本均行组织病理学检查。所有患者均在术后观察30 min,如果没有发现任何不良反应或并发症即可出院。
1.4 IVF-ET、冻融胚胎移植(frozen-thawed embryo transfer,FET)过程 根据患者年龄、卵巢储备功能以及既往促排卵方案选择控制性卵巢刺激方案,包括促性腺激素释放激素激动剂 (gonadotropin releasing hormone agonist,GnRHa) 长方案、GnRHa短方案、GnRHa超短方案、GnRHa超长方案及GnRH 拮抗剂(gonadotropin releasing hormone antagonist,GnRHA)方案。
促性腺激素(Gn)的使用类型及启动剂量需要根据患者的年龄、基础窦卵泡数及激素水平来选择,当2个以上卵泡直径达到18 mm时,注射人绒毛膜促性腺激素(Human chorionic gonadotropin,hCG),36~38 h后经阴道超声监测下行穿刺取卵术。取出卵母细胞后,体外培养4~6 h需根据男方精液情况选择IVF或胞浆内单精子注射(ICSI),授精后17~19 h成熟卵母细胞完成受精,胞质内出现二原核(2PN),记录2PN受精卵数。68~72 h进行卵裂期胚胎质量评估,挑选出1~2枚优质胚胎移植或冷冻。经患者签署知情同意书后,选择进行囊胚培养者,继续将卵裂期胚胎培养至受精后的第5~6天,胚胎将发育至囊胚期,根据囊胚腔的大小将囊胚分为1~6级。3级及3级以上的囊胚还需要对内细胞团和滋养层进行评分。
促排卵周期无明显ET禁忌证的患者,取卵后第3天选取优质卵裂期胚胎进行移植,移植≤2枚胚胎,若无优质胚胎,则移植可移植胚胎;适合囊胚移植的患者,则于取卵后第5~6天选取优质囊胚进行移植,优先单囊胚移植原则,囊胚数量不可超过2个,若无优质囊胚则移植可移植囊胚。取卵日起开始使用黄体支持,可以选择口服地屈孕酮片(20~40 mg/d)或黄体酮微粒、阴道使用黄体酮凝胶或肌内注射黄体酮。
促排卵周期孕酮水平提前升高、黄体期促排卵造成的内膜与胚胎发育完全不同步、中重度卵巢过度刺激综合征发生风险高、宫腔积液等不能移植的患者,需先将胚胎冷冻,择期行冻融胚胎移植。
冻融周期移植方法:对于月经周期规律、有排卵者于排卵后第3天移植卵裂期胚胎,排卵后第5~6天移植囊胚。无排卵或排卵障碍患者采用促排卵治疗或人工激素替代周期准备内膜,移植后给予黄体支持。移植前需记录子宫内膜厚度。
ET后14 d测血清hCG水平,如血清hCG水平>30 IU/mL,1周后复查,移植后30~35 d行阴道超声检查,宫腔内探及可见胎心搏动的妊娠囊诊断为临床妊娠。
1.5 统计学方法 采用SPSS 21.0统计软件进行数据描述与分析,符合正态分布的定量资料采用均数±标准差()表示,组间比较采用两独立样本均数的t检验,不符合正态分布的定量资料采用中位数和四分位数[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验;定性资料采用例数(百分比)表示,组间比较采用卡方检验或Fisher确切概率法。在多因素分析上,采用多因素Logistic回归分析RIF患者宫腔镜内膜活检术后第1次胚胎移植临床妊娠结局的影响因素。所有检验均以P<0.05为差异有统计学意义。
2 结果
2.1 2组一般情况比较 本研究共136例患者符合纳入标准,其中妊娠组70例,非妊娠组66例,临床妊娠率为51.5%。2组患者的年龄比较差异有统计学意义(P<0.05);而身高、体质量、不孕年限、移植失败次数、不孕类型比较差异均无统计学意义(P>0.05)。见表1。
2.2 2组患者术后再次种植情况比较 2组患者的移植胚胎类型比较差异有统计学意义(P<0.05);而宫腔镜检查时期、移植前子宫内膜厚度、移植距宫腔镜时间、移植周期及移植胚胎数量比较,差异均无统计学意义(P>0.05)。见表2。
2.3 多因素Logistic回归分析 将12个可能影响宫腔镜内膜活检术后临床妊娠率的因素进行多因素Logistic回归分析。以年龄、身高、体质量、不孕类型、不孕年限、宫腔镜检查时期、移植周期、子宫内膜厚度、既往移植次数、移植距宫腔镜时间、移植胚胎数、移植胚胎类型作为自变量,临床妊娠作为因变量。结果显示年龄及移植胚胎类型是影响宫腔镜子宫内膜活检术后临床妊娠率的独立因素,其中各因素的OR值分别为1.160、0.307,见表3。
3 讨论
3.1 临床妊娠率 在本研究中,RIF患者宫腔镜内膜活检术后第1次ET的临床妊娠率为51.5%,表明移植前行宫腔镜内膜活检术可显著提高RIF患者再次种植的临床妊娠率,与Cao等[3]、赵小玲等[5]的研究结果一致。其原因可能是宫腔镜手术使宫颈扩张,改善了宫颈管狭窄,通过子宫内膜活检可去除部分不规则增生的内膜,促进上皮细胞和基质细胞的增生和分化,同时可以促进子宫内膜螺旋动脉的形成,调节毛细血管的舒张功能,增加子宫内膜血流,这样可提高子宫内膜对于外源激素的敏感性,更有利于胚胎着床[6]。从分子生物学角度考虑,已有研究证实子宫内膜机械性损伤可引起子宫内膜的干细胞增生、迁移和分化,使免疫细胞聚集,促进子宫内膜的炎症反应,最终导致巨噬细胞炎性蛋白、白血病抑制因子等与子宫内膜容受性相关因子的表达,促使树突状细胞及巨噬细胞的活化,最终可提高胚胎种植率[7]。研究报道RIF患者宫腔镜内膜活检术后ET的临床妊娠率为27.1%~39.4%[8-9],而我院生殖中心RIF患者术后临床妊娠率高于其他生殖中心,可能是由于我院生殖中心在移植前会通过给予免疫治疗、改善子宫内膜菲薄、增加子宫内膜血流供应、治疗输卵管积水、利用现有技术获得优质胚胎等方式,减少了降低临床妊娠率的影响因素,因此RIF患者中因子宫内膜容受性导致不孕的比例较高,通过宫腔镜内膜活检术改善子宫内膜容受性,术后临床妊娠率显著提高。

表1 2组一般情况比较
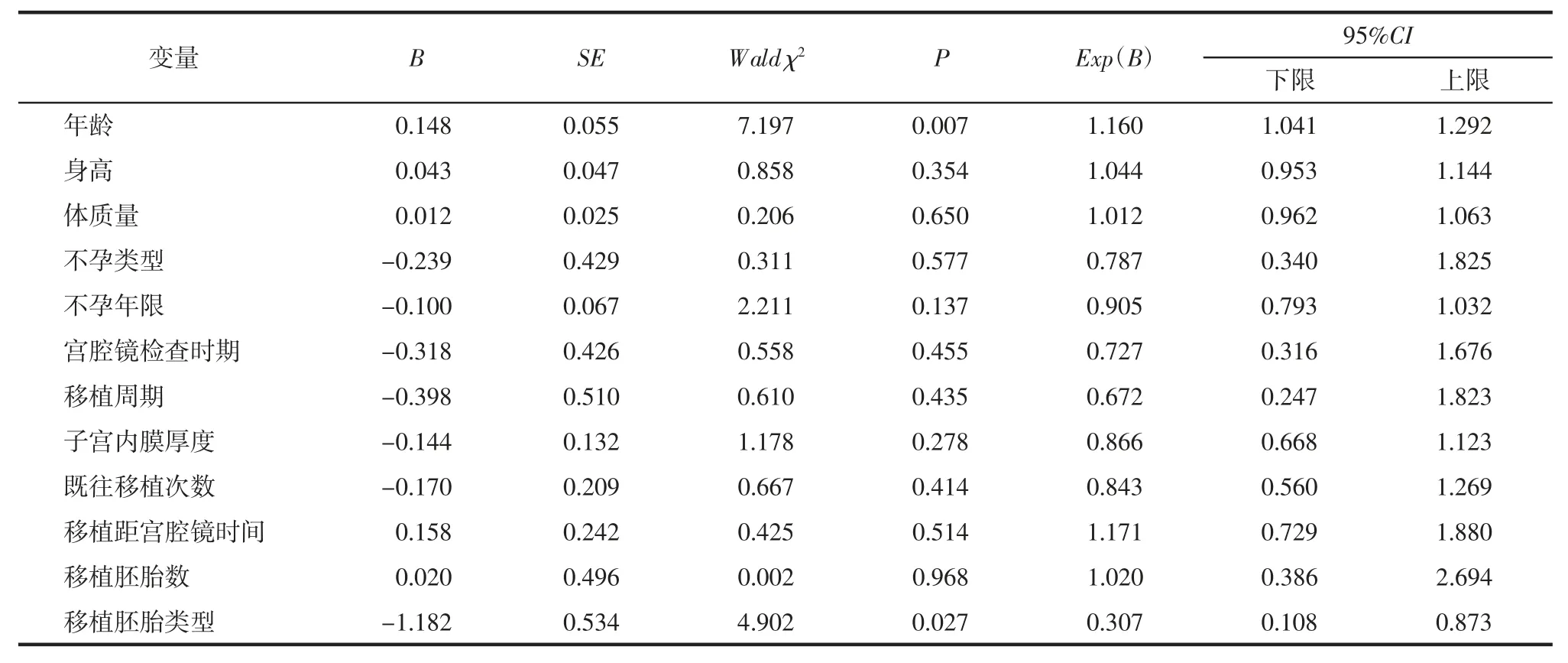
表3 宫腔镜内膜活检术术后临床妊娠的影响因素分析结果
3.2 影响因素 研究认为,年龄是RIF患者宫腔镜内膜活检术后第1次ET临床妊娠率的影响因素,本研究显示,妊娠组的平均年龄较非妊娠组的平均年龄小,差异有统计学差异(P<0.05)。这与既往文献结论一致,年龄<35岁患者的新鲜胚胎移植和冻融胚胎移植的着床率均显著高于年龄>44岁患者新鲜胚胎移植和冻融胚胎移植的着床率(41.3% vs.1.9%,47.1%vs.16.2%)[10]。随着女性年龄增加,卵巢中储备的卵母细胞数量逐渐减少,同时伴随着卵母细胞质量的下降,35周岁以上女性的卵巢储备能力明显下降,导致即使应用了较大剂量的Gn仍不能获得足够数量的卵泡,因而就更不易获得足够的优质胚胎,导致高龄患者难以获得临床妊娠。因此建议RIF患者尽早积极诊治,以免因为年龄增长减少临床妊娠的机会。
本研究中,妊娠组移植囊胚患者比例显著高于非妊娠组(61.4% vs. 36.4%,P<0.05),这与Levitas等[11]、Walsh等[12]的研究结论一致。囊胚是卵裂期胚胎继续发育的一个重要发育阶段,囊胚的形成过程同时是胚胎自然选择的过程,染色体异常、发育潜能差的胚胎大多数会停止发育,优质的胚胎才能发育至囊胚期。另外,在生理情况下,受精后第3天的卵裂期胚胎仍游走在输卵管中,发育至囊胚期才逐步从输卵管迁移到宫腔内并着床,囊胚的发育程度和子宫内膜的同步性更好,更符合生理过程。在患者卵巢功能尚可、取卵数满意情况下,可以选择囊胚培养,挑选出优质胚胎在适宜时期移植,以提高临床妊娠率。
既往研究中,在月经周期的增殖期或分泌期行宫腔镜内膜活检术均可改善临床妊娠率,但是关于RIF患者在月经周期的增殖期还是分泌期行宫腔镜内膜活检术能获得更高的临床妊娠率这一问题,目前尚无较多文献涉及。增殖期子宫内膜在高水平雌激素的作用下出现内膜细胞生长,间质组织再生及血管修复。排卵后,分泌期子宫内膜在雌、孕激素的作用下发生蜕膜化,间质疏松水肿,腺体弯曲并出现分泌现象。在本研究中,妊娠组于增殖期及分泌期行宫腔镜内膜活检术的比例与非妊娠组比较差异无统计学意义(P>0.05),表明RIF患者在增殖期或分泌期行宫腔镜内膜活检术均可同等程度改善临床妊娠率。虽然增殖期与分泌期子宫内膜结构差别明显,但既往研究表明,子宫内膜机械性损伤通过炎症机制改善子宫内膜容受性[13],炎症反应是一个持续动态的过程,细胞因子、趋化因子及细胞之间持续相互作用。本研究妊娠组与非妊娠组的宫腔镜距移植时间差异无统计学意义,炎症反应对子宫内膜容受性的改善可能持续存在,因此,动态持续的炎症反应在子宫内膜机械性损伤改善内膜容受性的过程中起着更重要的作用,而内膜机械性损伤的时机并不是主要影响因素。
Karayalçin等[14]对1 258例不孕症患者在ET前行宫腔镜检查术,根据ET距宫腔镜检查术的时间将患者分为3组,第1组ET距宫腔镜检查术时间≤50 d(n=407),第2组为50 d~6个月(n=280),第3组>6个月(n=571),3组患者的临床妊娠率差异有统计学意义(分别为45.2%、34.3%、27.1%,P<0.05),提示不孕症患者在ET前50 d行宫腔镜检查术可以获得更高的临床妊娠率。为了能够提高RIF患者的临床妊娠率,获得宫腔镜内膜活检术与术后第1次移植的最佳间隔时间,本研究将宫腔镜距移植时间分为4个时间段:≤1个月、1~3个月、3~6个月、>6个月,在妊娠组与非妊娠组的比较中发现,宫腔镜距移植时间并无显著差异,但是本研究纳入样本量较少,应继续采用大样本前瞻性研究证实该结论。
子宫内膜厚度也是影响子宫内膜容受性的因素之一。有研究将在超声下子宫内膜厚度<7 mm定义为薄型子宫内膜[15],但也有学者将新鲜周期的排卵触发日及冻融周期孕酮使用前子宫内膜厚度≤7~8 mm定义为薄型子宫内膜[16]。2014年Kasius等[17]对1 170例患者进行系统性回顾研究,结果显示,7 mm是子宫内膜厚度的一个折点,子宫内膜厚度≤7 mm的患者临床妊娠率和活产率均显著降低。本研究中,妊娠组的子宫内膜平均厚度与非妊娠组比较差异无统计学意义(P>0.05),2组患者的子宫内膜厚度均为10 mm左右。本研究入组患者中,仅1例患者移植前为薄型子宫内膜,厚度为6 mm,本研究并未大量涵盖薄型子宫内膜患者,因此不能有效证明移植前子宫内膜厚度是否为RIF患者宫腔镜内膜活检术后再次种植的影响因素,需要大样本研究获得准确结论。
本研究中,妊娠组中冻融周期及新鲜周期移植的比例与非妊娠组比较差异并无统计学意义(P>0.05),表明复苏周期与新鲜周期的临床妊娠率相似。最近有研究证实,复苏周期移植的临床妊娠率优于新鲜周期移植,新鲜周期移植的子宫内膜提前转化,使胚胎与子宫内膜发育不同步,导致临床妊娠率降低,而冻融周期移植可以获得更好的子宫内膜容受性及胚胎与子宫内膜的同步性,获得更高的临床妊娠率[18-20]。本研究中冻融周期移植与新鲜周期移植的临床妊娠率相似可能是因为部分冻融周期移植的胚胎来自于新鲜周期移植后剩余的可利用胚胎,质量通常不如新鲜周期胚胎,一定程度上降低了冻融周期移植的临床妊娠率。与新鲜周期移植相比,冻融周期移植具有优势,可以提高单个取卵周期的累积妊娠率,降低多胎妊娠率及重度卵巢过度刺激综合征等并发症发生率。但是冻融周期移植会增加患者的治疗时间及医疗负担,冻融胚胎可能存在潜在的冷冻损伤,对子代表观遗传学的影响尚不能排除,冻融过程中有胚胎溶解、凋亡的风险。因此,在辅助生殖技术中能否将冻融周期移植作为首选仍需循证医学支持,对于不符合新鲜周期移植条件或者必须行胚胎冻存的患者行冻融周期移植可能是较好的选择。
综上所述,RIF患者移植前行宫腔镜内膜活检术可显著提高术后ET的临床妊娠率,如无手术禁忌建议RIF患者移植前行宫腔镜内膜活检术。本研究显示,宫腔镜内膜活检术在月经周期中的治疗时机,不是影响术后第1次ET临床妊娠的相关因素,无需在特定月经周期进行宫腔镜内膜活检术,减少患者的时间成本及医疗负担。移植胚胎类型及年龄是RIF患者宫腔镜内膜活检术后再次种植临床妊娠的影响因素。RIF患者宫腔镜内膜活检术后移植囊胚更容易获得临床妊娠。因此,RIF患者如卵巢储备尚可且卵裂期胚胎数量满意时可培养囊胚移植。年轻患者获得临床妊娠的概率更高,RIF患者需积极治疗,避免因中断治疗年龄增长降低临床妊娠的机会。本研究为回顾性研究,尚需进行前瞻性研究进一步确定RIF患者移植前行宫腔镜内膜活检术对临床妊娠的影响。
