关于康乃馨培育技术的探讨
2021-01-28曹碧珍
曹碧珍
(莆田市城厢区霞林街道办事处,福建莆田 351100)
康乃馨又名香石竹、麝香石竹等,其瓶苗微型花携带轻巧方便又经济实惠。随着社会的发展,人们开始重视绿色环保,用花卉美化人居环境成为新时尚。康乃馨有许多变种与杂交种,在温室里培育可以连续不断开花。康乃馨离体快速繁殖就是利用植物细胞的全能性,取植物的部分组织,在人为控制的无菌环境条件下,应用培养基培育出一株完整的植株。通过研究瓶苗微型花卉不仅丰富了瓶苗花卉品种,而且大大缩短了植株从幼苗到开花的时间,根据需要随时诱导开花,甚至可以使开花时间不再受季节限制,既节约种植面积,又降低栽培设施费用[1-3]。瓶苗微型花卉为花卉产业发展提供新的方向,满足了市场对鲜花的需求,也给人们带来了更大的经济效益。因此,研究瓶内开花技术,总结花芽的分化规律,掌握开花的调控机理具有非常重要的意义。目前,瓶苗主要是被用作母苗应用于科学研究,并推广供观赏。基于此,探讨康乃馨快速繁殖及微型化技术,为花卉快速繁殖及工厂生产提供科学依据。
1 培育
1.1 实验材料、仪器 实验材料为质量优良的康乃馨种子,实验试剂包括75%酒精、0.12%的升汞、萘乙酸(NAA)、多效唑(PP333)、赤霉素(GA)、细胞分裂素(6-BA)、蒸馏水、蔗糖、琼脂等。实验仪器包括试管、量筒、烧杯、玻璃棒、玻璃瓶、移液管、剪刀、镊子、酒精灯、pH试纸、标签纸、电炉、METTLERPM200电子天平、高压蒸气灭菌锅、超净工作台、培养架等。
1.2 实验方法 (1)比对种子灭菌时间对康乃馨萌发的效果。在无菌的条件下将康乃馨种子在75%的酒精中浸泡10 s,后用无菌水清洗3~4次,然后用0.12%的升汞对康乃馨进行灭菌,各组灭菌时间分别为8、9、10、11、12 min。灭菌完用无菌水反复洗5~6次,后用无菌滤纸吸干水分,再接种到基本MS培养基上。每个灭菌时间处理接种5瓶,每瓶8粒种子,作标记置于培养室中,温度控制为(26±1)℃,光照时间为13 h/d,光照强度控制在2 000 Lx条件下培养。一个月后统计每组的污染率及萌发率,分析康乃馨种子最佳灭菌时间。
(2)浓度不同的多效唑(PP333)对康乃馨瓶苗壮苗矮化培养的影响。把1.2 cm无菌康乃馨茎段接种到含有0.25、0.50、0.75、1.00、1.25 mg/L多效唑PP333的MS培养基上,同样在温度为(26±1)℃,光照时间为13 h/d,光照强度为2 000 Lx的培养室里培养,观察瓶苗生长状况。
(3)浓度不同的细胞分裂素(6-BA)、赤霉素(GA)和萘乙酸(NAA)对康乃馨增殖的影响。种子萌发约3 cm长时,把无菌康乃馨瓶苗切成1~2 cm茎段,且每个茎段留一个叶片,接种到含有不同浓度的细胞分裂素6-BA、植物生长激素NAA和赤霉素GA的MS培养基上,做一个三因素四水平的正交试验。每瓶培养基接种5个茎段,然后置于温度为(26±1)℃,光照时间13 h/d,光照强度为2 000 Lx的培养室里培养,30 d后观察芽苗生长情况及其增殖系数。
(4)不同基本培养基对康乃馨瓶苗生根的影响。分别以MS、1/2MS、1/3MS以及1/4MS(MS培养基是最常用的培养基,成分是在配制1 L培养基时加硝酸铵1.65%、硝酸钾1.6 g、氯化钙0.44 g、硫酸镁0.37 g、磷酸二氢钾0.17 g、碘化钾0.83 mg、硼酸5.2 mg、硫酸锰22.3 mg、硫酸锌3.6 mg、钼酸钠0.25 mg、硫酸铜0.025 mg、氯化钴0.025 mg、硫酸铁27.8 mg、蔗糖30 g以及琼脂7 g)作为康乃馨不同的生根培养基,在无菌条件下,每个处理组4瓶且每瓶接种5个,在(26±1)℃下光照时间13 h/d光照强度为2 000 Lx的温室中进行培养,观察康乃馨的生根情况。
2 结果与分析
2.1 灭菌时间对康乃馨种子萌发的影响 本试验使用0.12%升汞对康乃馨种子进行灭菌,安排不同灭菌时间进行比较,接种15 d后统计种子萌发与污染情况,见表1。从表1可以看出,灭菌效果受灭菌时间影响很大,康乃馨种子的最佳灭菌时间为10 min,种子的未染菌萌发率为91.4%。

表1 灭菌消毒时间对康乃馨种子萌发的影响
2.2 不同浓度植物生长调节剂对康乃馨增殖的影响 不同浓度植物生长调节剂对康乃馨增殖的影响结果通过增殖实验正交法分析极差R得出影响效果(如表2):细胞分裂素6-BA>植物生长激素NAA>赤霉素GA;再通过细胞分裂素6-BA、植物生长激素NAA和赤霉素GA对康乃馨增殖的影响进行实验,通过比较平均值k1、k2、k3、k4得出(表3),实验得出的结论是细胞分裂素6-BA的最适增殖浓度为1.00 mg/L,植物生长激素NAA的最适增殖浓度为0.75 mg/L,赤霉素GA的最适增殖浓度为0.15 mg/L。
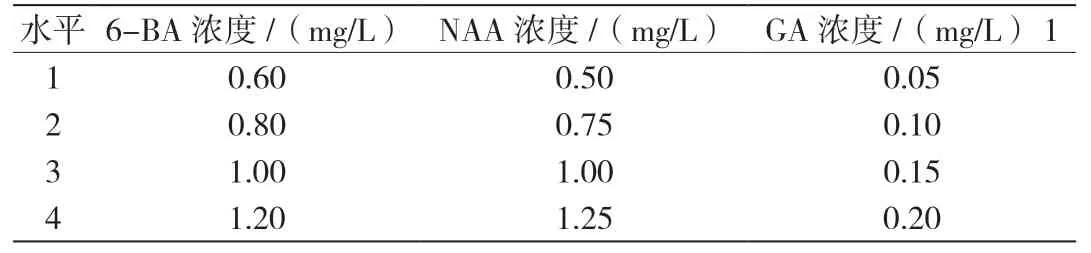
表2 增殖实验正交法因素水平表
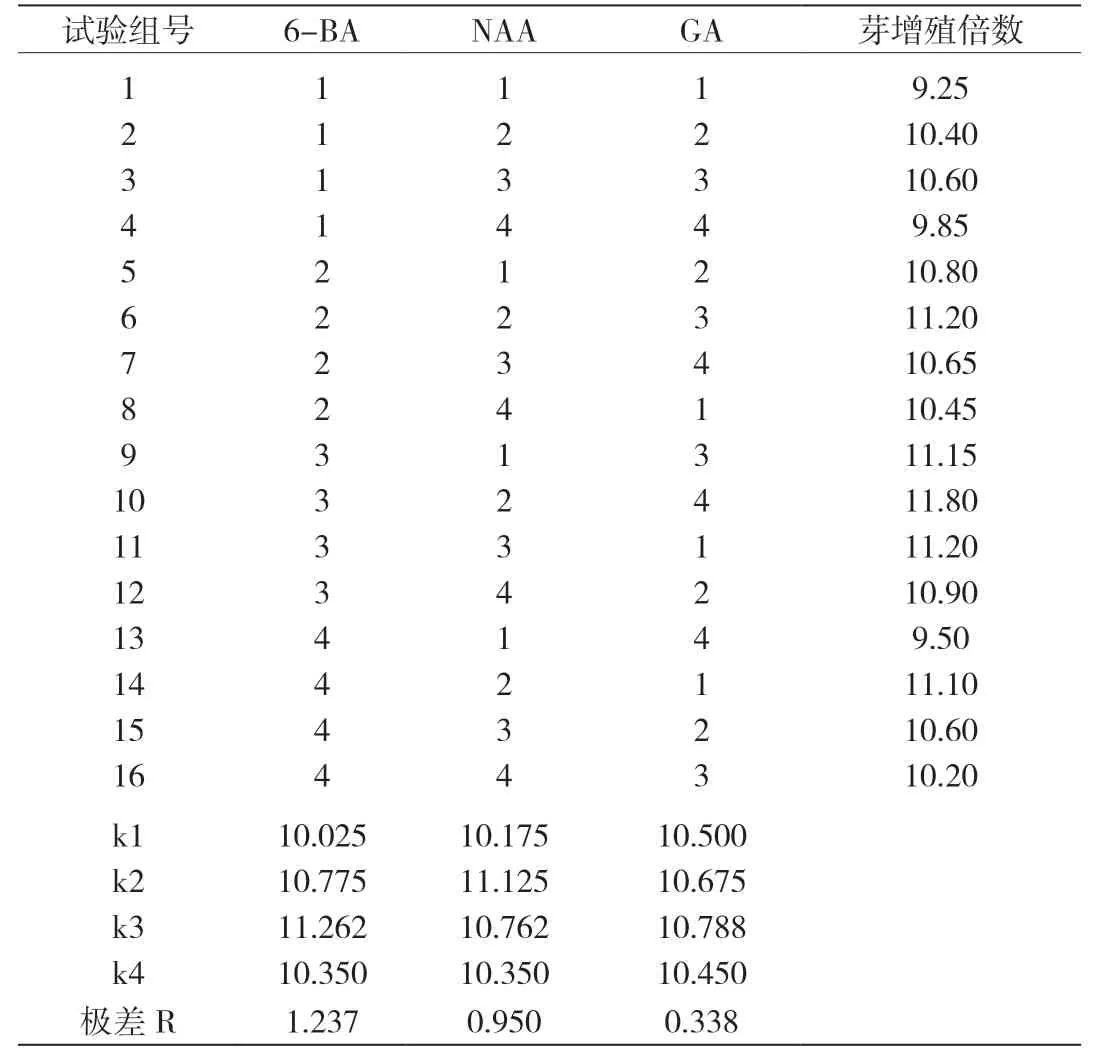
表3 6-BA、NAA和GA对康乃馨增殖的影响

表4 不同浓度PP333对康乃馨壮苗的影响
2.3 PP333浓度对康乃馨瓶苗壮苗矮化培养的影响 PP333是三唑类植物生长延缓剂,能延缓植物的生长发育,提高植物抗逆性,培育结果如表4。PP333浓度不同,对康乃馨的生长影响明显,低浓度影响不大,高浓度影响过大,植株长得过矮。PP333最适浓度为0.75 mg/L,此条件下植株矮壮健康,长势良好。因此,康乃馨最佳壮苗矮化培养基为MS+6-BA 1.00 mg/L+NAA 0.75 mg/L+PP333 0.75 mg/L+蔗糖30 g/L+琼脂9 g/L。
2.4 基本培养基对康乃馨瓶苗生根的影响 用1/2MS、1/3MS、1/4MS作康乃馨的生根培养基,培育结果如表5。从表5可知,培养基中营养成分的含量对康乃馨生根影响不同,用1/2MS培养基康乃馨的生根率最高,说明在一定范围内减少培养基中大量元素含量对康乃馨瓶苗的生根有促进作用。因此,最佳的生根培养基配方是1/2MS+NAA 0.75 mg/L+GA 0.15 mg/L+PP333 0.75 mg/L+蔗糖30 g/L+琼脂9 g/L。

表5 不同浓度基本MS培养基下康乃馨瓶苗生根率
3 讨论与结论
3.1 讨论 康乃馨的最佳灭菌时间为10 min,未染菌萌发率为91.4%。康乃馨的增殖试验过程中用到了三种植物生长调节剂,即NAA、6-BA和GA。NAA的作用是多方面的,包括刺激生长、促进生根、疏花疏果、防止落花落果、诱导开花、抑制抽芽、促进早熟和增产等。试验得出,培养康乃馨的最适NAA浓度为0.75 mg/L;6-BA作为一种常用的植物生长调节剂,能够促进细胞分裂、促进种子发芽、抑制或促进茎叶的伸长生长、抑制或促进根的生长、促进侧芽生长、促进花芽形成和开花等,对康乃馨增殖来说最适的6-BA浓度是1.0 mg/L。GA可刺激叶和芽的生长,解除休眠,促进开花结果,还有增产作用,试验得出,0.15 mg/L赤霉素对康乃馨的增殖效果最好。
多效唑是一种植物生长调节剂,具有延缓植物生长,抑制茎秆伸长,促进植物分蘖、矮化,增加植物抗逆性能,缩短节间、提高产量等效果。本试验中,多效唑浓度太低(0.25 mg/L)时,对康乃馨生长影响不明显,植株长得细高,没有达到壮苗的作用。当浓度太高时,即浓度为1.25 mg/L时,植株过于矮壮。所以多效唑浓度要适宜,本试验中康乃馨的最适多效唑浓度为0.75 mg/L。
实验表明,康乃馨的最佳生根基础培养基为1/2MS培养基,因为植物在生根过程中并不需要太多的营养。
康乃馨瓶苗离体快繁和微型化技术可以缩短植株从幼苗到开花的时间,使得开花时间不再受季节限制,也减少了种植面积。花卉微型化后利于种植,且对降低栽培设施费用的投资也同样起到了十分重要的作用因此,康乃馨瓶苗离体快繁和微型化技术有助于推动花卉产业发展。
3.2 结论 通过康乃馨瓶苗离体快繁和微型化技术试验得出结论:用0.12%升汞消毒的康乃馨外植体的最适灭菌时间为10 min,此时种子的未染菌萌发率为91.4%,污染率又极低;康乃馨的最适增殖培养基为MS+6-BA 1.0 mg/L+NAA 0.75 mg/L+GA 0.15 mg/L+糖30 g/L+琼 脂9 g/L;康乃馨最适壮苗矮化培养基为MS+6-BA 1.0 mg/L+NAA 0.75 mg/L+PP333 0.75 mg/L+糖30 g/L+琼 脂9 g/L;康乃馨最适生根培养基为1/2MS+NAA 0.75 mg/L+GA 0.15 mg/L+PP333 0.75 mg/L+糖30 g/L+琼脂9 g/L。
研究康乃馨瓶苗快繁和微型化技术,有助于带动瓶苗花卉产业多元化发展。康乃馨矮化壮苗生长转入生殖生长机理还需要继续研究,将该研究成果推广应用将创造出更多的经济效益。
