睡眠脑电成分对慢性意识障碍患者评估及预后预判的研究
2021-01-27夏晴杨艺强峻曾春王勇夏小雨党圆圆路长宇李凯孔德生何江弘赵元立刘献增
夏晴 杨艺 强峻 曾春 王勇 夏小雨 党圆圆 路长宇 李凯 孔德生 何江弘 赵元立 刘献增
意识障碍(disorders of consciousness,DOC)是指人们对自身和环境的感知发生障碍,或人们赖以感知环境的精神活动发生障碍的一种状态,主要表现为意识内容和(或)觉醒障碍[1]。严重DOC 包括植物状态(vegetative state,VS)、微意识状态(minimally conscious state,MCS),其中VS 患者有睡眠-觉醒周期,但完全丧失对自身及周围环境的觉知能力,即觉醒和觉知发生了分离,而MCS 患者则存在微弱但确定的觉知能力。从正常的模式到严重的损伤和结构紊乱的睡眠障碍,在DOC 病例中被广泛报道,并且一些模式与诊断和预后相关。
脑电活动是通过电极记录下来的脑细胞的自发性、节律性电活动,可以反映患者脑部的活动状况及其意识水平。α 节律活动是指正常人在清醒安静闭目时出现在后头部频率为8~13 Hz 的节律性活动,一般在枕区电压最高,波幅可变动,闭眼且精神放松状态下容易出现,注意力集中,特别是视觉注意和积极的精神活动可使其阻滞[2]。α 节律活动以枕叶为中心,并被认为起源于枕叶,但也有研究认为是丘脑起源。根据脑电活动特征可将意识状态分为:清醒期、浅睡眠期、深睡眠期和快眼动(rapid eye movement,REM)睡眠。顶尖波出现于非快眼动(non-rapid eye movement,NREM)睡眠Ⅰ期,并可延续至睡眠纺锤期即NREM 睡眠Ⅱ期的早期,顶尖波最大波幅出现在颅顶区,在缺少中线记录时以双侧中央、顶区最明显,可扩展至额、颞区;睡眠纺锤是进入NREM 睡眠Ⅱ期的标志,并可延续至NREM 睡眠Ⅲ期,睡眠纺锤产生于大脑皮质,其节律受丘脑-皮质投射系统调节[3]。研究表明,正常人群中不同睡眠分期的脑电活动比例结构相对一致。
本研究采用视频脑电图监测方法,分析患者治疗前后脑电背景活动及其特征性波形,比较不同意识水平以及不同预后患者在脑电成分上的差异,探寻DOC 患者的脑电活动规律和睡眠期脑电活动的特征,为改善临床治疗、加深对DOC相关机制的研究奠定初步基础。
一、资料与方法
1.一般资料:本研究选取北京大学国际医院神经外科自2020 年1 月至4 月收治的DOC 患者为研究对象。纳入标准[4]:(1)发病在28 d 以上(病情相对稳定,符合国际普遍公认的慢性期DOC 的诊断标准);(2)GCS 评分≤8 分;(3)患者家属知情并同意;(4)该研究符合2013 年修订的《赫尔辛基宣言》(www.wma.net/en/30publications/10policies/b3/index.html)要求。排除标准:(1)监测前使用过明显影响脑功能判断的药物(如镇静安眠剂、麻醉剂和抗精神病药等);(2)支持对脑电信号干扰较大的;(3)有采集脑电禁忌的患者。
2.评价指标:入院后1 周(T0)行3 次昏迷恢复量表-修订版(coma recovery scale-revised,CRS-R)评分,以最高分作为DOC 患者的诊断标准。结束基本治疗及外科治疗后7 d(T1)再次行CRS-R 评分,评价患者意识改变的行为学。出院后1个月随访,采用CRS-R 评分和格拉斯哥预后量表-扩展版(Glasgow outcome scale-extended,GOS-E)评分。GOS-E 评分>2 分或CRS-R 评分有诊断的跃迁评定为预后好。
3.脑电采集方法:采用Nicolet EEG 脑电采集监测系统(Natus Medical Inc,美国),按国际标准10-20 系统放置电极,采用平均参考作为参考,16 导双极导联记录法:左额极-平均参考(FP1-AVE)、右额极-平均参考(FP2-AVE)、左额-平均参考(F3-AVE)、右额-平均参考(F4-AVE)、左中央-平均参考(C3-AVE)、右中央-平均参考(C4-AVE)、左顶-平均参考(P3-AVE)、右顶-平均参考(P4-AVE)、左枕-平均参考(O1-AVE)、右枕-平均参考(O2-AVE)、左前颞-平均参考(F7-AVE)、右前颞-平均参考(F8-AVE)、左中颞-平均参考(T3-AVE)、右中颞-平均参考(T4-AVE)、左后颞-平均参考(T5-AVE)、右后颞-平均参考(T6-AVE)[5]。设定低频滤波0.016 Hz,高频滤波200 Hz,采样率为2000 Hz,记录时间为16 h 以上。将盘状电极以火棉胶固定于头皮。各导联阻抗控制在5 kΩ 以内,然后用医用网套固定。记录期间尽量减少外界干扰,并记录心电图。每次记录从下午4 点开始,在第2 天患者醒来后约1 h 结束。比较患者2 次脑电背景活动及其特征性波形的变化,将脑电活动中重要成分做半定量的记录。
同一患者T0 监测一次长时程脑电,T1 再次监测脑电,比较2 次脑电背景活动及其特征性波形的变化,以及不同意识水平和不同预后患者在睡眠脑电成分上的差异,寻找DOC患者的睡眠脑电规律。
4.脑电分析解读:观察患者脑电背景活动、波幅特点、反应性和睡眠特征性波形。脑电反应性被定义为给予声音刺激(耳边大声呼唤)、疼痛刺激(压眶)及光照刺激(光照),脑电活动出现波幅和频率的改变,具有确定性以及可重复性,且有明显锁时关系。睡眠波被定义为脑电监测中出现的顶尖波、睡眠纺锤波和K 综合波等特征性波形。通过脑电背景活动及波幅特点进行Young 分级。
二、结果
1.一般信息:采集长程脑电信息患者6 例,其中男性3例,女性3 例;病因外伤2 例,脑卒中3 例,缺血缺氧性脑病1例;病程范围2~29 个月,病程(9.7±3.1)个月。入院根据CRS-R评分,对6 例患者进行意识水平的行为检查,2 周内进行5 次评估,最高分作为最终诊断,其中MCS 3 例,VS 3 例(表1)。
2.脑电情况(半定量):6 例患者入院后完成长程脑电监测,枕区α 节律阳性者4 例,其中3 例MCS,1 例VS;脑电活动中睡眠特征性波形存在者3 例,其中2 例MCS,1 例VS,并不是所有MCS 患者均存在睡眠纺锤波。P1、P4 患者在T0、T1 时均存在纺锤波,预后更佳。P2 患者在T0 时无睡眠特征性波形,而T1 时出现了纺锤波和K 波,治疗后的睡眠脑电活动较之前更好,其预后较好。患者的睡眠脑电结构特征见表2。
3.睡眠脑电成分与患者意识水平的关系:不同意识水平的患者均有可能出现或不出现枕区α 节律,健侧为优势侧,睁眼时均未被抑制;但意识水平好的患者更有可能出现α 节律,本组3 例MCS 患者均可见,其中1 例MCS 患者患侧重现α 波形,但3 例VS 患者中仅1 例可见,另2 例不可见(图1)。
4.睡眠脑电成分与预后的关系:由表3 可知,预后较好的DOC 患者中有1 例VS、2 例MCS,但通过对比治疗前后DOC患者的脑电活动可知,预后较好的患者更有可能出现睡眠纺锤波形;其中VS 患者治疗前(T0)即可见睡眠纺锤波形,于治疗后(T1)时可记录到的纺锤波形较治疗前(T0)出现部位更为广泛,并可见顶尖波(图2A~B);MCS 患者治疗前(T0)1 例未见睡眠纺锤波形、1 例可见,于治疗后(T1)时记录到纺锤波形,包括相对较快频段12~14 Hz 甚至可达16 Hz 及相对较慢频段10~12 Hz,其中1 例在出现K 波的基础上并可见5 次K-综合波,即其上可复合睡眠纺锤波(图2C~D)。
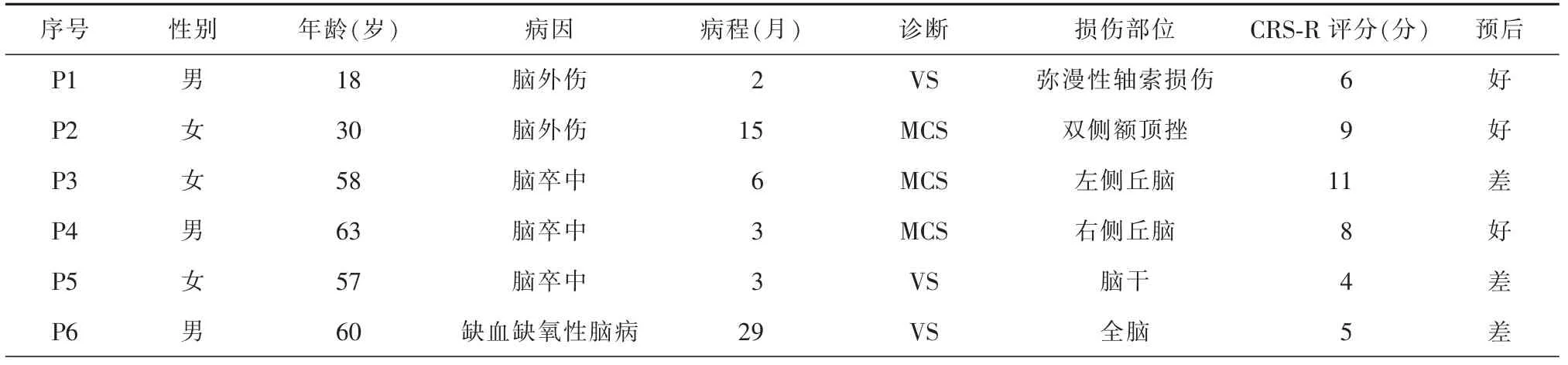
表1 意识障碍患者的一般情况
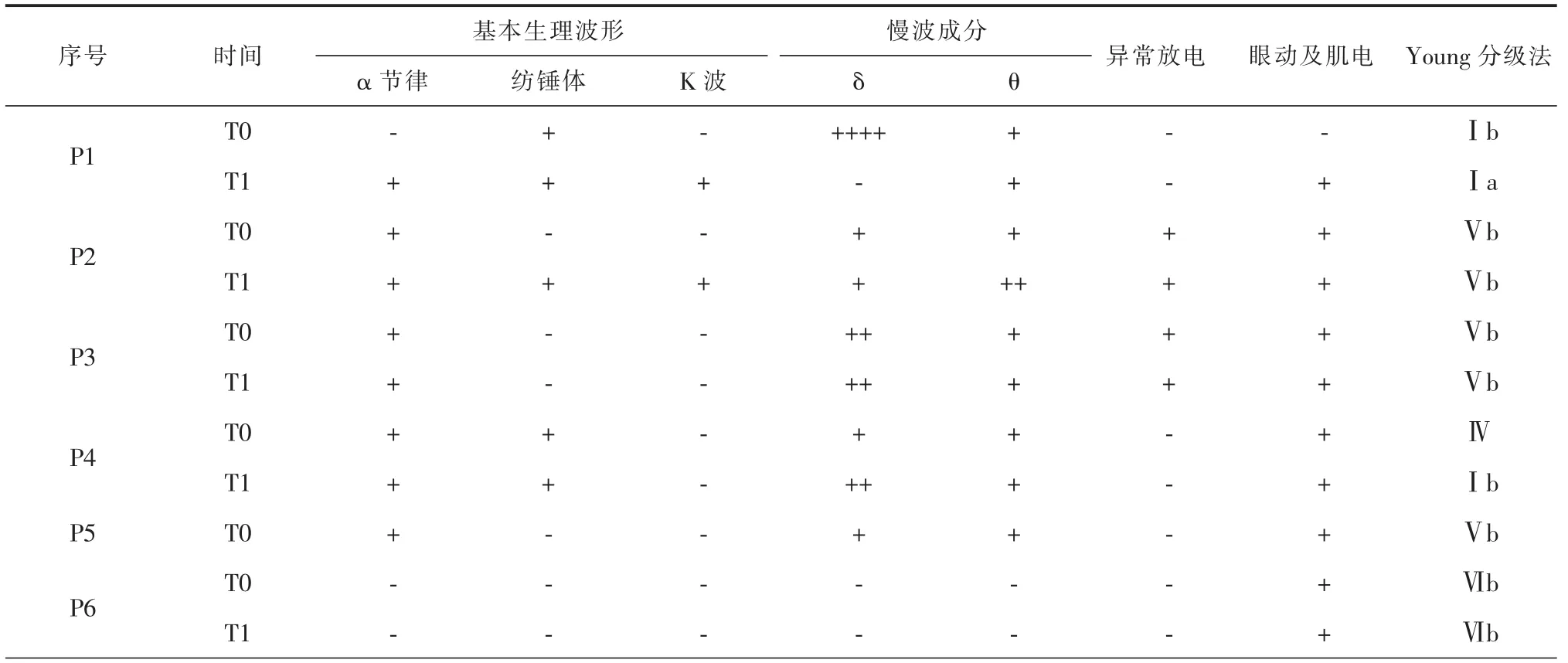
表2 患者2 次脑电中基线情况和脑电成分
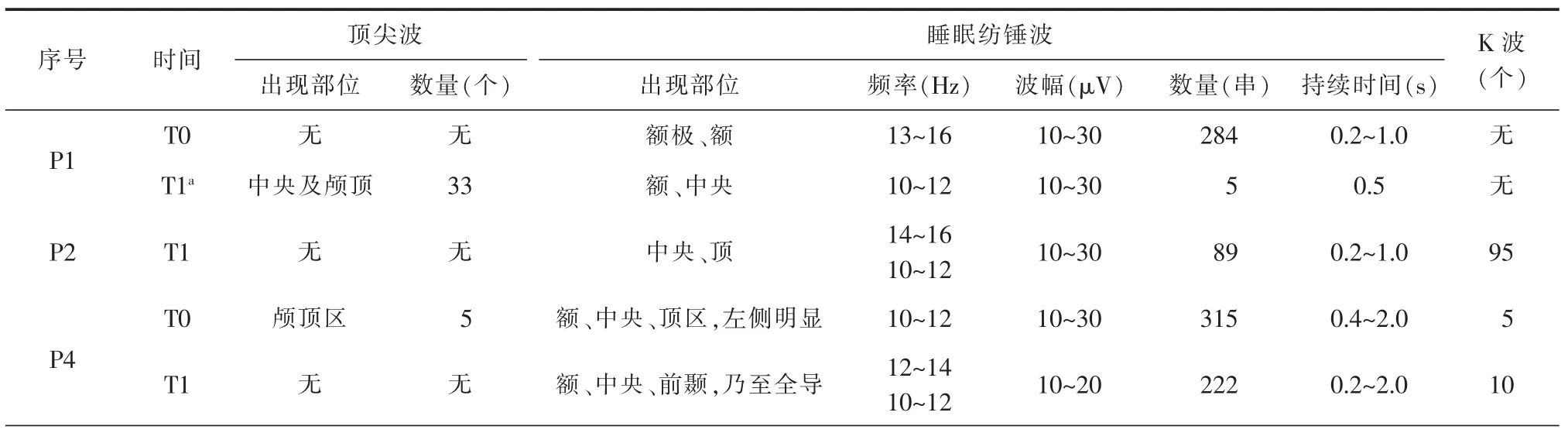
表3 3 例预后好的患者睡眠脑电成分量化分析
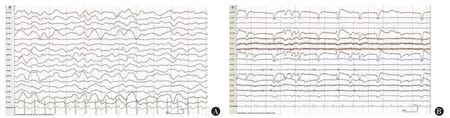
图1 2 例枕区未见α 节律患者的脑电图
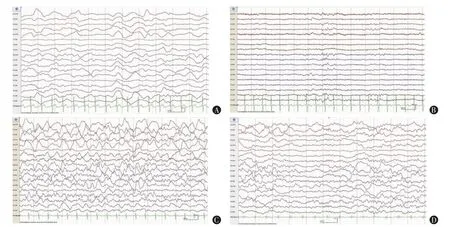
图2 2 例预后较好患者的脑电图睡眠特征性波形差异
三、讨论
从行为和神经生物学的角度来看,睡眠和意识密切相关。DOC 患者本身存在睡眠清醒周期,但缺乏意识内容,对自身及周围环境无法感知,且其觉醒状态具有波动性。脑电图具有安全、简便、可连续床旁检测等优点,被广泛应用于判定DOC 患者脑功能状况[6]。在健康个体中,睡眠期包括无意识期以及明确的脑电图变化,除了警觉行为的减少(临床上通过观察闭眼及肌肉不收缩来判断),睡眠有大量非常可靠的电生理学特征,比如慢波、纺锤波及快速眼动睡眠。有研究报道,标准睡眠周期的存在同时反映了大脑功能的完整性,而在卒中及阿尔茨海默病等病理状态下标准睡眠周期发生了改变[7]。在DOC 中,清醒和睡眠的可操作性电生理定义是有难度的。脑电图记录的振荡不再反映与正常生理睡眠相同的细胞机制。大幅度的慢波不一定像正常睡眠个体那样表示NREM 睡眠或慢波睡眠。睡眠分期阶段标准在DOC 中未定义。有关脑电图的研究集中在脑电波反应性对DOC 患者预后判断方面,而有关睡眠构成的研究较少。
2020 年欧洲意识障碍指南建议用睡眠脑电图进行DOC的诊断鉴别,作为多模式评估的一部分(证据不足,建议不足)[8]。慢波睡眠[非快速眼动睡眠阶段3;相对风险 (relative risk,RR)=5.90,95%置信区间(confidence interval,CI):2.32~15.01]、快速眼动睡眠 (RR=4.34,95%CI:2.11~8.90)、睡眠纺锤波(RR=1.78,95%CI:1.33~2.39)的存在是预后较好的表现[9]。
对VS 和MCS 患者进行观察,其中睡眠电生理的存在与行为觉醒变化之间有相互关系,而这一结果仍有争议。觉醒行为波动主要与脑干和基底前脑功能相联系,即与特定的上行网状激活系统活动有关系[10]。因此,闭眼及不动并不一定说明丘脑-皮层功能的改变,尤其在存在广泛丘脑-皮层去联系的患者,头皮脑电图可以检测到这些变化[11]。本研究6 例DOC 患者均有行为睡眠周期,其中5 例患者存在自发的睁闭眼活动,脑干反射多保留,另1 例患者(P5)睁眼行为极少,为脑干严重损伤。
有文献报道,纺锤波可以反映丘脑保留的功能完整性,睡眠纺锤波是健康人第二阶段睡眠的标志[12]。基于对创伤性脑损伤患者的临床观察,纺锤体似乎与皮质可塑性有关[13]。在DOC 患者中也观察到了类似的关系,其睡眠记录显示了纺锤波,保留了意识的迹象,并有更高的恢复机会,在本研究中得到了明确的验证(患者P1、P4)。一些研究人员已经表明,在无意识的患者中也可以观察到纺锤波,但结果是不确定的[14]。本研究3 例患者出现纺锤波(包括第2 次评估时出现),均意识恢复良好;2 例外伤的患者在T0 时无K 波表现,意识水平呈现水平差,T1 时间出现K 波,预后恢复很好。
DOC 患者的脑电活动越接近正常状态,预后越好。DOC患者预后良好的特征性活动包括纺锤波、阶段性觉醒活动和睡眠阶段的保持[15]。睡眠模式的中断和NREM 睡眠时相事件(例如纺锤波)经常在昏迷的早期阶段发现。若人类纺锤体发生器位于丘脑,很容易假设昏迷中纺锤体的缺失是由上升网状丘脑-皮质通路或丘脑-皮质环路的中断造成的。睡眠觉醒周期的缺失似乎与脑干或下丘脑功能障碍有关,初步证据表明这可能与不良结果有关。
值得注意的是,昏迷状态下的连续δ 活动不应被误认为是正常的慢波睡眠,在DOC 患者的睡眠分期中需要进一步明确。睡眠周期被认为是睡眠需要的可靠标志,并且与大脑成熟、学习期间发生的大脑可塑性有关,但也与脑损伤反应有关。慢波活动定义了慢波睡眠,其与睡眠的第三和第四阶段组合有关。当慢波活动占据一个时期的20%以上时,可以标记慢波活动的变化[16]。慢波睡眠和快速眼动睡眠有可能反映受损脑干核团的剩余功能;昼夜节律组织模式提供了下丘脑剩余功能的信息;中缝核头部损毁影响慢波睡眠,尾部损毁主要抑制REM睡眠[17,18]。本研究的患者没有发现明确的睡眠周期,但枕区节律的出现可在一定程度上反映出DOC 患者的意识水平。
综上所述,DOC 患者是否出现枕区α 节律以及是否出现特征性的睡眠脑电成分对意识水平及预后具有一定的提示意义。但本研究为初步性研究,睡眠脑电活动的周期性有待进一步研究,其对DOC 患者的临床治疗节律调节及睡眠意识相关性理解有一定的参考意义。
利益冲突所有作者均声明不存在利益冲突
