针刺调控NLRC5抑制NF-κB通路减轻SAMP8小鼠脑内神经炎症反应的研究*
2021-01-26周雅然张雪竹沈鹏
周雅然 ,张雪竹 ,沈鹏
(1.天津中医药大学第一附属医院针灸部,天津 300381;2.国家中医临床医学研究中心,天津 300381;3.天津中医药大学第一附属医院针灸研究所,天津 300381;4.天津医学高等专科学校,天津 300222)
阿尔茨海默病(AD)是临床常见的神经变性疾病,病因不清,与β-淀粉样蛋白沉积(Aβ)、tau蛋白过度磷酸化、氧化应激损伤、金属离子失调等病理机制有关[1]。
NLRC5是NOD样受体(NLRs)家族成员之一,是新近发现的细胞内模式识别受体,分布广泛,是调控机体的先天免疫和炎症反应的关键分子[2]。研究显示,NLRC5能负调控核转录因子(NF-κB)信号通路活性,通过自身寡聚化抑制NF-κB通路上的NF-κB 抑制蛋白激酶(IκK)复合物磷酸化,从而阻止NF-κB活化,达到抑制炎症反应,维持免疫稳态的作用[3]。目前关于NLRC5的研究,多集中于对机体外周免疫反应的调节,尚无NLRC5参与调节AD脑内神经炎症反应的报道。
“调神益智”针法为石学敏院士根据痴呆患者肾精亏虚,脑髓失养的病机所创立,临床应用该针法能显著改善血管性痴呆患者的认知功能及日常生活能力[4]。该针法对AD模型动物的学习记忆能力也具改善作用[5],且能减轻AD脑内星形胶质细胞活化增殖[6]。活化的星形胶质细胞不仅促进Aβ沉积,还能分泌多种炎症因子和趋化因子形成正反馈级联效应,加剧AD脑内炎症反应[7]。
但目前关于针刺调控AD或快速老化小鼠(SAMP8)脑内炎症的研究较少,也未见与NLRC5相关的研究报道。因此,本研究以SAMP8小鼠及其正常同源抗快速老化小鼠R1(SAMRl)作为对照,通过观察针刺调控NLRC5对NF-κB通路的影响,从神经炎症角度揭示针刺治疗AD的部分机制。
1 材料与方法
1.1 主要试剂及仪器 RNA提取试剂盒、Superscript first strand synthesis system购自Invitrogen公司;SYBR Green real time PCR Master Mix购自TOYOBO公司;DL2000 DNA ladder购自北京天为时代公司;Rnase A(核糖核酸酶A,R-4875)购自Sigma公司;小鼠来源的 NF-кB p65、NLRC5及 HRP标记的Actin单克隆抗体、Western Blotting化学发光试剂购自Santa Cruz公司;兔来源的Phospho-NF-κB p65(Ser536)(93H1)购自 CST 公司。白介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)酶联免疫吸附(ELISA)试剂盒购自德国IBL公司。
荧光定量聚合酶链式反应(PCR)仪(Light Cycler 480,Roche,德国)、酶标仪(Elx800,Bio-Tek,美国)、凝胶成像系统(ChemiDox XRS,Bio-Rad,美国)、凝胶成像分析软件(Quantity One,Bio-Rad,美国)。
1.2 动物造模与分组 选取健康7月龄雄性SAMP8及其同源正常对照小鼠SAMR1,分为SAMR1组、SAMP8组和SAMP8针刺组,每组10只。动物饲养温度(23±2)℃、相对湿度50%~60%的环境中,自动控制光照循环12 h光照/12 h黑暗,每周更换鼠笼垫料1次。自由取食和饮水。动物由天津中医药大学第一附属医院实验动物中心提供(津实动质M准字第006号,清洁级)。
1.3 治疗方法 针刺组采用“调神益智”针法进行治疗,取穴为水沟、内关和三阴交。穴位定位参照中国针灸学会实验针灸研究会制定的《动物针灸穴位图谱》。水沟行雀啄手法10次;内关行捻转泻法30 s;三阴交行捻转补法30 s。每日治疗1次,持续30 d,第7天休息1次。
1.4 Morris水迷宫评价认知功能 采用Morris水迷宫评价动物认知功能,具体方法参考文献[8]。简述如下,Morris水迷宫由圆形水池、圆柱形平台和记录系统3部分组成。水池直径90 cm,高50 cm,池壁及池底涂成黑色。水池注水30 cm,水温为(24±1)℃。随意将水池分为4个象限;将无色透明的平台(直径9 cm,高28 cm)置于任一象限中央,平台表面没于水下1 cm。摄像头置于水池中央的上方约2 m处,采集动物游泳轨迹图像,由图像自动采集和分析系统进行分析处理。
隐蔽平台实验:将平台置于第3象限中央,平台中点距池壁22.5 cm,且位置保持不变。将动物面朝池壁轻轻放入水中,记录小鼠从入水至找到平台的游泳轨迹及时间(逃避潜伏期)等。实验前1 d,让动物在迷宫中自由游泳以熟悉环境,上下午各1次,每次时间为60 s。如果60 s内找不到平台,由实验者将小鼠放到平台上10 s以熟悉环境。正式实验过程中,小鼠如果在60 s内找不到平台也将其放在平台上10 s,并将潜伏期记为60 s。此实验于第1~5天进行,上下午各两次,且入水点随机改变,但同1天内上下午入水点的次序相同。
空间探索实验:此实验于隐蔽实验结束后,撤除平台立即进行。入水点选取第2象限,游泳时间为60 s,记录小鼠在原平台处停留时间以及穿越次数等。
反向实验:将平台置于第1象限中央,平台中点距池壁22.5 cm,其他条件及方法同隐蔽平台实验。此实验于第6~8天进行。
可视平台实验:为排除感觉、视觉或运动功能障碍对空间学习记忆的影响,第9天进行可视平台实验。此时平台高出水面1 cm,并将平台表面包裹成绿色,其余操作同隐蔽平台实验,上下午各1次。
1.5 RT-PCR法测定NF-κBmRNA等的表达 Trizol法提取海马组织中总RNA。将2 μg总RNA逆转录为cDNA。将cDNA加入到含有上下游引物、荧光染料SYBR green的25 μL反应体系中,qRT-PCR法检测其中p65、NLRC5基因相对于管家基因GAPDH的表达情况。引物由上海生工合成,引物序列为:P65,5’-CACCTCAATGGCTACACAGGACCA-3’,5’-ATCTTGAGCTCGGCAGTGTT-3’;NLRC5,5’-CCTGAACGATGACAGCCTGA,5’-AACAGCATGGCTTAGGGACC-3’;GAPDH,5’-AGACAGCCGCATCTTCTTGT-3’,5’-CTTGCCGTGGGTAGAGTCAT-3’。PCR扩增条件为:95 ℃预变性 15 s;95 ℃ 5 s、60 ℃ 20 s、72 ℃ 10 s,40 个循环。反应结束,2-ΔΔCT法分析结果。所有实验重复3次。
1.6 Western Blot测定蛋白表达 RIPA裂解液提取海马组织总蛋白。蛋白样品经10% SDS聚丙烯酰胺凝胶电泳、转印、5%脱脂奶封闭后,分别与总p65(t-p65)、磷酸化 p65(p-p65)、NLRC5(1∶1 000)一抗4℃杂交过夜,后与相应二抗杂交、化学发光显色,采用凝胶图像分析系统分析光密度值。每个样品重复测量 3次,取均值分析。实验以 β-actin(1∶1 000)作为内参照物。
1.7 ELISA 法检测 IL-1β、IL-6、TNF-α水平 治疗结束后,将动物处死,分离动物脑内海马组织。依照ELISA试剂盒说明书,于450nm测定其中IL-1β、IL-6、TNF-α 的含量。
1.8 统计学方法 采用SPSS 23.0统计软件进行分析。所有数据均行正态性及方差齐性检验,结果以均数±标准差(±s)表示,隐蔽平台和反向平台实验的逃避潜伏期比较采用重复测量方差分析,其他数据组间比较采用单因素方差分析,组间多重比较采用 LSD-t检验(方差齐时)/Dunnett’s T3法(方差不齐时),P<0.05 为差异有统计学意义。
2 结果
2.1 针刺对认知功能的影响 对隐蔽平台实验的研究表明,SAMR1组的逃避潜伏期随训练天数增加逐渐降低;SAMP8组的逃避潜伏期虽随时间降低,但明显高于 SAMR1 组(P<0.01);针刺组的逃避潜伏期从第 3天起明显低于 SAMP8 组(P<0.05),但仍高于SAMR1对照组,见表1。从采用的搜索策略比较,第1天各组动物大多以边缘式搜索策略寻找水中平台,少数SAMR1小鼠能以随机式策略发现平台。第3天SAMR1和针刺组多能以趋向式策略找到平台,而SAMP8组的动物中仅部分能以趋向式策略找到平台,其余则多采取边缘式或随机式策略搜索平台。第5天SAMR1组和针刺组小鼠多在相对较短时间内以趋向式找到平台,部分表现为直线式;而SAMP8组则仍多以随机式和趋向式策略寻找平台,见图1。
对空间探索实验的研究表明,与SAMR1组比较,SAMP8组的首次穿越原平台时间明显较长,穿越原平台次数较少,中环区域停留时间百分比较小(P<0.05),说明 SAMP8 的记忆保持能力受损。与SAMP8组比较,针刺组首次穿越原平台时间较短,原平台位置的穿越次数较多,中环区域停留时间百分比较高(P<0.05),提示针刺能提高小鼠的记忆保持能力,见表2。对反向平台实验的研究表明,SAMP8组逃避潜伏期明显高于 SAMR1 组(P<0.05),提示SAMP8存在再学习能力的损伤。针刺组逃避潜伏期明显短于 SAMP8 组(P<0.05),而与 SAMR1 组差异无统计学意义(P>0.05),提示针刺能提高 SAMP8 的再学习能力,见表3。对可视平台实验的研究表明,各组的逃避潜伏期和搜索策略间均差异无统计学意义(P>0.05),提示感觉或运动功能的差异未对其空间学习记忆产生影响。
表1 隐蔽平台实验中逃避潜伏期结果比较(±s)Tab.1 Comparison of escape latencies in the hidden platform trials(±s)s

表1 隐蔽平台实验中逃避潜伏期结果比较(±s)Tab.1 Comparison of escape latencies in the hidden platform trials(±s)s
注:与 SAMR1 组比较,*P<0.05,**P<0.01;与 SAMP8 组比较,#P<0.05。
组别 动物数 第1天 第2天 第3天 第4天 第5天SAMR1 组 10 33.49±12.89 26.20± 5.76 19.17± 4.06 20.62± 5.74 17.48±11.05 SAMP8 组 10 42.87±11.49** 36.71±14.47** 37.76±14.49** 33.62± 6.80** 32.59± 6.76**针刺组 10 36.10± 9.24* 30.14±11.99* 27.17±13.15*# 29.39±12.04* 25.55±18.90*#

图1 隐蔽平台实验中搜索策略的变化Fig.1 Changes in search strategy in the hidden platform trials
表2 空间探索实验结果比较(±s)Tab.2Comparison of the results in the probe trial(±s)

表2 空间探索实验结果比较(±s)Tab.2Comparison of the results in the probe trial(±s)
注:与 SAMR1 组比较,*P<0.05;与 SAMP8 组比较,#P<0.05。
中环区域停留时间百分比(%)SAMR1 组 10 12.80± 9.22 4.16±1.07 49.11± 7.71 SAMP8 组 10 29.94±17.19* 1.62±0.58* 29.70± 5.44*针刺组 10 14.31± 9.05*# 3.31±1.14# 43.50±13.12#组别 动物数 首次穿越原平台时间(s)原平台穿越次数(次)
表3 反向平台实验中逃避潜伏期结果比较(±s)Tab.3 Comparison of escape latencies in the reversal trials(±s)s
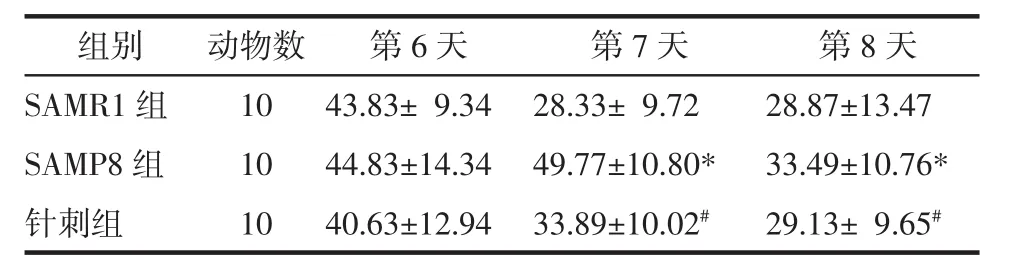
表3 反向平台实验中逃避潜伏期结果比较(±s)Tab.3 Comparison of escape latencies in the reversal trials(±s)s
注:与 SAMR1 组比较,*P<0.05;与 SAMP8 组比较,#P<0.05。
组别 动物数 第6天 第7天 第8天SAMR1 组 10 43.83± 9.34 28.33± 9.72 28.87±13.47 SAMP8 组 10 44.83±14.34 49.77±10.80* 33.49±10.76*针刺组 10 40.63±12.94 33.89±10.02# 29.13± 9.65#
2.2 针刺对脑内NF-κB、NLRC5 mRNA表达的影响 SAMP8海马内p65 mRNA表达较SAMR1明显增高,NLRC5 mRNA表达较SAMR1显著降低(P<0.01);针刺治疗能够明显抑制 p65 mRNA 水平,提高NLRC5 mRNA水平,与SAMP8相比差异有统计学意义(P<0.05),见图 2。
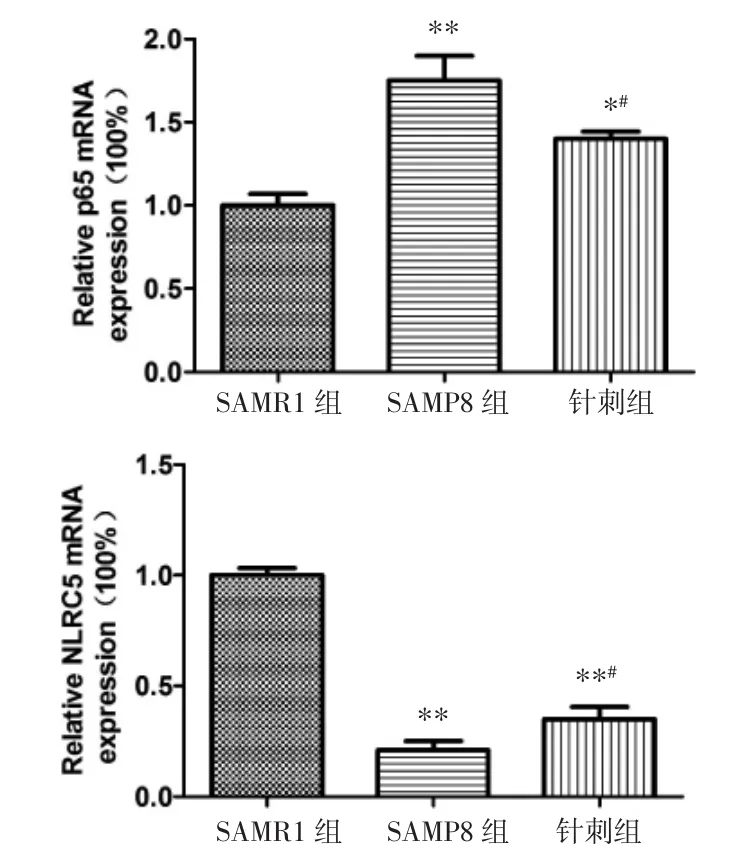
图2 海马内p65和NLRC5 mRNA的表达情况(±s)Fig.2 p65 and NLRC5 mRNA expression level in the hippocampus(±s)
2.3 针刺对NF-κB、NLRC5通路蛋白表达的影响 Western Blot结果表明,各组β-actin表达量差异无统计学意义,提示各组上样量均等。SAMP8海马内 t-p65、p-p65、p-IκK 表达较 SAMR1 升高,NLRC5较SAMR1降低,组间比较差异具有统计学意义(P<0.05)。针刺治疗后,针刺组 t-p65、p-p65、p-IκK表达明显下调,NLRC5表达上调,与SAMP8比较差异具有统计学意义(P<0.05)。见图3。
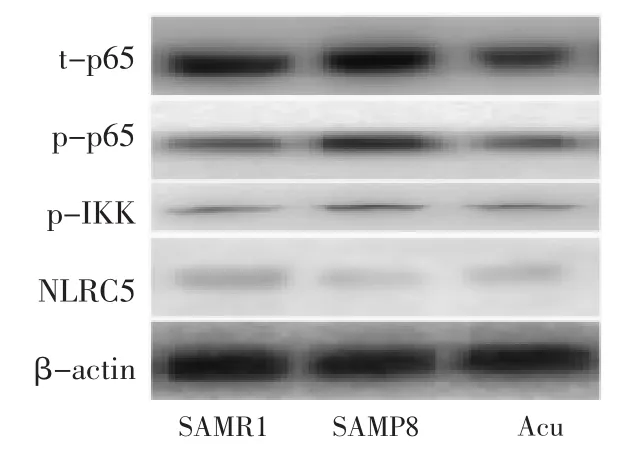
图3 NLRC5、NF-κB通路蛋白的表达情况Fig.3 Expression of NLRC5,NF-κB pathway proteins
2.4 针刺对海马内 IL-1β、IL-6、TNF-α水平的影响 SAMP8 海马内 IL-1β、IL-6、TNF-α 水平较SAMR1显著增高(P<0.05 或 P<0.01);针刺能够降低上述炎症因子水平,特别是IL-6降低明显,与SAMP8相比,差异有统计学意义,并且明显高于SAMR1(P<0.05),见表 4。
表4 海马内 IL-1β、IL-6、TNF-α 水平(±s)Tab.4 IL-1β,IL-6,TNF-α levels in the hippocampus(±s)pg/g

表4 海马内 IL-1β、IL-6、TNF-α 水平(±s)Tab.4 IL-1β,IL-6,TNF-α levels in the hippocampus(±s)pg/g
注:与 SAMR1 组比较,*P<0.05,**P<0.01;与 SAMP8 组比较,#P<0.05。
组别 动物数 IL-1β IL-6 TNF-α SAMR1 组 10 54.18±22.61 296.85± 48.42 64.52±21.36 SAMP8 组 10 88.19±29.38*563.16±150.06**98.41±35.52*针刺组 10 78.29±26.43 469.09± 73.23*#76.66±24.80*
3 讨论
AD是衰老相关疾病。随着衰老,细胞内氧化应激水平增高而蛋白质错误折叠的修复能力下降,均导致蛋白质变性损伤增多,以致Aβ沉积增加。研究显示,Aβ具有强烈的诱导DNA损伤和神经元凋亡的作用[9],Aβ可激活小胶质细胞和星形胶质细胞,并促进其释放IL-1β、IL-6、TNF-α等炎症因子。炎症因子水平增高不仅加速了Aβ沉积[10],还可持续激活NF-κB通路。NF-κB通路的活化可促进多种炎症递质的转录表达,由此造成AD脑内正反馈式的瀑布级联效应,导致慢性持续性神经炎症反应,引起AD渐进性神经损伤[11]。
NLRC5是调控机体的先天免疫和炎症反应的关键分子。NLRC5能负调控NF-κB信号通路活性,通过自身寡聚化抑制NF-κB通路上的IкK复合物磷酸化,从而抑制NF-κB的核移位,从转录水平抑制NF-κB信号通路活性,达到抑制炎症反应,维持免疫稳态的作用[12]。敲除NLRC5基因或减少其表达后,NF-κB 活性相应提高,且 TNF-α、IL-6 和 IL-1β等炎症因子强烈表达[13]。最近的证据表明,NLRC5通过Toll样受体(TLR)信号通路来负调节NF-κB的激活[14]。
临床研究证实,针刺治疗轻中度AD有一定效果,能改善患者的认知功能、日常生活活动能力、神经精神症状和总体功能,特别在日常生活活动能力、神经精神症状和总体功能方面优于临床常用西药安理申,且安全性、耐受性良好[15]。但目前关于针刺调控AD脑内炎症的研究较少,也未见与NLRC5相关的研究报道。有关血管性痴呆的研究表明,针刺可使大鼠海马缺血区p65和IL-1β、TNF-α表达降低,阻滞活化的NF-кB进入细胞核,抑制NF-кB信号通路的传导,减少炎性细胞因子的释放,从而减轻神经细胞的损伤,发挥脑保护作用[16-17]。
石学敏院士根据AD肾精亏虚,脑髓失养的病机,创立“调神益智”针法。其中,水沟居于督脉,督脉为阳脉之海,主一身之阳,与脑关系密切,水沟为督脉与手足阳明经之交会穴,性善启闭开窍,有开窍醒神之功,为调神之要穴;内关为心包经络穴,可清心开窍;三阴交为足厥阴肝经、足太阴脾经、足少阴肾经之交会,有补肾滋阴生髓的功能。3穴合用,可达到补肾填精、调神益智的作用。本研究发现,与SAMR1组比较,SAMP8小鼠学习记忆功能受损,NF-κB 通路中 p-IκK、p-p65表达上升,而 NLRC5表达下降,提示SAMP8认知下降与脑内炎症反应增强有一定相关性。针刺组的水迷宫成绩明显优于SAMP8组,针刺能明显下调NF-κB通路中p-IκK、p-p65的表达,而提高NLRC5表达。提示SAMP8鼠脑内存在NF-κB通路激活现象,针刺能通过提高NLRC5来抑制IκK激酶磷酸化,从而减弱NF-κB的活化,减少炎症因子释放,缓解SAMP8小鼠脑内的炎症反应,从而保护神经细胞,改善SAMP8小鼠认知障碍。
4 小结
SAMP8鼠脑内存在炎症反应激活现象,针刺能通过提高NLRC5来抑制NF-κB的活化,减少炎症因子释放,降低脑内炎症反应,从而改善神经元存活微环境,进而改善SAMP8小鼠的认知障碍。
