中国抗击新型冠状病毒的策略与进展
2021-01-25刘薇关伟杰钟南山
刘薇,关伟杰,钟南山
State Key Laboratory of Respiratory Disease, National Clinical Research Center for Respiratory Disease, Guangzhou Institute of Respiratory Health, The First Affiliated Hospital of Guangzhou Medical University, Guangzhou Medical University, Guangzhou 510120, China
1. 引言
2019年12月出现了由新型冠状病毒SARS-CoV-2引发的新型冠状病毒肺炎(COVID-19)。根据世界卫生组织(WHO)的数据,截至2020年10月3日,已有34 495 176例确诊病例及1 025 729例死亡病例。SARSCoV-2和SARS-CoV的基因序列至少有70%是一致的[1,2]。继SARS-CoV和MERS-CoV之后,SARS-CoV-2是于21世纪造成疫情暴发的第三种冠状病毒。从无症状到致命性感染,该病毒引发了一系列差异化的临床表现[3]。
与其他常见的呼吸道病毒(如流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒)一样,冠状病毒通常引起的是临床表现为普通感冒或轻症肺炎的轻度、自限性上呼吸道感染[4]。截至2019年,在所有已知的冠状病毒中,仅6种会导致人类疾病。其中冠状病毒229E、OC43、NL63、HKU1主要引起轻中度呼吸系统疾病[5]。然而,冠状病毒RNA基因组的遗传多样性、频繁的重组和累积突变,以及人类活动与野生动物交互接触的显著增加,共同提高了产生传染力及毒力更强的病原体的概率。
自COVID-19疫情暴发以来,中国面临着许多由未知性带来的挑战。例如,该疾病的传染性和传播途径、临床表现、免疫应答情况以及可能有效的治疗方案等。如何更好地管理激增的新病例,及时根据预测的疾病发展轨迹对患者进行分诊,采取合适的治疗方案改善临床结局,是政府和医疗机构的核心任务。中国在抗击新冠肺炎斗争中,坚持“生命至上”的原则,迅速采取了非药物干预措施,并在阐明其传播途径及临床特点、发展新型治疗干预措施以及疫苗研发等方面发挥了关键作用。本文总结了中国在不同领域所采用的战“疫”策略,以期提高对未来疫情暴发的防控能力,也为全球疫情防治提供经验。
2. 中国抗击COVID-19 的策略概述
自2003年SARS流行以来,中国建立了较完备的流行病监测系统,这为中国迅速识别首例“不明原因肺炎”病例奠定了基础[6,7]。在短短一个月内,中国政府宣布该流行病为“重大突发公共卫生事件”。计算机断层扫描(CT)图像显示的斑片状阴影和磨玻璃阴影以及重症患者的“白肺”表现等情况[8]似曾相识,这引发了中国社会基于17年前SARS大流行时的恐慌。
传播途径和传染源的鉴别直接影响着全国范围内控制疫情发展的非药物性干预措施的制订[9,10]。在武汉,大多数病例都有近期去往海鲜批发市场或与海鲜批发市场人员接触的经历。当发现出现感染的医护人员、散发病例不存在海鲜批发市场接触史这一情况时,中国政府迅速声明该病存在人传人的可能性,并通过众多社交媒体平台向社会预警。中国政府准确锁定武汉市(而非其他城市)为中国境内疫源区并采取了前所未有的防控措施:封锁武汉及其周边城市,从而迅速控制感染病例的大规模外流,限制并阻断其他人员向疫源区流动[9]。为更迅速地控制疫情,非政府组织也被迅速动员起来监测和追踪相关流动人口行程轨迹。
为了更有效地管理激增的轻中度病例,中国在大型公共场所建造了临时医院(方舱医院),这些医院拥有13 000余张病床,以便确诊病例的隔离、治疗和监控,以及缓解医疗用品短缺压力。方舱医院建造成本低,可帮助降低家庭和社区传播风险,缓解定点医院的床位压力并及时分诊重症患者。为了将传播风险降到最低,中国要求有密切接触史的人群,即使无症状且病毒PCR检测为阴性,仍需在家中进行隔离。这些措施非常有效地遏制了累计病例数的持续上升。但是,中国仍面临着输入病例造成的局部地区疫情相继暴发的挑战,尤其是北京、新疆、大连和香港等人口流动性较大的地区。
3. SARS-CoV-2 的感染机制
SARS-CoV-2最早是从集中发现的一组具有发热、咳嗽、呼吸困难等症状的患者的样本中分离并鉴定出来的。这些患者的胸部CT影像呈磨玻璃样改变[6]。基于靶向panβ冠状病毒RNA依赖的RNA聚合酶(RdRp)结构共有序列的逆转录聚合酶链反应(RT-PCR)技术与高通量测序技术,证实该病原体是一种新型的β冠状病毒[7]。电子显微镜下观察到该病毒外观形似日冕,与冠状病毒科的病毒形态相一致[7]。
SARS-CoV-2的自然宿主极可能是蝙蝠,因为它与一种蝙蝠中的SARS样冠状病毒(BatCoV RaTG13)高度同源,二者基因组序列相似度达96%[11,12]。SARSCoV-2的出现可能是某冠状病毒基因组中突变的累积,促使病毒跨越动物与人之间传播的物种屏障。但是,从动物到人的传播途径不是导致COVID-19大流行的主要方式。
SARS-CoV-2识别受体和进入细胞的机制与SARSCoV类似。该病毒通过其病毒颗粒表面的刺突蛋白(表面S蛋白)识别并结合于细胞表面受体血管紧张素转化酶2(ACE2)从而进入靶细胞。靶细胞膜上的跨膜丝氨酸蛋白酶,如FURIN(弗林蛋白酶)和TMPRSS2(跨膜丝氨酸蛋白酶2),可诱导S蛋白裂解并促使病毒包膜与细胞膜融合而介导病毒进入细胞[13]。因此,同时表达血管紧张素转化酶2(ACE2)和丝氨酸蛋白酶的细胞可能是SARS-CoV-2直接攻击的对象。单细胞RNA测序研究发现ACE2和TMPRSS2在多种细胞上广泛表达,包括II型肺泡上皮细胞、鼻黏膜杯状细胞、胆管上皮细胞、结肠上皮细胞、食管角质形成细胞、胃肠道上皮细胞、胰岛β细胞、肾近端小管上皮细胞和足细胞等[14]。临床上也观察到了呼吸系统以外的症状,其中涉及血液系统、心血管系统、肾脏、胃肠道、肝胆、内分泌和神经系统,以及眼科和皮肤科[14]。这些发现可以用于解释由于病毒直接攻击人体组织而引起的多器官感染和损伤。
SARS-CoV-2主要通过直接攻击人体组织、损伤内皮细胞并促使血栓形成、诱导免疫失调及肾素-血管紧张素-醛固酮系统功能紊乱等途径攻击宿主[15]。COVID-19感染时常伴随强烈的炎症反应,即释放大量促炎细胞因子,形成细胞因子风暴[16,17]。发展成肺炎的COVID-19患者的血浆中,促炎细胞因子浓度显著升高,其中包括白介素-1β(IL-1β)、白介素-1受体拮抗剂(IL-1RA)、IL-7、IL-8、IL-9、IL-10、成纤维细胞生长因子、粒细胞集落刺激因子(G-CSF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、干扰素-γ(IFN-γ)、干扰素诱导蛋白-10(IP -10)、单核细胞趋化蛋白-1(MCP-1)、巨噬细胞炎性蛋白-1α(MIP-1α)、巨噬细胞炎性蛋白-1β(MIP-1β)、血小板源性生长因子(PDGF)、肿瘤坏死因子-α(TNF-α)和血管内皮生长因子(VEGF)[18]。与轻症病例相比,重症病例通常伴随着IL-2、IL-7、IL-10、G-CSF、IP10、MCP-1、MIP-1α和TNF-α的血浆浓度的显著升高。这些促炎因子促使免疫细胞(如巨噬细胞、嗜中性粒细胞和T淋巴细胞)向感染部位聚集,导致内皮细胞间连接的不稳定性以及血管通透性的改变,同时造成弥漫性肺泡损伤,最终导致患者多器官衰竭和死亡。
ACE2是决定病毒传播的关键环节。与SARS-CoV相比,SARS-CoV-2的S蛋白受体结合结构域与ACE2的结合能力提高了10~20倍[19,20],这可能是SARSCoV-2传播能力更强的原因之一[21]。SARS-CoV-2的感染能力从呼吸道近端到远端逐渐降低,这与ACE2从口咽部到肺泡表达量逐渐减少的情况相吻合[22]。SARSCoV-2的感染方式可能是先从鼻腔开始,然后随气流沿呼吸道至肺部,而不是直接引起肺部感染。更有可能的感染方式是:大量病毒从最初受感染的呼吸道排出后,随黏液分泌物积累在口咽腔中,最终高浓度的病毒随呼吸气流到达气管、支气管,从而造成肺部感染[23]。
分子动力学模拟实验推测,与其他冠状病毒相比,SARS-CoV-2与ACE2有独特的结合界面,亲和力更强,并形成独特的残基结合网络[2]。与SARS-CoV相比,SARS-CoV-2有更多的保守残基参与受体结合,并且可与ACE2形成更大的接触面积。与低致病性的冠状病毒不同,SARS-CoV-2核衣壳蛋白有更强的核定位信号,其表面S蛋白有独特的插入突变,这些都可能与该病毒的高病死率相关[24]。
SARS-CoV-2可以通过突变演化出具有不同毒力和传染力的分枝[25]。多项研究论述了一个突变株,其S蛋白中的第614位密码子处的甘氨酸(G)被天冬氨酸(D)取代[25–28]。该突变(D614G)位于S蛋白的B细胞抗原表位,这是受体结合结构域的高度免疫优势区。体外研究发现D614G突变的假病毒的感染性是D614毒株的9倍[29]。自2019年12月以来,发生D614G突变的SARS-CoV-2开始流行,并且在一些欧洲国家(如荷兰、瑞士和法国)更为常见,但该毒株在中国却并非常见。SARS-CoV-2病毒发生D614G突变可能是导致欧洲人群出现致命性感染的原因之一[27]。根据对来自68个国家的感染者的10 022个SARS-CoV-2基因组进行测序分析发现,其中有6294个样本带有D614G突变;几乎所有携带D614G突变的基因组中都存在共突变,且共突变通常发生在调控病毒复制的蛋白相应的基因(ORF1ab P4715L; RdRp P323L)上,这可能会影响病毒的复制速度[28]。据预测,D614G突变可能导致S蛋白的空间构象发生微调,造成该病毒免疫原性(被B淋巴细胞识别的特性)的丧失。而B淋巴细胞介导的适应性免疫应答恰是人体抗SARS-CoV-2感染的主要途径。
4.传播途径
目前认为SARS-CoV-2的传播主要依赖于接触含有病毒的飞沫和排泄物。患者的多种液体样本中都存在病毒RNA,其中包括支气管肺泡灌洗液、痰液、鼻拭子、咽拭子、粪便、血液和尿液[30],这些发现提示着可能存在多种传播途径。目前已从粪便和尿液样本中分离出来了具有感染性的SARS-CoV-2病毒颗粒。与以上发现相一致的是,SARS-CoV-2可有效感染人肠道上皮细胞[31–34],导致20%~50%的患者出现明显的胃肠道症状,包括腹痛和腹泻[35–37]。患者发病后的17~28天粪便中的病毒载量明显高于呼吸道,而在此之后仅可检测到病毒RNA片段而非具有感染性的活病毒[38]。在腹泻发作期间,粪便中更易检测到具有感染性的活病毒[37]。此外,尿液中也分离出了该病毒。鉴于这些研究发现,我们应当采取适当的预防措施以避免接触传播的发生。
5.实验室诊断的进展
疾病流行早期急需建立快速诊断的方法以应对基于社区的大规模筛查和患者病情发展的持续监测。在COVID-19流行的早期阶段,诊断往往基于症状和胸部影像学表现。多数COVID-19患者的CT表现为斑片状磨玻璃阴影。但是,17.9%的非重症患者及2.9%的重症患者入院时未见影像学异常[39]。
RT-PCR已广泛用于SARS-CoV-2的RNA片段检测,同时也被推荐用于诊断SARS-CoV-2急性感染。但假阴性结果造成的漏诊可能对整个社会造成危害[40]。造成假阴性的原因可能与检测标本中病毒载量过低有关,也可能是因为SARS-CoV-2的NP和ORF基因发生突变 [41]。
血清学检测是诊断COVID-19的另一常用方法[42–44]。准确的血清学检测可辅助对个体暴露于病毒后感染过程的理解,尤其是对无症状感染者感染过程的监测。症状出现后抗体滴度逐渐升高(通常在第7至第10天达到峰值),因此抗N蛋白和抗S蛋白的特异性IgM和IgG可用于SARS-CoV-2感染的检测。抗N蛋白和抗S蛋白IgM和IgG的联合检测可以提高早期感染的检出率。发病一周内,联合检测抗N蛋白、抗S蛋白的IgM和IgG可使阳性检出率提升至75%[45]。第二周内,联合检测抗N-IgM和抗N-IgG或抗N-IgG和抗S-IgG的阳性检出率可达94.7%[45]。第三周,非重症监护病房(即非ICU)患者的抗S-IgG滴度明显高于ICU患者[45]。此外,ICU患者中抗N-IgG滴度明显更高,而中度症状患者抗S-IgG滴度更高。这些发现将有助于预后评估[46]。
为加快COVID-19的临床诊断检测速度(特别是群体检测和床旁检测),基于CRISPR/Cas系统(CRISPR即成簇的规律间隔的短回文重复序列,Cas即CRISPR关联基因)的检测方法因其快速、精准、操作简便的特点而被开发用于SARS-CoV-2的诊断。CRISPR/Cas系统本身是在古细菌和细菌中发现的用于抵抗外来遗传物质入侵的适应性免疫防御系统[47,48]。该系统中的基因编辑蛋白可在向导RNA的协助下结合于靶基因并实现对靶序列的切割[47,49–51]。目前CRISPR/Cas12a系统被改造用于COVID-19检测。该体系中含有靶向SARSCoV-2中orf1a、orf1b、N和E基因的CRISPR RNA(crRNA)和携带可淬灭的绿色荧光标记的单链DNA报告基因[48]。当存在SARS-CoV-2序列时,即使含量极少,也可实现绿色荧光标签断裂并发光,且发光情况肉眼可见并不依赖仪器设备。该检测技术可实现逆转录和等温扩增,同时在低温下进行,反应全程均不依赖于实验室仪器,因此有很大的应用前景。
6. COVID-19 的临床特点
鉴于对COVID-19的临床表现缺乏了解,防治目标不明确,归纳总结首批41例武汉病例的临床特点是必要的[52]。为观察全国范围内的总体发病情况,另有一项研究分析了来自中国大陆552家医院的1099例实验室确诊病例的临床特点[39]。患者入院时最常见的症状是发热和咳嗽,而恶心、呕吐和腹泻等胃肠道症状较少见(<5%);中位潜伏期为4天(四分位数间距:2~7天);该研究中病死率为1.4%,与截至2020年2月16日的中国官方统计数字相近[39]。但是,由于早期感染者的数目不确定,因此无法得出更为精准的病死率。重要的是,约半数患者入院时并未出现发热症状,这提示发热不能成为COVID-19人群筛查的唯一标准。此外淋巴细胞减少症是重症患者中十分常见的且更为突出的表现。因此临床上尝试针对淋巴细胞减少症进行治疗并观察其对于治疗COVID-19是否有效。此外,儿童对COVID-19没有免疫力,大多数患儿都有近期家族感染史[53,54]。
在SARS和MERS中,疾病的严重程度和进程与多种合并症有关[55–57]。相似的是,患有糖尿病、慢性阻塞性肺疾病(COPD)、心血管疾病(CVD)、高血压、恶性肿瘤或其他合并症的COVID-19患者的死亡率明显更高。在合并有糖尿病、COPD和CVD的COVID-19患者中,可观察到与易感性升高相关的ACE2表达水平升高[58]。高血压患者在治疗过程中也可能因使用大剂量血管紧张素转化酶抑制剂(ACEI)和血管紧张素受体拮抗剂(ARB)类药物而引起ACE2表达增加。但是目前没有证据表明应用ACEI或ARB会加重COVID-19病情[59–62]。此外,癌症患者由于处于免疫抑制状态而更易感[63]。且癌症患者的ICU入住率、有创呼吸机使用概率以及死亡概率都更大[63,64]。因此,为使不良结局风险高的患者得到密切监测,应根据患者合并症的有无及种类进行分诊。同时,为了降低医院感染风险,应推迟对处于临床稳定期的癌症患者的放射治疗和化学药物治疗。
在不同国家,COVID-19的消化系统症状的发生率差异很大。最近一项对主要来自中国的29项研究进行的荟萃分析显示,有21%的患者有厌食症状,7%的患者有恶心和(或)呕吐症状,9%的患者有腹泻症状,3%的患者有腹痛症状。然而,在美国进行的一项研究显示其患者的症状与占比分别是:厌食(34.8%)、腹泻(33.7%)、恶心(26.4%);与中国相比,这些消化系统症状在美国患者中更为常见[14]。
值得注意的是,有一小部分患者在整个病程中始终无症状[65]。若症状不典型患者核酸检测呈阳性,则有必要对其密切接触者进行追踪[66,67]。在第一例无症状感染者的报道中,患者为一名有家族感染史的儿童,且有相应CT表现。进一步的研究表明,在核酸检测阳性的病例中无症状感染者占到了20%~78%[66,68]。在中国,于2020年4月1日确诊的166例新发病例中,有130例(78%)为无症状感染者。与有症状的感染者不同的是,嗅觉减退和鼻塞症状在无症状感染者中很常见;不论他们的CT结果是否有阳性发现,RT-PCR可鉴别患者是否被SARS-CoV-2感染。无症状感染者在发病前排毒现象明显,具有传染性;与有症状者相比,这类人群的排毒期可能更长[69,70]。但是,无症状感染者表现各异,因为有些患者可能正处于疾病的早期阶段,有些患者可能在整个病程中都没有出现症状。
7. 危重症患者的预后预测
在许多患者中,COVID-19病情发展迅速。在一项对1099例患者的统计中,其总体病死率为1.4%[39];而根据中国疾病预防控制中心的数据,对72 314例患者的统计分析发现危重症患者的病死率高达49%[71]。早期识别可能发展成为危重症的高危患者将有助于早期分诊、及时开展临床治疗以及更合理地匹配医疗资源[72]。在疫情暴发的最初几个月,中国面临的整体问题是如何从每日上千名的确诊病例中尽快识别出可能发展成危重症的患者。然而在疫情初期,中国还没有这种预测工具。
为了解决这个紧急问题,基于来自31个省级行政区的575家医院的1590名COVID-19患者的回顾性队列研究被纳入预测风险评分系统的构建,用于推测COVID-19住院患者的病情是否有发展为危重症的倾向性。通过使用最小绝对收缩和选择算子(LASSO)算法,筛选出了19个常见临床变量用于危重症预测[包括临床特点和血常规结果,如胸片(CXR)异常、年龄、武汉旅居史、首次最高体温、呼吸频率、收缩压、咯血、呼吸困难、皮疹、意识丧失、合并症数量、COPD史、肿瘤病史、血氧饱和度、中性粒细胞、中性粒细胞与淋巴细胞之比、乳酸脱氢酶、直接胆红素和肌酐水平][72]。在此基础上,通过引入人工智能(AI)系统,利用深度学习的生存模型,进一步创建了在线计算工具。该计算工具可将COVID-19患者从其他常见肺炎患者中分选出来[73]。
另一种基于CT的AI系统可用于帮助患者早期分诊、疾病监测和治疗,并为纵向随访提供数据[74]。由于CT可以提供更详细的病理学信息,且能更好地定量评估病变的大小以及肺部受累的程度或严重程度,因此,尤其是在床旁检测时,它可能是首选检查方法。其次,特别是在医疗系统超负荷运行的情况下,CT的快速周转时间和AI系统的应用,可以显著缩短从临床检查到分诊的时间,加快患者早期分诊[75,76]。
血液学和免疫学生物标志物的动态变化也可以提示COVID-19的严重程度,用于推测临床结局[77]。外周血淋巴细胞、嗜酸性粒细胞和血小板计数可作为疾病恢复的预测指标。嗜中性粒细胞、嗜碱性粒细胞和IL-6水平的逐渐升高与死亡结局相关[18]。不论最初就诊时疾病的严重程度如何,死亡患者的淋巴细胞绝对值始终显著低于幸存者。此外,死亡患者有更高水平的中性粒细胞计数、IL-6、降钙素原、D-二聚体、淀粉样蛋白A和C反应蛋白。同时死亡结局也与明显的淋巴细胞减少有关。重症患者的血小板计数明显降低,而死亡患者的血小板计数甚至更低。这些发现为实施针对恢复炎症细胞正常计数和炎症介质的治疗性干预措施提供了科学依据。
8. 临床治疗进展
与SARS和MERS的感染类似,目前还没有有效的抗COVID-19的治疗方法。因此,目前推荐的治疗干预措施(包括支持性治疗)都是基于已发布的指南或专家共识[78]。大多数治疗用药是参考SARS或MERS暴发期间采取的方案。表1汇总了中国大陆COVID-19临床试验的主要研究结果。但是,在COVID-19暴发初期,几乎没有临床试验可提示哪种药物治疗COVID-19最有效,以及是否存在针对COVID-19的靶向治疗。
病毒感染(包括病毒性脓毒症)[79]仍然是COVID-19发病机制中的关键因素,这迫使人们开展并探索抗病毒药物尤其是对重症或危重症患者的疗效的研究。在体外[80,81]和体内实验[82–84]中,洛匹那韦/利托那韦、瑞德西韦和氯喹等药物被尝试用于抗SARSCoV-2感染[这些药物也曾用于治疗埃博拉(Ebola)病毒或人类免疫缺陷病毒(HIV)感染]。在中国疫情早期阶段进行的一项随机临床试验中,重症COVID-19患者被分到单一接受标准化治疗的对照组,或联合使用14天的洛匹那韦/利托那韦治疗的治疗组[82]。结果显示,治疗组和对照组的临床改善时间(即从随机分组开始至临床症状改善的时间)以及死亡率均无显著差异。随后,在另一项双盲临床试验中,重症COVID-19患者被随机分到仅接受标准化治疗的对照组,或同时接受10天的瑞德西韦治疗的治疗组[81]。结果再次表明,对照组和治疗组的临床改善时间没有显著差异;临床改善时间是该临床试验的主要终点。正如在两项试验中动态监测的那样,洛匹那韦/利托那韦或瑞德西韦均未显著降低病毒载量。这些阴性结果可能与多种因素有关。值得注意的是,进入临床试验的患者已有平均11~13天的发病时长,相较于更早期用药,疗效可能有所降低。实际上,洛匹那韦/利托那韦的早期用药(即在发病10天之内)与缩短排毒时间有关[83]。此外,由于疫情暴发的突然且患者招募过早停止(当武汉市的流行病学曲线趋于平坦时很难继续招募患者),这些临床研究的统计分析可能受到了影响。不过,这些研究结果并不能排除洛匹那韦/利托那韦或瑞德西韦用于治疗重症COVID-19患者是有效的。临床研究均表明治疗组具有更短的临床改善时间[82,85]。随后临床研究表明接受10天瑞德西韦治疗组较安慰剂组临床改善时间更短且14天死亡率更低[86]。此外,与只进行常规治疗相比,洛匹那韦/利托那韦联合IFN-β和利巴韦林治疗可显著降低病毒载量[87]。因此,联合使用抗病毒药物治疗可能会加速COVID-19患者的病毒清除。其他几种治疗COVID-19的候选药物也正在临床试验阶段。其中氯喹和羟氯喹的疗效仍存在争议。尽管氯喹有效降低了住院患者的病毒载量并实现了病毒检测转阴[88],但在轻中度患者中使用羟氯喹未能提高28天病毒转阴率[84]。在一项初步开放研究中,与洛匹那韦/利托那韦联合IFN-α雾化吸入治疗相比,法匹拉韦能显著缩短病毒清除时间,并提高胸部影像改善率[89]。这一发现为使用强效抗病毒候选药物提供了科学依据。
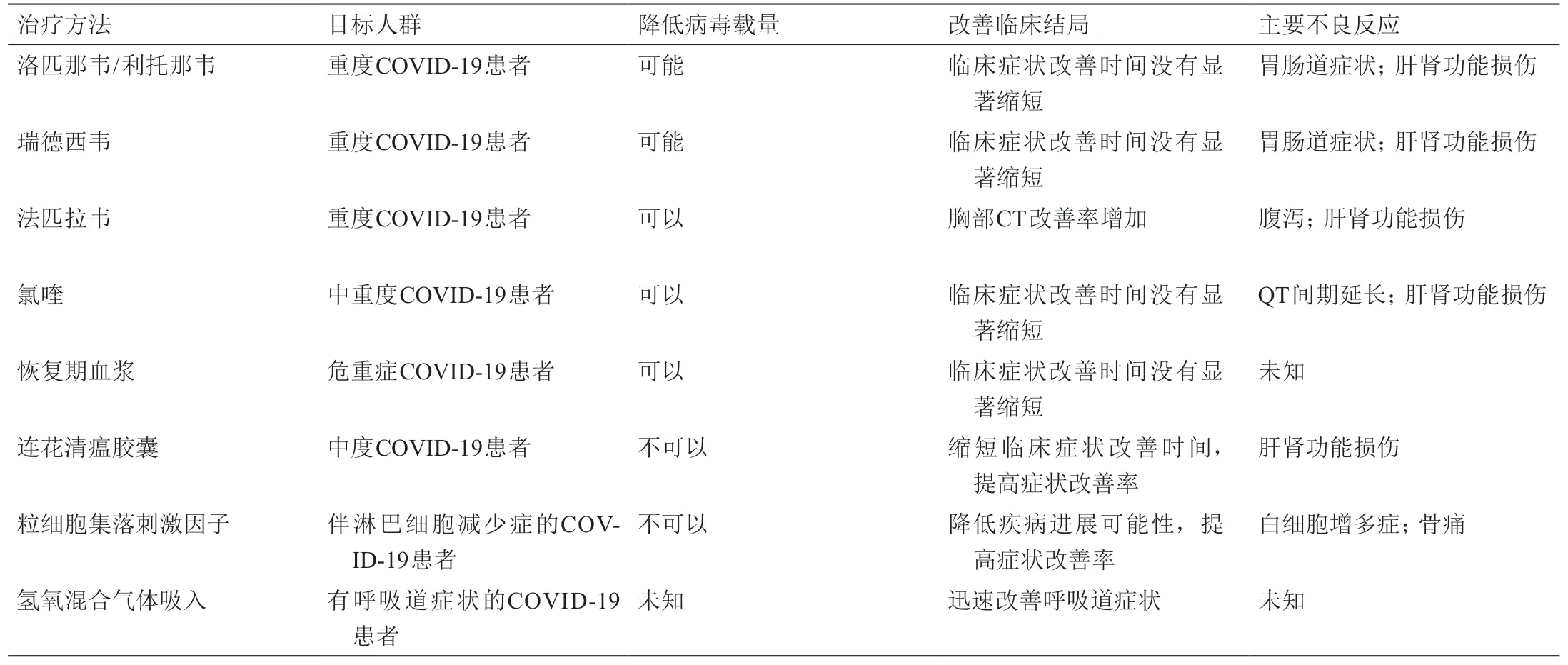
表1 中国大陆COVID-19临床试验的主要研究结果
除了过度的炎症反应和病毒感染外,异常的免疫应答也是导致不良临床结局的典型病理生理改变。高达80%的COVID-19患者合并淋巴细胞减少症,这一症状与死亡风险显著相关[39,90]。使用人重组粒细胞集落刺激因子(rhG-CSF)可以动员淋巴细胞向外周血迁移,这可能是一种对合并淋巴细胞减少症患者有效的治疗方法。最近的一项随机临床试验显示,与只采取常规治疗相比,rhG-CSF治疗尽管未能缩短临床改善时间,但它显著提高了CD8+T细胞和自然杀伤(NK)细胞计数,并且降低了患者发展为危重症或死亡的风险[91]。特别是在外周血淋巴细胞计数低于400个·mL−1的患者中,它的效果更加明显。但仍需对rhG-CSF的作用机制进行进一步研究。
皮质类固醇具有显著的抗炎作用,可以减轻炎症介导的肺损伤,从而防止患者呼吸衰竭或死亡。一项观察性研究表明,使用甲泼尼龙可显著降低伴有急性呼吸窘迫综合征的COVID-19患者的死亡风险[92]。与这些发现一致的是,最近一项对住院患者的临床试验表明,与接受有创机械通气或非有创机械通气吸氧治疗的对照组相比,口服或静脉注射地塞米松(6 mg·d−1)10天以上可以显著降低28天死亡率[93]。发病后治疗7天以上,即便肺炎症性损伤更为明显的患者也同样可以获益。但是,对于没有接受任何呼吸支持治疗的患者,地塞米松并没有显著效果,这也与最近的一项荟萃分析的结果一致[94]。
在危重症COVID-19患者中,靶向治疗的运用非常有限。鉴于治疗SARS和MERS患者的经验,恢复期血浆被尝试用于治疗危重症患者。一项对5名患者进行的单臂试验表明,具有高滴度中和抗体的恢复期血浆可以改善总体临床状况[95]。一项随机临床试验显示,在常规治疗基础上加上恢复期血浆治疗的临床疗效在28天时没有改善[69]。然而,尽管恢复期血浆的应用在统计学上没有显著差异,且对垂危患者的疗效不突出,但在重症患者却能观察到疗效[96]。由于在疫情后期难以招募足够患者,该研究入组人数较少,因此不能直接否定恢复期血浆的疗效。
几项在中国的研究发现,大多数死亡患者都存在弥散性血管内凝血(DIC)[97,98]。D-二聚体和其他纤维蛋白降解产物水平明显升高,凝血酶原时间延长,提示不良预后可能与凝血功能障碍有关[99]。D-二聚体水平的动态变化与COVID-19不良预后呈正相关[98]。脓毒症诱导的凝血病评分大于或等于4分,或D-二聚体水平大于正常值上限6倍的患者,在接受低分子肝素治疗7天及以上后,其死亡率更低[100]。当给予抗凝治疗时,应密切监测患者。使用华法林后可能发生致命性并发症,如弥漫性肺泡出血[101]。
非药物性干预可在COVID-19临床治疗中发挥一定作用。由于气道阻力增加,部分COVID-19患者出现了呼吸困难症状。氦氧混合气体由于其相对分子质量较小,已用于缓解呼吸衰竭[102]和慢性阻塞性肺疾病[103]患者出现的呼吸困难症状。但是,由于成本效益比低,氦氧混合气体尚未在临床实践中得到广泛应用。而氢氧混合气体(H2-O2)可以通过在售的仪器直接电解水而产生,且方便在家中使用[104]。最近有研究显示吸入H2-O2可以明显缓解伴有中央气道狭窄患者出现的呼吸困难症状[104]。明确吸入H2-O2能否有效改善有症状的COVID-19患者的临床表现是十分必要的。在一项开放标签的多中心临床试验中发现,吸入H2-O2可以迅速且显著地缓解主要呼吸道症状(包括呼吸困难、胸痛和咳嗽),提高研究开始时伴有呼吸困难症状的COVID-19患者的静息血氧饱和度,同时也能降低此类患者的病情严重程度[105]。基于这些发现,H2-O2吸入治疗被国家卫生健康委员会(以下简称卫健委)纳入伴有呼吸困难的COVID-19患者的治疗或推荐在氧气设备供应缺乏地区的患者中使用[106]。
传统中药一直是药物备选库。一系列中药方剂被摸索用于SARS和流感治疗。例如,连花清瘟(LH)胶囊已被批准用于治疗轻中度SARS患者[107,108]。因此,LH胶囊被优先研究用于COVID-19治疗,与其他正在研发的候选药物相比,超说明书使用的在售药物的研发时间(R&D)更短。体外研究发现LH胶囊具有抑制SARS-CoV-2的作用[109]。多中心随机临床试验比较了在单独常规治疗基础上加用LH胶囊的疗效[110]。治疗14天后,尽管未观察到病毒载量的显著差异,但患者治愈率显著提高,临床恢复时间也显著缩短。由于患者的血药浓度明显低于体外病毒抑制浓度,因此LH胶囊所表现的治疗效果可能与直接抗病毒作用无关[109]。体外研究发现LH胶囊可能通过抑制细胞因子的释放发挥抗炎和抗氧化作用[110]。LH胶囊已获得卫健委的批准用于轻中度的COVID-19患者的治疗[106]。除LH胶囊外,其他中药方剂如血必净注射液和六神胶囊也显示出抗SARS-CoV-2活性[111,112]。目前正在开展多中心临床试验,以证实这些中药方剂(如血必净注射液用于COVID-19重症或危重症患者)的疗效。
9. 疫苗研发
尽管全球为此次疫情的防控及疾病治疗做出了巨大努力,但目前尚没有针对性的有效措施。由于疫情传播迅速以及人体在感染后相应抗体滴度下降较快[113],研发安全有效且能诱导强烈的抗SARS-CoV-2的免疫反应的疫苗以实现COVID-19的全球控制是十分必要的。
疫苗研发得益于SARS-CoV-2全基因组序列的早期公布。根据世界卫生组织的数据,截至2020年9月3日,共有33款候选疫苗处于临床研发的不同阶段,其中6款正处于III期临床试验阶段[114]。2020年7月22日,由科兴生物制药股份有限公司(Sinovac Biotech)开发的两款COVID-19灭活疫苗于中国获批[115]。俄罗斯行政办公室于2020年8月10日批准了另一种腺病毒载体疫苗。美国当局最近也宣布将于今年年底批准使用某种疫苗。
在COVID-19大流行等突发公共卫生事件中,监管机构应迅速采取行动,通过提高监管的灵活性来加快疫苗研发。为指导疫苗加快研发和审批,自2020年3月起,中国监管机构和国家药品监督管理局(NMPA)陆续发布了7份指导意见来提供路线图并作出要求[116]。此外,NMPA还起草了一项特定方案以使审查和研发同步。因此,疫苗可及时进入临床,以避免重大延误。例如,NMPA仅在24小时内就完成了中国医药集团总公司关于COVID-19疫苗的审查,而既往惯例需要60天。迄今为止,中国已有10款COVID-19候选疫苗进入临床试验阶段[114,117–123],其中有4款已进入国际III期临床试验。此外,超过21个临床前研究项目有望进入临床试验阶段。
当前研发的新冠疫苗可大致分为两类:一类是基于病毒(灭活/减毒)的疫苗;另一类是基于重组蛋白[亚单位/病毒样颗粒(VLP)]的疫苗[120,121,124,125]。目前4款“灭活病毒疫苗”处于II期临床试验后期,其中两款已被批准用于紧急治疗。基于此前对肠道71型病毒灭活疫苗和脊髓灰质炎病毒灭活疫苗的研发经验,中国在针对此次疫情的“灭活病毒疫苗”研发上取得了重大成果。此外,一款基于复制缺陷的5型人类腺病毒的COVD-19疫苗编码了SARS-CoV-2的S蛋白,同时作为一种亚单位疫苗,可通过单剂量肌内注射或滴鼻接种成功诱导细胞免疫应答。该疫苗可以有效预防上、下呼吸道的SARS-CoV-2感染[126]。此外,与肌内注射相比,黏膜接种可能在阻断病毒在上呼吸道复制方面更为有效。

表2 中国大陆防控COVID-19的进展及干预措施总结
10. 结语
COVID-19大流行为全球带来了前所未有的威胁,不仅导致了高发病率及高死亡率,也极大地破坏了正常社会经济活动。基于抗击SARS和MERS的经验,中国迅速采取了有效措施,遏制了病例的激增,并最终控制了这次疫情(表2)。早发现、早隔离、早治疗和早预防的原则是有效控制这一全球疫情大流行的关键。
致谢
特别感谢彭涛、赵金存、杨子峰、宋健、周君侯等为本稿付出的努力,包括资料收集和修改等工作。项目由国家自然科学基金(81761128014)和国家重点研发计划(2020YFC0842400)资助。
Compliance with ethics guidelines
Wei Liu, Wei-Jie Guan, and Nan-Shan Zhong declare that they have no conflict of interest or financial conflicts to disclose.
