利拉鲁肽对糖尿病小鼠肝糖异生关键酶PEPCK 及G6pase 的表达影响及机制探讨
2021-01-25杜国慧刘博伟尹福在齐曦明范冬梅
杜国慧刘博伟尹福在齐曦明范冬梅
(1.承德医学院,河北承德 067000; 2.河北省秦皇岛市第一医院内分泌二科,河北 秦皇岛 066000;3.河北省秦皇岛市第一医院中心实验室,河北秦皇岛 066000)
糖尿病作为慢性代谢性疾病,随其发病率的飙升[1],已越来越受人们的关注,其发病病理生理机制主要表现在胰岛素的缺乏和胰岛素抵抗两个方面。 其中肝的胰岛素抵抗与2 型糖尿病的发生发展息息相关,肝糖代谢的紊乱主要通过肝糖原合成及糖异生来影响葡萄糖代谢。 CUL4a—DDB1 连接酶复合物是一类E3 泛素连接酶复合物,可以通过对底物进行泛素化修饰,从而改变蛋白功能或促进被修饰蛋白的降解,DNA 损伤结合蛋白1(DDB1)是DDB1- cul4a 连接酶复合物的支架组分[2-4]。
本课题旨在探讨GLP-1 受体激动剂利拉鲁肽对糖尿病小鼠肝E3 泛素蛋白酶DDB1 及肝糖异生的影响及可能的机制,为 GLP-1 受体激动剂在T2DM 等代谢性疾病治疗中的应用提供理论依据。
1 材料和方法
1.1 实验动物
SPF 级,雄性 KK-Ay 糖尿病小鼠 10 只,11 ~ 12周,体重为33~35 g;SPF 级,雄性 C57 小鼠 5 只 11~12 周,体重为26~28 g,均购自北京华阜康生物科技股份有限公司[SCXK(京)2019-0008],实验在天津南开大学医学部免疫实验组[SYXK(津)2017-00005]进行。 实验经天津南开大学伦理管理委员会审核(201907-001),对实验小鼠在实验过程中的所有处置均按国家《实验动物管理条例》的规定执行,并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
利拉鲁肽注射液购自诺和诺德制药有限公司;RIPA 裂 解 液、 PMSF、 SDS-PAGE 制 胶 盒、 TBS(20X)、TRIS Base、Glycine、SDS(十二烷基磺酸钠)、Tween20、脱脂奶粉(Skim Milk)均购自索莱宝科技(Solarbio);BCA 蛋白浓度测定试剂盒购自中国Beyotime Biotechnology 公司;ECL 显影液、PVDF 膜购自美国 Millipore 公司; Anti-mouse IgG-HRP antibody、Anti-Rabbit IgG-HRP antibody 购自北京中杉金桥生物技术有限公司;Anti-IgG-DDB1 antibody购 自 Abcam; Anti-IgG-G6pase antibody、 Anti-IgGPEPCK antibody 购自博奥森( Bioss); Anti-Cryptochrome I/CRY1 Antibody、Anti-FoxO1a Rabbit Monoclonal Antibody 购自博士德;SDS-Loading Buffer(5×)购自北京康润科技(Genstar);葡萄糖氧化酶试剂盒购自上海荣盛。
1.3 实验方法
1.3.1 实验分组
取11~12 周雄性KK-Ay 糖尿病小鼠10 只,单笼饲养于屏障环境,温度:20℃~22℃,湿度:45%~55%,光照:12 h/12 h 明暗循环,所有小鼠均予以常规饮食。 小鼠适应环境1 周后测量体重(35.04±0.92)g,血糖>13.9 mmol/L 的 KK-Ay 小鼠随机分为2 组,即利拉鲁肽干预组和模型对照组,每组5只。 另取同周龄体重(28.02±2.04)的雄性 C57 小鼠5 只作为正常对照,利拉鲁肽干预组每日腹腔注射250 μg/kg利拉鲁肽,模型对照组和正常对照组每日腹腔注射等量生理盐水,给药时间每日16:00 ~17:00,连续干预8 周。
1.3.2 动物处理与取样
在处死小鼠前,禁食12 h,对小鼠进行眼眶取血;取出眼眶血放于EP 管中,然后将EP 管置于37℃水浴锅孵育30 min;3000 r/min 离心10 min;取上清液(即血清)转移到对应标记新的1.5 mL 离心管中;采用葡萄糖氧化酶法测定血糖。 同时处死小鼠剖腹取小鼠肝组织分装置于-80℃冰箱保存备用。
1.3.3 Western blot 检测
取0.2 g 肝组织,加入提前配好的RIPA 裂解液800 μL(RIPA 裂解液+蛋白酶抑制剂2%+磷酸酶抑制剂1%+PMSF 1%),超声波裂解肝组织,冰上静置30 min,12000 r/min 离心 30 min,取上清。 应用BCA 法创建蛋白定量标准曲线,依据定量,计算各肝标本中的总蛋白和蛋白浓度。 应用10% SDSPAGE 分离胶胶对蛋白电泳分离约1.0 ~1.5 h,在冰浴条件下转膜(湿转)约120 min。 用5%脱脂奶粉溶液室温下封闭2 h。 一抗(依据抗体说明书及摸索的具体情况确定稀释比例,用1×TBST 稀释)4℃条件下摇床孵育过夜。 第2 天将PVDF 膜用1×TBST 洗涤5 次,每次6 min,二抗(依据说明书要求的稀释比例,应用1×TBST 稀释)室温孵育2 h,洗涤后在多功能成像仪暗室中曝光、成像、记录图像。
1.4 统计学方法
用Image J 软件测定每个目标条带的灰度值,使用Graphpad 5.0 进行统计学分析和作图。 实验数据用平均数±标准差(±s)表示,组间比较用t检验,以P<0.05 为有统计学意义。
2 结果
2.1 对随机血糖的影响
三组小鼠血糖值差异具有统计学意义,模型对照组血糖值(30.84±1.29)mmol/L 较正常对照组血糖值(8.88±0.47)mmol/L 明显升高,差异有统计学意义(P<0.01);利拉鲁肽干预组血糖值(23.74±2.74)mmol/L 较模型对照组明显下降,差异具有统计学意义(P<0.05)。
2.2 对肝组织E3 泛素蛋白酶DDB1 表达的影响
Western blot 结果显示糖尿病小鼠肝内E3 泛素蛋白酶DDB1 蛋白水平明显高于正常对照组(P<0.05),经利拉鲁肽干预处理后,糖尿病小鼠肝内DDB1,CRY1 的表达均低于糖尿病对照组(P<0.05),见图1、表1。
2.3 对小鼠肝组织CRY1、FOXO1, 及糖异生关键酶PEPCK、G6pase 表达的影响
Western blot 结果显示糖尿病小鼠肝内FOXO1,PEPCK 及G6pase 蛋白水平明显高于正常对照组(P<0.05),经利拉鲁肽干预后,糖尿病小鼠肝内FOXO1,PEPCK 及G6pase 的表达均明显低于模型对照组(P<0.05),见图2,表2。 糖尿病小鼠内CRY1 蛋白表达水平明显低于正常对照组(P<0.05),利拉鲁肽干预处理后,表达量却明显上调(P<0.05),见图2、表2。

图1 利拉鲁肽对糖尿病小鼠肝E3 泛素蛋白酶DDB1蛋白表达水平的比较Figure 1 Comparison of the expression level of E3 ubiquitin protease DDB1 in liver of diabetic mice with 1iraglutide
3 讨论
胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)主要由末端空肠、回肠和结肠中的 L 细胞受到食物刺激后分泌[5],是一种肠内分泌源性肽,通过刺激胰岛素分泌、抑制胰高血糖素释放、促进β细胞增殖、减少食物摄入等途径,起到抑制糖尿病的作用[6],现已广泛应用于临床,主要用于改善2型糖尿病患者的胰岛素敏感性。 各项临床研究及meta 分析都指出:GLP-1 及其类似物能够显著降低2 型糖尿病患者的血糖及体重,改善胰岛素的敏感性,可以改善心衰大鼠左心室的收缩和舒张功能袁减轻心肌细胞的损伤,且独立于降糖机制[7]。 其中利拉鲁肽(1iraglutide)属于长效的 GLP-1 类似物,与人体天然的GLP-1 氨基酸序列具有97%的同源性,于2010 年由美国FDA 批准用于临床,而目前主要用于改善成人2 型糖尿病患者的血糖控制[8],本次实验结果提示模型对照组较正常对照组血糖明显升高,而利拉鲁肽干预后,血糖明显下降,并具有统计学意义。
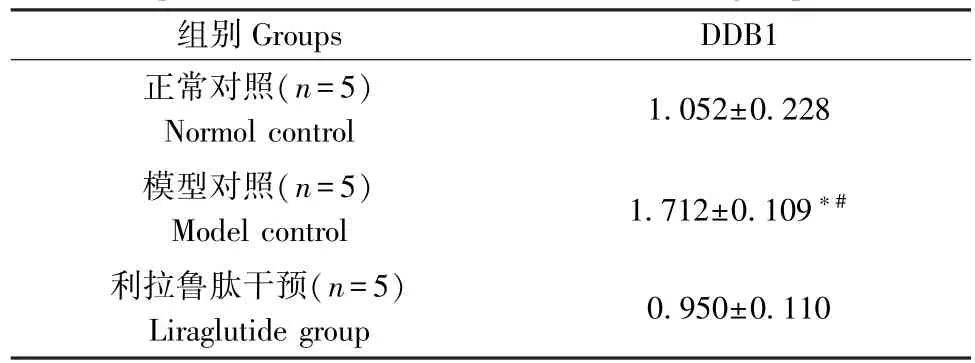
表1 5 组小鼠肝组织E3 泛素蛋白酶DDB1蛋白表达水平的比较Table 1 Comparison of the expression level of E3 ubiquitin protease DDB1 in liver tissues of five groups

图2 利拉鲁肽对小鼠肝CRY1、FOXO1 及PEPCK、G6pase 蛋白表达水平的影响Figure 2 Effect of Lilarutin on CRY1、FOXO1 and PEPCK、G6pase expression in mouse liver

表2 5 组小鼠肝组织 CRY1、FOXO1、G6pase、PEPCK 蛋白表达水平的比较Table 2 Comparison of protein expression levels of CRY1, FOXO1, G6pase and PEPCK in five groups mouse liver
泛素-蛋白酶体途径(UPS)是存在于真核细胞中精确调控细胞质和细胞核内蛋白质有序降解的途径,由泛素(Ub)、 泛素激活酶(E1)、 泛素结合酶(E2)、 泛素连接酶(E3)、26S 蛋白酶体和去泛素化酶(DUBs)组成[9]。 越来越多的研究证据表明E3泛素蛋白酶通过调节胰岛素信号传导中的关键分子在胰岛素抵抗的发展中起着关键作用[10]:MG53的过度表达可以触发肌肉胰岛素抵抗和代谢综合征[11-12];膜相关环-CH-1(MARCH1)可以通过泛素化负调节胰岛素受体的细胞表面水平[13];也有报道称脂肪组织E3 泛素蛋白酶Pellino3 对胰岛素抵抗却表现出保护作用[14]。 Xin 等人的研究表明,E3 泛素蛋白连接酶DDB1 可能是一种新型的糖原异生监管因素,它主要通过介导CRY1 蛋白的降解,进而推动FOXO1 介导的糖异生作用,同时也证实肝细胞DDB1 缺乏不仅抑制空腹时糖原异生,并且可以保护小鼠免受禁食高脂肪饮食引起的高血糖[15-16]。本研究结果显示利拉鲁肽在肝内可作用于E3 泛素蛋白酶DDB1,并下调它的表达,提示 GLP-1 及其类似物在肝内可能通过下调E3 泛素蛋白酶,进而发挥抑制肝糖异生的作用,而其中的具体作用机制尚有待进一步实验研究。
肝是糖脂代谢的重要器官,在糖尿病的发生发展中起着至关重要的作用[17]。 在糖尿病患者中,肝糖异生增加导致大量内源性葡萄糖产生,特别是增加了空腹高血糖的发生[18],其中糖异生限速酶葡萄糖-6-磷酸酶(G-6-Pase)和磷酸烯醇式丙酮酸羧化酶(PEPCK)编码基因的多少是决定糖异生启动的关键环节[19],故通过干预肝糖异生, 减少肝葡萄糖生成, 将为改善肝胰岛素抵抗提供一个广阔前景。而肝糖异生还受很多转录因子的调控,包括叉头盒转录因子 O1(FoxO1)、CREB、 PGC-1α 等等,其中FOXO1 被证实是肝用来监测脂质和葡萄糖代谢与循环胰岛素水平的传感器,是肝糖异生关键酶调控的上游靶点,主要促进空腹时肝糖异生, 增加肝糖输出[20-21]。 Fan 等人[22]发现 exendin-4 可增加幼鼠肝AKT 和FOXO1 磷酸化,抑制葡萄糖-6-磷酸酶(G6pase)和磷酸烯醇丙酮酸羧激酶(PEPCK)的表达。 在本次研究中同样证实利拉鲁肽下调了肝糖异生关键酶PEPCK 及G6pase 的表达,糖异生的上游靶点FOXO1 的表达也同样被下调,推测利拉鲁肽抑制肝糖异生可能与部分下调E3 泛素蛋白酶进而抑制FOXO1 有关,而其中的具体机制需要进一步去验证。
隐花色素1(cryptochrome 1,CRY1)表达蛋白是生物钟的组成部分,经体液和神经途径送达效应器,调节生理、生化和节律行为,肝糖异生也受昼夜节律的调控,昼夜节律是协调葡萄糖代谢与外部环境变化,研究发现CRY1 可以通过作用于糖皮质激素受体和胰高血糖素信号通路负调控FOXO1 的表达,抑制肝糖异生[23-25], Stojkovic 等[26]人提出泛素化是一个时钟蛋白修饰编码的关键因素,本研究发现肝中CRY1 的表达与DDB1 呈负相关,这与之前研究结果是相符的,故推测CRY1 在肝可能是通过泛素蛋白的泛素化来降解的,进而抑制肝糖异生,但其中的具体机制仍需要进一步研究证实。
总之,利拉鲁肽降低糖尿病小鼠糖异生关键酶PEPCK 及G6pase 的表达,抑制了肝的糖异生,有效控制糖尿病小鼠血糖。 同时利拉鲁肽可显著下调糖尿病小鼠肝内E3 泛素蛋白酶DDB1 的表达水平,揭示了利拉鲁肽调节肝糖异生可能存在的一种新的通路,这同时也揭示了E3 泛素蛋白酶可能成为一种新的肝糖异生的负调控因子,有望成为治疗2型糖尿病的新的靶点。
