大黄酚通过抑制巨噬细胞的TNF-α从而改善LPS诱导的小鼠炎症反应
2021-01-25闫东梅
朱 培,闫东梅,郑 伟
(1.吉林大学基础医学院 免疫学系,吉林 长春130021;2.吉林省一汽总医院 质量控制部,吉林 长春130061)
大黄是一种传统中草药。根据古代中医书籍《神农本草经》记载,大黄主要有三种主要的药理作用:①清理肠道消化不良内容物,使肠道通畅;②消除体内毒素并减轻炎症;③增强新陈代谢,改善器官功能[1]。大黄的主要活性成分包括大黄酚、大黄酸、大黄素等[2-3],其中大黄酚是蒽醌家族的成员,具有抗癌、保肝、抗菌抗炎等生物学功能[4-5],但是是否具有改善脓毒血症的作用,以及其抗炎机制还不清楚。
脓毒血症引起的全身炎症反应是导致器官功能障碍综合征的主要原因之一[6-7],大黄与抗生素合用的方案治疗脓毒血症能够起到明显的改善及缓解全身炎症反应的作用,大大提高了患者的生存率和治愈率[8-9]。先天性免疫应答的早期激活与脓毒血症的发病机理有关[10],其中激活的巨噬细胞释放的细胞因子如肿瘤坏死因子-α(TNF-α)是脓毒血症“细胞因子风暴”的主要来源之一,对宿主早期的炎症发展至关重要[11]。
本研究通过给小鼠腹腔注射脂多糖(LPS)建立小鼠炎症模型,观察不同浓度的大黄酚对LPS诱导的小鼠炎症模型肝组织和肺组织损伤的影响以及血清中炎症因子TNF-α水平,探究大黄酚在大黄抑制全身炎症中的作用。此外,我们通过检测小鼠腹腔巨噬细胞在基因水平上表达炎症因子的情况,探讨大黄酚是否能够抑制巨噬细胞表达TNF-α。本研究为探究大黄在临床全身严重炎症中的作用机制提供了一个实验依据。
1 材料与方法
1.1 材料
1.1.1主要试剂 大黄酚(纯度≥98%,货号:SC8260)购自中国北京索莱宝科技有限公司,用N,N二甲基甲酰胺∶吐温80∶生理盐水=1∶1∶8溶解; LPS(货号:L8880-10 mg)购自中国北京索莱宝科技有限公司; TNF-α酶联免疫吸附法(ELISA)试剂盒(货号:SEA133Mu)购自武汉克隆科技股份有限公司;DMEM高糖培养液(货号:01-052-1ACS)、胎牛血清FBS(货号:04-001-1A)均购自沈阳汇佰生物科技有限公司;逆转录试剂及QPCR试剂均购自长春海灵科贸有限公司。
1.1.2主要仪器 细胞用超净台为中国苏净安泰产品;二氧化碳细胞培养箱为日本SANYO产品;显微镜为德国蔡司倒置荧光显微镜;QPCR仪为美国ABI 7300;多功能酶标仪为美国Bio-Rad产品。
1.2 方法
1.2.1实验动物及分组 6-8周清洁级BALB/C小鼠,体重(20±2)g,购自长春市亿思实验动物技术有限责任公司,动物合格证号:SCXK(吉)2016-0003,饲养温度26-28 ℃,湿度60 %-80 %,光照12 h/12 h。分组情况:小鼠随机分为5组:正常组(Normal control)、LPS组(10 mg/kg LPS+vehicle)、大黄酚给药组(10 mg/kg)(LPS+10 mg/kg)、大黄酚给药组(1 mg/kg)(LPS+1 mg/kg)、大黄酚给药组(0.1 mg/kg)(LPS+0.1 mg/kg),每组6只。
1.2.2小鼠给药方法 第一天:正常组给生理盐水作为对照,其余4组小鼠腹腔注射给LPS(10 mg/kg)制备炎症模型,1 h后腹腔注射给予大黄酚,24 h和48 h重复给药1次。
1.2.3HE染色检测小鼠肝和肺组织的病理改变 取小鼠肝组织和肺组织,固定在4%中性福尔马林固定液中,经脱水、常规石蜡包埋、切片后,进行HE染色,于光学显微镜下观察组织的病理学改变,并进行肝组织损伤评分和肺组织损伤评分[12]。
1.2.4ELISA检测小鼠血清中TNF-α的含量 将取出的小鼠血液在常温静置4 h后,3 000 r/min离心20 min,取上层血清。严格按照ELISA试剂盒说明书检测TNF-α。
1.2.5小鼠腹腔巨噬细胞的收取及培养方法 将处死的小鼠在75 %的医用酒精中浸泡2 min,置于超净台中,无菌操作取出小鼠腹腔巨噬细胞,400 g 离心5 min,弃去上清,用10 ml含10% FBS的DMEM培养液重悬将细胞置于培养皿中培养4 h后贴壁,收取细胞,并提取总RNA。
1.2.6QPCR方法检测小鼠腹腔巨噬细胞中TNF-α及iNOS的表达情况 用Trizol试剂提取小鼠腹腔巨噬细胞总RNA,用反转录试剂进行逆转录,得到cDNA,根据QPCR试剂盒说明对β-actin、TNF-α进行检测。基因引物:β-actin上游5’-GACTTCAACAGCAACTCCCACTC-3’,下游5’-TAGCCGTATTCATTGTCATACCAG-3’; TNF-α 上游5’- GGTGCCTATGTCTCAGCCTCTT-3’,下游 5’- GCCATAGAACTGATGAGAGGGAG-3’。以β-actin为内参,按照2-ΔΔCt法计算TNF-α的相对表达量。
1.2.7统计学分析 实验结果采用Student’s T test分析,P<0.05时具有统计学意义。所有实验数据来源于3至6个独立实验数据可计算的平均值±标准差,每项实验均重复3次以上。
2 结果
2.1 黄酚对LPS诱导的小鼠炎症模型中肝和肺组织病理学改变的影响
我们通过观察正常组(Normal control)、LPS组(LPS+vehicle)、大黄酚给药组(LPS+10 mg/kg)3组小鼠肝和肺HE染色的组织切片发现,LPS组的小鼠表现为细胞密度降低、细胞间隙增大的肝组织损伤特征,而LPS+10 mg/kg大黄酚组显示细胞间隙降低、中性粒细胞浸润减少(见图1A),图1B为肝组织损伤评分。此外,LPS组的小鼠还表现出急性肺泡损伤和炎症的特征,例如充血、中性粒细胞积聚和肺泡壁明显增厚,而LPS+10 mg/kg大黄酚组显示LPS诱导的小鼠肺部炎症得到改善,甚至还可见到正常组织学特征(见图1C),图1D为肺组织损伤评分。
2.2 大黄酚对LPS诱导的小鼠炎症模型血清中TNF-α水平的影响
用ELISA方法检测血清中TNF-α的含量。结果显示10 mg/kg的大黄酚给药组(LPS+10 mg/kg)明显抑制了LPS诱导的血清中TNF-α水平的升高,见图2。
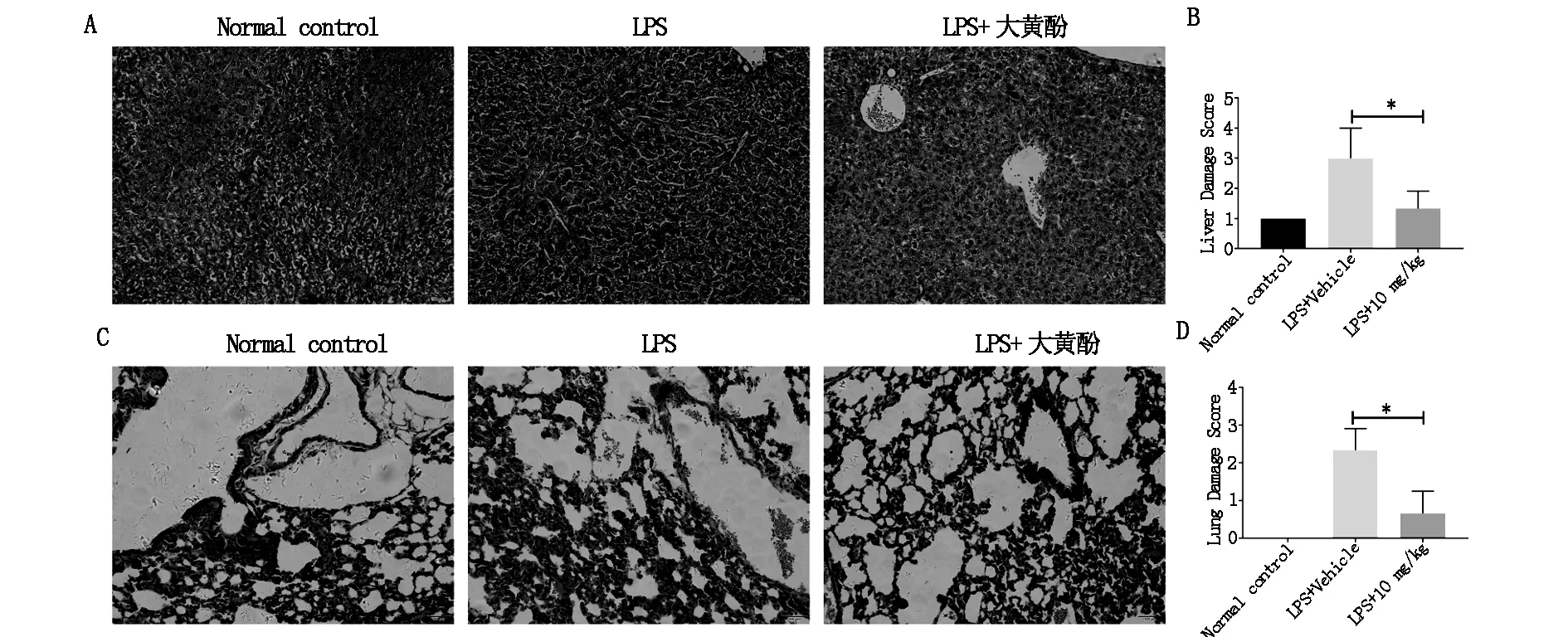
图1 小鼠肝组织和肺组织HE染色结果

图2 小鼠血清中TNF-α水平
2.3 大黄酚对LPS诱导的小鼠炎症模型小鼠腹腔巨噬细胞表达炎症因子的影响
为了进一步探讨大黄酚抑制小鼠炎症的相关机制,我们取小鼠腹腔巨噬细胞,并提取总RNA,进行逆转录,用QPCR的方法检测5组小鼠腹腔巨噬细胞中炎症因子TNF-α的表达情况。结果如图3所示,10 mg/kg的大黄酚给药组明显抑制了LPS诱导的巨噬细胞表达TNF-α。
3 讨论
全身炎症反应是脓毒血症引发严重并发症的主要原因,且临床脓毒血症的死亡率极高,但是目前还没有针对脓毒血症的特定治疗方法和高效药物。大黄制剂与常规治疗的联合应明显降低了脓毒血症的致死率,这值得我们去探究大黄的作用机制。大黄酚是大黄的重要生物活性成分之一,近年来相关研究发现大黄酚单独使用也具有独特的生物学特性。
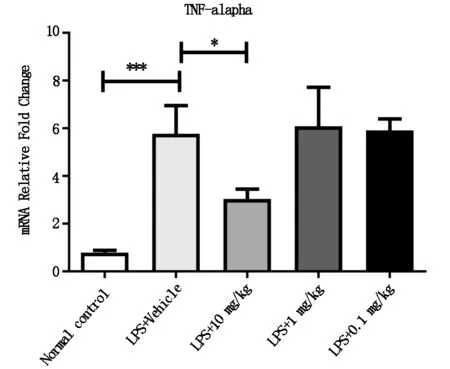
图3 小鼠腹腔巨噬细胞表达TNF-α的情况
研究发现,大黄酚能够通过抑制LPS诱导的巨噬细胞中NF-κB和caspase-1的活化从而抑制其表达TNF-α、白介素6(IL-6)和环氧化酶2(COX-2)[4]。此外,大黄酚还能够抑制LPS诱导的小胶质细胞分泌炎症因子一氧化氮(NO)和TNF-α[13],且在小鼠脑缺血再灌注模型中,大黄酚能够通过抑制脑组织表达C0X-2和基质金属蛋白酶9( MMP-9)减轻炎症反应[14],这表明大黄酚可能对中枢神经系统起到保护作用。近期研究发现大黄酚对乳腺癌、卵巢癌、绒毛膜癌、肺癌、肝癌以及结肠癌都显示出抗肿瘤作用[15-16],相关机制可能与大黄酚能够抑制细胞增殖或通过靶向NF-κB、AKT/ERK1/2等信号通路促进细胞凋亡等途径有关[5,17]。
在本研究中,LPS明显诱导了小鼠的炎症反应,并且在LPS刺激72小时后,血清中的TNF-α依旧是正常对照组的2倍,而给10 mg/kg大黄酚治疗的小鼠血清中TNF-α的水平几乎接近正常组,这说明大黄酚能够明显抑制机体全身炎症的发展。通过收集腹腔巨噬细胞检测其在基因水平上表达TNF-α的情况,我们进一步明确了大黄酚能够通过抑制巨噬细胞表达炎症因子来抑制LPS诱导的炎症反应。本研究为大黄酚在临床上的治疗提供了理论依据。
