香格里拉海拔高度对‘赤霞珠’葡萄果实花色苷的影响
2021-01-25何涛杜鸿燕马义邓维萍朱书生杜飞
何涛,杜鸿燕,马义,邓维萍,朱书生,杜飞*
(云南农业大学教育部农业生物多样性与病害控制重点实验室,云南昆明 650201)
花色苷由花色素结合糖苷而成,是一种水溶性色素,广泛存在于植物液泡中,从而使其呈现不同的颜色[1]。花色苷类物质属于葡萄酒多酚的一种,在葡萄酒中常以花色苷单体、花色苷衍生物及聚合体的形式存在[2]。作为功能性物质,花色苷的含量及种类不仅影响葡萄酒的色泽、风味、口感,还能与单宁生成复合物,使葡萄酒中的涩味和粗糙感得以降低,呈现更好的口感,从而影响葡萄酒质量,进而影响市场价值[3]。葡萄果实中的花色苷主要以糖苷的形式存在,葡萄和葡萄酒中常见的花色苷有15种[4],其中果实中主要有矢车菊色素、飞燕草色素、芍药色素、矮牵牛色素和锦葵色素5种花色素诱导体。据报道,花色苷具有降低肝脏及血清中脂肪含量、抗肿瘤、延血小板凝集等营养和药理作用,在食品、化妆品、医药等领域都有着巨大的应用潜力[5]。花色苷作为黄酮类的一个大分支,能够清除体内的自由基,从而降低氧化酶活性[6],还具有吸收紫外线、抗氧化等作用,因而选育天然色素丰富、品质纯良的葡萄品种具有广阔的前景。
在葡萄生长发育过程中,花色苷在转色期开始积累,其生物合成途径和代谢调控受各种因素的影响,主要有外界环境因素(温度、湿度、光照、水分、海拔);营养条件因素,包括土壤肥力状况,氮源等;葡萄病虫害发生程度;葡萄激素和基因调控等。研究表明,弱光可降低花色苷的含量,而强光能促进花色苷和类黄酮物质合成[7]。温度是影响花色苷合成的重要因素,Spayd等[8]研究表明,较低的平均温度有利于花色苷的合成,而温度高于35 ℃会导致花色苷含量降低[9-12]。水分也会影响葡萄花色苷的合成[13]。葡萄栽培模式会改变葡萄环境条件,从而影响果实花色苷积累;在葡萄转色至成熟期间,花色苷含量还与海拔高度有关,高海拔地区温度低、光照强,有利于花色苷的合成[14-17]。但影响花色苷的因素错综复杂,且各种因素之间有交互作用,因此深入研究各因素及其协同或抑制作用对花色苷的合成和积累具有重要意义。
目前,国内外有关花色苷的研究主要集中在花色苷资源分布的评价与资源库的建立、定性与定量方法学、生理活性与功能、高效提取与绿色分离技术、结构稳定性与分子降解机制、应用与产品开发等6个方面[18-21]。蒋宝等[22]通过研究海拔对黄土高原地区‘赤霞珠’果实酚类物质含量及抗氧化活性的影响,发现不同海拔高度能影响‘赤霞珠’果实的品质,但影响程度在不同品质指标间存在差异。在黄土高原地区,低海拔地区‘赤霞珠’果实的成熟度、酚类化合物含量及抗氧化能力均优于高海拔地区‘赤霞珠’果实[23]。赵新节等[24]对花色苷合成的影响因素进行研究发现,葡萄品种、气候条件、土壤条件,以及植物激素和植株负载等均会影响果实花色苷的合成。而关于在不同海拔下对葡萄品种‘赤霞珠’果实的花色苷测定的研究较为少见,本研究以香格里拉6个不同海拔的‘赤霞珠’葡萄为试材,对不同成熟期的花色苷含量进行测定,以评价香格里拉地区不同海拔高度对葡萄质量的影响,进而对推动当地葡萄酒产业的发展提供参考依据。
1 材料与方法
1.1 材料
材料取自云南省德钦县6个不同海拔高度的‘赤霞珠’葡萄,分别是日米(1860 m)、尼通(2000 m)、荣中(2100 m)、西当(2240 m)、阿东(2600 m)、红坡(2675 m)。2016年8月19日开始取样,依据葡萄生长情况,在其不同生长时期内取样4次,10月15日结束。6个试验点分别编号为试验点1、2、3、4、5、6,将材料置于-80 ℃下保存,备用。
1.2 花色苷的提取
选取大约15粒着色均匀的葡萄,小心剥离果皮,用液氮研磨成粉,称取1.00 g粉末于50 mL离心管中。然后加入1%的盐酸-甲醇溶液20 mL,在30 ℃控温振荡器中避光提取2 h,期间每30 min换一次水,以防止控温振荡器中的水温过高。提取液于5000 r/min的转速下离心5 min,收集上清液,然后继续用上述方法提取花色苷,重复提取5次。合并提取液,于旋转蒸发仪上蒸发干燥(35 ℃,转速60 r/min),残留物用甲醇溶解,并定容至5 mL容量瓶中,-80 ℃保存待测。每个试验点做3个重复。
1.3 香格里拉不同海拔试验点气象数据检测方法
试验采用GPRS-Base系统气象站采集上述6个不同海拔梯度葡萄园的气象数据。气象站安置在离葡萄园20 m以内的区域,高度为1.5 m。连续监测大气环境中温度、日照时长、紫外辐射和总辐射、降雨量及相对湿度,数据记录每次1 h。选取2016年8—9月时间段的气象数据,采用SQL(Structured query language)数据库软件统计平均温度、平均相对湿度、平均日光辐射强度、总光辐射强度、平均紫外辐射强度、总紫外辐射强度。
1.4 高效液相色谱(HPLC)定性和定量分析
花色素苷的定性分别采用标样矢车菊素葡萄糖苷(Cy)、飞燕草素葡萄糖苷(Dp)、芍药素葡萄糖苷(Pn)、矮牵牛素葡萄糖苷(Pt)和锦葵素葡萄糖苷(Mv)来进行。出峰面积表示5种花色素苷的相对百分含量。液相分析前,待测样品用0.22 μm有机微孔滤膜过滤,然后直接进样。
1.5 色谱条件
日本岛津(Shimadzu)公司高效液相色谱仪LC-20A,色谱柱采用YMC-TriartC18柱(250 mm×4.6 mm,5 μm)。流动相A体积比:水∶甲酸=90∶10;流动相B体积比:甲酸∶乙腈=10∶90。洗脱程序:0~1 min,3%B;1~12 min,3%~15% B;12~14 min,15%~25% B;24~28 min,25%~30% B;28~32 min,30%~4% B;32~40 min,4% B;流速:1.0 mL/min;柱温:30 ℃;检测波长:525 nm;进样量:10 μL。
1.6 绘制花色苷单体标准曲线
绘制花色苷单体标准曲线前,先分别将5种花色苷单体标准溶液依次稀释为不同的浓度梯度。Mv稀释为:500、250、125、62.5、31.25、15.625 mg/L;Pn、Pt、Cy、Dp稀释条件为:200、100、50、25、12.5、6.25 mg/L。
1.7 计算方法
Dp:y=3×106x-5356.5R2=0.9998094
Cy:y=3×106x-1573.9R2=0.9999006
Pt: y=3×106x-4042.8R2=0.9997693
Pn:y=3×106x-993.73R2=0.9996636
Mv:y=3×106x-29178R2=0.995908
其中x为浓度(mg/mL),y为面积,R2表示线性相关程度。
2 结果与分析
2.1 ‘赤霞珠’葡萄园气象因子差异分析
各试验点在5月—10月期间的温差均高于26 ℃,平均温度均超过20 ℃(表1),其中以试验点2尼通和试验点4西当的温差最大,均超过28 ℃。虽然平均温度之间没有显著差异,但可以明显看出,随着海拔的升高,各试验点平均温度减低,海拔最高的试验点6红坡的平均温度仅为20.23 ℃。6个试验点中,除海拔较高的试验点5及试验点3外,其平均总辐射强度随着海拔的增高而升高,试验点的平均紫外辐射则有不同,在试验点1、2、3随海拔增加而升高,在试验点4、5、6则随海拔升高而降低。比较特别的是海拔最高的试验点5、6,二者均位于山谷地带,其平均相对湿度比其他试验点高,但紫外辐射却相对较低。
2.2 ‘赤霞珠’果实花色素苷的组分分析
HPLC法测定结果表明,香格里拉‘赤霞珠’葡萄果皮中有超过10种花色素苷衍生物,确定花色苷的洗脱顺序依次为Dp(16.295 min)、Cy(18.013 min)、Pt(18.958 min)、Pn(19.756 min)、Mv(20.026 min)。
2.3 果实中转色初期不同花色苷组分含量分析
‘赤霞珠’果实转色初期5种主要花色苷组分的测定结果表明(图1),试验点4的Mv含量显著高于其他试验点的含量,但是其他4种组分Pn、Pt、Cy、Dp在不同试验点中的含量没有显著差异。
2.4 果实中转色期不同花色苷组分含量分析
图2结果表明,在50%转色期时,试验点2的Dp含量较高,显著高于试验点4;Pt在低海拔地区的含量较高,试验点1、试验点2和试验点3的含量显著高于试验点4;低海拔试验点的Pn含量较高,试验点2的Pn含量显著高于试验点5、6、4;各试验点Cy差异不大;较低海拔的试验点2的Mv含量显著高于试验点4。
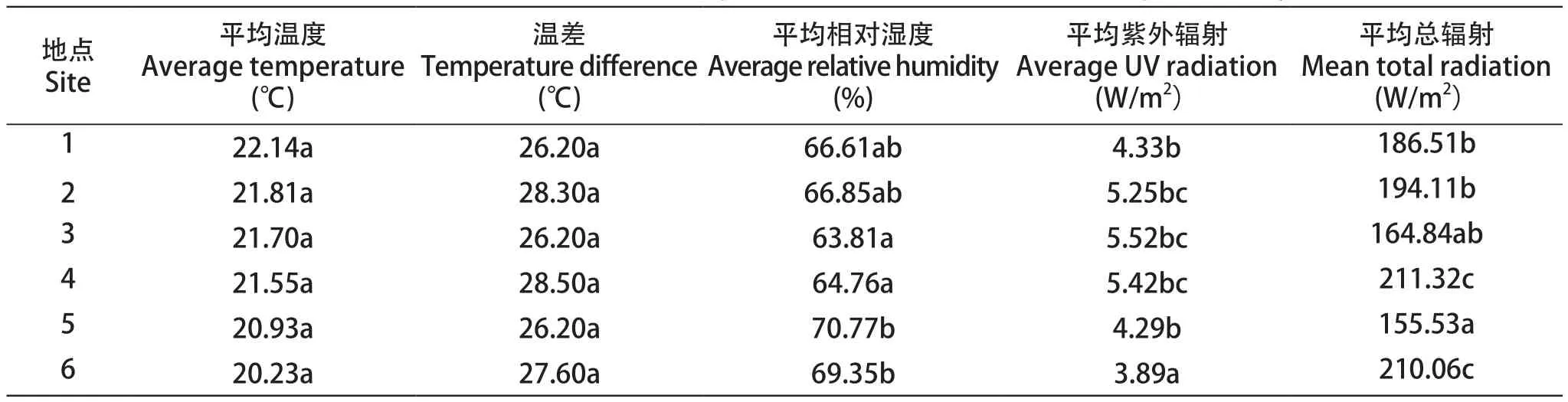
表1 ‘赤霞珠’葡萄园气象因子统计表Table 1 Statistical table of meteorological factors for 'Cabernet Sauvignon' vineyards
在100%转色期时(图3),试验点4的Dp含量上升较快,与试验点2没有显著差异,显著高于试验点5;试验点4‘赤霞珠’果实中的Pt含量大幅上升,显著高于试验点1、3、5、6;各试验点Pn含量均有上升,但试验点3的上升最少;Cy在较低海拔的试验点1含量为最高,且显著高于试验点3、4、5和试验点6,以试验点3的含量最低。Mv变化趋势为在100%转色期时试验点4的含量急剧上升,其含量反而显著高于其他试验点。
2.5 果实成熟期不同花色苷组分含量分析
图4结果表明,试验点4的Mv含量显著高于其他试验点,但是其他4种组分Pn、Pt、Cy和Dp在不同试验点没有显著性差异。
3 讨论与结论
研究发现在‘赤霞珠’果实中共有10多种花色苷衍生物,其中矢车菊色素、飞燕草色素、芍药色素、矮牵牛色素和锦葵色素五种为主要花色苷,这与孙磊[25]研究中国野生葡萄果皮花色苷组分得出的结论类似。欧亚种葡萄主要以单糖花色苷为主,双糖花色苷含量很少,并且主要以锦葵色素类花色苷为主,唐传核等[26]研究葡萄多酚类化合物以及生理功能也发现这5种物质为主要花色素。

图1 果实中转色初期不同花色苷组分Figure 1 Content of different anthocyanin in the early stage of the transition color
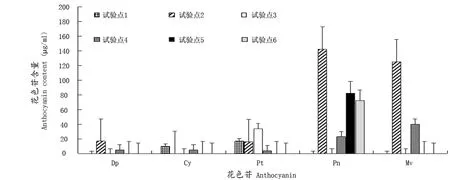
图2 果实中50%转色期不同花色苷组分Figure 2 Content of different anthocyanin in the early stage of 50% transition color
在葡萄转色初期和成熟期,西当试验点‘赤霞珠’果实的Mv含量都显著高于其他试验点,而在50%转色期和100%转色期5种花色苷的含量则各有不同。蒋宝等[27]研究认为,在黄土高原地区低海拔处的‘赤霞珠’果实的酚类化合物含量及抗氧化能力均优于高海拔坡地‘赤霞珠’果实。赵新节等[24]研究认为,夜间蓝光照射比红光照射更能促进糖分和花色苷的积累,温度和湿度都会影响花色苷相关基因的表达,这与转色初期高海拔葡萄花色苷含量显著高于低海拔的结论类似。‘赤霞珠’葡萄果实花色苷的组分及含量跟光照、温度、湿度、土壤和栽培措施等因素有着密切关系。有大量证据表明,花色苷的产生与光和温度水平呈正相关,Oliveira等[28]研究表明,与巴西海拔较低的伯南布哥(Pernambuco)相比,海拔较高的巴伊亚(Bahia)地区葡萄中花色苷单体含量均显著升高;Mateus等[29]连续3年在杜罗河谷研究了来自不同海拔的两种葡萄‘Touriga Nacional’和‘Touriga Francesa’发现,高海拔会增加葡萄和葡萄酒中花青素的含量。Liang等[30]研究了中国5个葡萄栽培地区的4个葡萄品种,认为高海拔地区花青素的浓度较高。根据Winkler等[31]的研究认为,葡萄的颜色与温度有关,非常冷或非常热的温度与较差的颜色呈正相关。花青素积累的最佳温度范围是17~26 ℃。低温,尤其是在夜间的低温会增加红葡萄的色泽,而温度高于35 ℃,则通常会抑制花色苷的合成。因此,在2000~2600 m海拔区域的葡萄中发现的高浓度总单体花色苷可能与生长成熟周期内保持在30 ℃以下的最高温度有关,有利于花色苷的积累并避免其降解。

图3 果实中100%转色期不同花色苷组分含量Figure 3 Content of different anthocyanin in the early stage of 100% transition color

图4 果实中成熟期不同花色苷组分Figure 4 Content of different anthocyanin components in the ripening period
