大负荷运动后不同时相下骨骼肌线粒体的分裂及其过程
2021-01-25白胜超陈圣菊李俊平尚画雨高扬王瑞元
白胜超,陈圣菊,李俊平,尚画雨,高扬,王瑞元
人体长时间进行大负荷运动或是承受不适应的运动负荷后,肌肉会出现收缩能力下降、酸痛、超微结构改变等,甚至造成运动性骨骼肌损伤[1]。课题组前期研究发现,大负荷运动后可导致骨骼肌肌浆网肿胀,诱导微管解聚,通过微管相关蛋白4(mitogen-acti‐vated protein kinase4,MAP4)与电压依赖性阴离子通道(voltage-dependent anion channel,VDAC)的结合影响线粒体的形态,表现为线粒体大小不一、肿胀、嵴稀少,或空泡化,出现严重的结构异常现象[2]。之后又对线粒体分布进行了研究,发现大负荷运动可引起骨骼肌线粒体再分布,主要为肌膜下大量聚积,疑似和线粒体分裂具有重要关系。
线粒体分裂是线粒体动力学的重要方面,与线粒体的形态、移动、数量均具有重要关系,影响后续自噬与凋亡的发生以及骨骼肌的功能,是整个运动性骨骼肌损伤中非常重要的一环。线粒体受到损伤后会发生分裂,受损部分断裂,通过后续的线粒体融合完成自我修复或是线粒体自噬进行清除,运动后线粒体分裂是完成损伤修复的必要过程,影响骨骼肌的恢复以及运动训练的实际效果。调控线粒体分裂的主要蛋白为DRP1(dynamin-relatedprotein1,DRP1)、线粒体分裂蛋白1(mitochondrial fission protein1,Fis1),线粒体分裂因子(mitochondrial fission factor,MFF)等[3]。研究指出,DRP1 起到关键作用,大量聚集形成环状结构,对线粒体收缩切割使其分裂[4]。最新研究发现,低氧或是用FCCP(具有降低线粒体膜电势的作用)处理细胞可以引起细胞线粒体分裂增加,主要通过FUNDC1(FUN14 domain containing 1,FUNDC1)与视神经萎缩症蛋白1(optic atrophy1,OPA1)、钙联结蛋白(Calnexin,CNX)、DRP1等蛋白的相互结合所致[5]。这提示,大负荷运动后骨骼肌线粒体的分裂过程可能会通过FUNDC1的介导实现。
运动后骨骼肌的修复过程逐渐加强,在此期间线粒体可能一直处于高度动态变化之中,因此,探究大负荷运动后多时相下的骨骼肌线粒体分裂现象具有重要意义,能够提高对骨骼肌损伤机理的深层认识,丰富骨骼肌修复的理论基础。目前,关于运动后骨骼肌线粒体分裂的研究大多集中在某一时间点,并未进行前后多时相研究,对线粒体分裂的动态变化及其过程尚不明确。一次性大负荷离心运动后大鼠比目鱼肌会造成运动性骨骼肌损伤,线粒体出现明显肿胀和肌膜下积聚等超微结构异常变化[6]。因此,本研究借鉴该模型进行干预,使用透射电镜观察骨骼肌线粒体是否出现片段化;免疫荧光检测线粒体外膜转位酶20(Translocase of outer mitochondrial membrane 20,TOMM20)与DRP1 的共定位确定线粒体是否出现分裂现象;Western Blot 方法检测线粒体中DRP1 蛋白量,确定线粒体分裂程度,从而明确大负荷运动后不同时相下骨骼肌线粒体分裂的动态情况;Western Blot 方法检测骨骼肌中FUNDC1 表达量,确定线粒体分裂是否和FUNDC1 表达具有关系,免疫共沉淀检测FUNDC1 与OPA1、CNX、DRP1 等蛋白的相互作用,从分子水平上进一步明确大负荷运动后骨骼肌线粒体的分裂过程。以期能够从线粒体分裂角度对运动性骨骼肌损伤与修复的机理进行一定理论补充。
1 材料与方法
1.1 动物与分组
SPF 级别8 周龄雄性Spraque-Dawley 大 鼠64 只,体重(220.21±8.39)g,购于北京维通利华实验动物技术有限公司(SCXK 京2012-0001:使用许可证号)。北京体育大学标准动物房内进行分笼饲养,饲养环境为温度(23±3)℃,相对湿度40%~70%,室内12 h 明暗切换模拟白昼,自由进食、饮水,该实验已获得伦理委员会批准。
所有大鼠均进行适应性3 天饲养,之后随机分组为安静对照组(C 组,n=8)和单纯运动组(E 组,n=56)。单纯运动组根据干预后时间点不同,又分为0、2、6、12、24、48和72 h等时相组(见表1)。
表1 实验动物分组Table1 Groups of Experimental Animals
1.2 运动模型
大鼠运动模型的预适应期参照赵晓琴[7]方案进行,为期3 天,方式为:单纯运动组大鼠在小动物电动跑台上进行规定速度的运动,第1天跑台坡度为0°,速度为16 m/min,训练5 min;第2 天跑台坡度为0°,速度为16 m/min,训练10 min;第3 天休息。正式实验运动方案参照R.B.ARMSTRONG[6-8]经典离心运动模型,造成比目鱼肌运动性骨骼肌损伤,跑台坡度为-16°,速度16 m/min,运动时间为1.5 h。
1.3 样本采集
分别对应实验的时相点进行取材,按照3.5 mL/kg剂量进行水合氯醛麻药腹腔注射,采血管主动脉取血,之后取出比目鱼肌,用于后续样品制备。
取部分比目鱼肌,体积为1×1×1 mm3,置于4 ℃预冷的2.5%戊二醛固定液中,用于后续电镜检测。取部分比目鱼肌,体积为4×4×4 mm3,OCT 包埋后存于冰箱,用于后续免疫荧光实验。取100 mg 新鲜比目鱼肌,严格按照碧云天线粒体分离试剂盒(C3606)进行操作,差速离心提取线粒体,加入存储液转存冰箱,用于Western Blot 检测。取部分比目鱼肌锡纸包裹投入液氮中暂存,最终转移到-80 ℃冰箱中储存,用于免疫共沉淀测试。
1.4 主要仪器与试剂
1.4.1 透射电子显微镜观察骨骼肌线粒体超微结构的变化 (1)磷酸盐缓冲液冲洗样品。(2)锇酸固定后梯度酒精脱水。(3)环氧树脂包埋后切片,醋酸铀和柠檬酸铅染色液染色。(4)干燥后进行观察结构,电镜(×2 000~8 000)随机进行拍摄。具体步骤参照相关文献操作[6]。
1.4.2 免疫荧光检测骨骼肌线粒体TOMM20/DRP1的共定位 (1)冰冻切片。(2)丙酮液固定。(3)PBS 清洗后滴加5%的羊血清封闭,37 ℃,30 min。(4)滴加羊血清稀释过的一抗TOMM20(英国,Abcam 公司)与DRP1(英国,Abcam 公司),稀释比例1:400,4 ℃过夜孵育。(5)PBS清洗后滴加羊血清配制的二抗(中国,伊莱瑞特生物科技股份有限公司),比例1:250,室温孵育2 h。(6)PBS 清洗后滴加DAPI封片。(7)激光共聚焦设置波长为488 和555 2 种,随机采集视野,图片用IPP6.0软件分析共定位百分数。具体步骤参照相关文献操作[6]。
1.4.3 Western Blot测定线粒体DRP1 蛋白量、骨骼肌FUNDC1表达量(1)比目鱼肌剪碎匀浆并离心(12 000 g,4 ℃,10 min),上清液和线粒体样品分别用BCA 试剂盒进行蛋白定量,加入样缓,煮沸保存。(2)加入样品。(3)电泳80 V 恒压。(4)300 mA 恒流转膜。(5)5%BSA室温摇床封闭2.5 h。(6)滴加封闭液稀释的一抗,稀释比例为DRP1(1:800)(英国,Abcam公司),线粒体内参COXⅣ(1:2 000),FUNDC1(1:400)(美国,Millipore 公司),GAPDH(1:2 000)(中国,中衫金桥),4 ℃过夜。(7)TBST 清洗后滴加对应的二抗(中国,中衫金桥),浓度均为1:6 000,孵育2 h。(8)TBST 清洗后滴加发光液放入成像系统采集图片。所有蛋白结果用Gel-pro分析灰度值,所得结果用目的蛋白/内参计算比之后,每组数据再除以对照组,便于进行倍数比较。FUNDC1 抗体存在多条条带,根据说明书的要求,选取17kDa的条带进行分析。具体步骤参照相关文献操作[6]。
1.4.4 免疫共沉淀测定骨骼肌FUNDC1 与OPA1、CNX、DRP1 等蛋白的相互结合作用 (1)比目鱼肌加入IP 裂解液,进行剪碎匀浆并离心(12 000 g,4 ℃,10 min)。(2)PBS 稀释蛋白到1 ug/uL 的浓度,取1 mL量,加入1 uL 兔IgG,加入20 uL 的珠子混匀,2 h,4 ℃环境。(3)离心(14 000 g,4 ℃,10 min),取上清,弃沉淀。(4)加入抗体一FUNDC1(美国,Millipore公司),设置阴性对照组,4 ℃过夜。(5)加入30 uL 的珠子,4 ℃,2 h孵育,之后离心(14 000 g,4 ℃,10 min),保留沉淀,清洗后加入样缓,煮沸保存。(6)蛋白质免疫印迹实验,同Western Blot 实验方法。具体步骤参照相关文献操作[7]。
1.5 统计处理
采用SPSS19.0 统计软件分析,实验数据均以平均数±标准差(x±s)的形式表示。实验数据采用单因素方差分析(one-way ANOVA),方差齐性时用LSD 方法进行组内多重比较,方差不齐时采用Tamhanes’方法,P<0.05为差异具有统计学意义。
2 结 果
2.1 大负荷运动后不同时相下骨骼肌线粒体超微结构的变化
首先使用透射电镜,对运动及针刺后不同时相下骨骼肌线粒体超微结构进行观察发现,单纯进行运动,E2、E6 组线粒体明显肿胀变圆,结构不清晰,并出现少量疑似线粒体的片段;E12 组线粒体分布不均,出现大小不一的线粒体片段,2 μm 标尺下数量更为明显,线粒体结构出现更明显肿胀,部分膜结构不清晰,形状扭曲;E24 组肌原纤维间片段化的细小线粒体数量依然较多,线粒体的长条形态并不清晰,结构依然肿胀;E48 组线粒体细小片段数量已经明显观察到小于E12 组的表现,偶见多余数量的线粒体;E72 组未观察到明显的线粒体片段,但略有缺失(见图1)。
2.2 大负荷运动后不同时相下TOMM20 和DRP1 共定位的变化
激光共聚焦显微镜采集图像显示(见图2),蓝色荧光为细胞核,TOMM20 为线粒体膜标志蛋白,阳性表达呈绿色荧光,DRP1 为线粒体分裂标志蛋白,阳性表达呈红色荧光,TOMM20 和DRP1 发生共定位呈黄色,说明DRP1 蛋白转位到线粒体,阴性对照组红色和绿色荧光较少,黄色荧光未发现。采用IPP 图像分析软件对图像进行分析,以共定位百分比值表示TOMM20 和DRP1 共定位的量,组间同一时间点的相互比较详见表2。

图1 大负荷运动后不同时相下骨骼肌线粒体超微结构的变化Figure 1 Ultrastructural Changes of Skeletal Muscle Mitochondria under Different Phases after a Heavy-Load Exercise
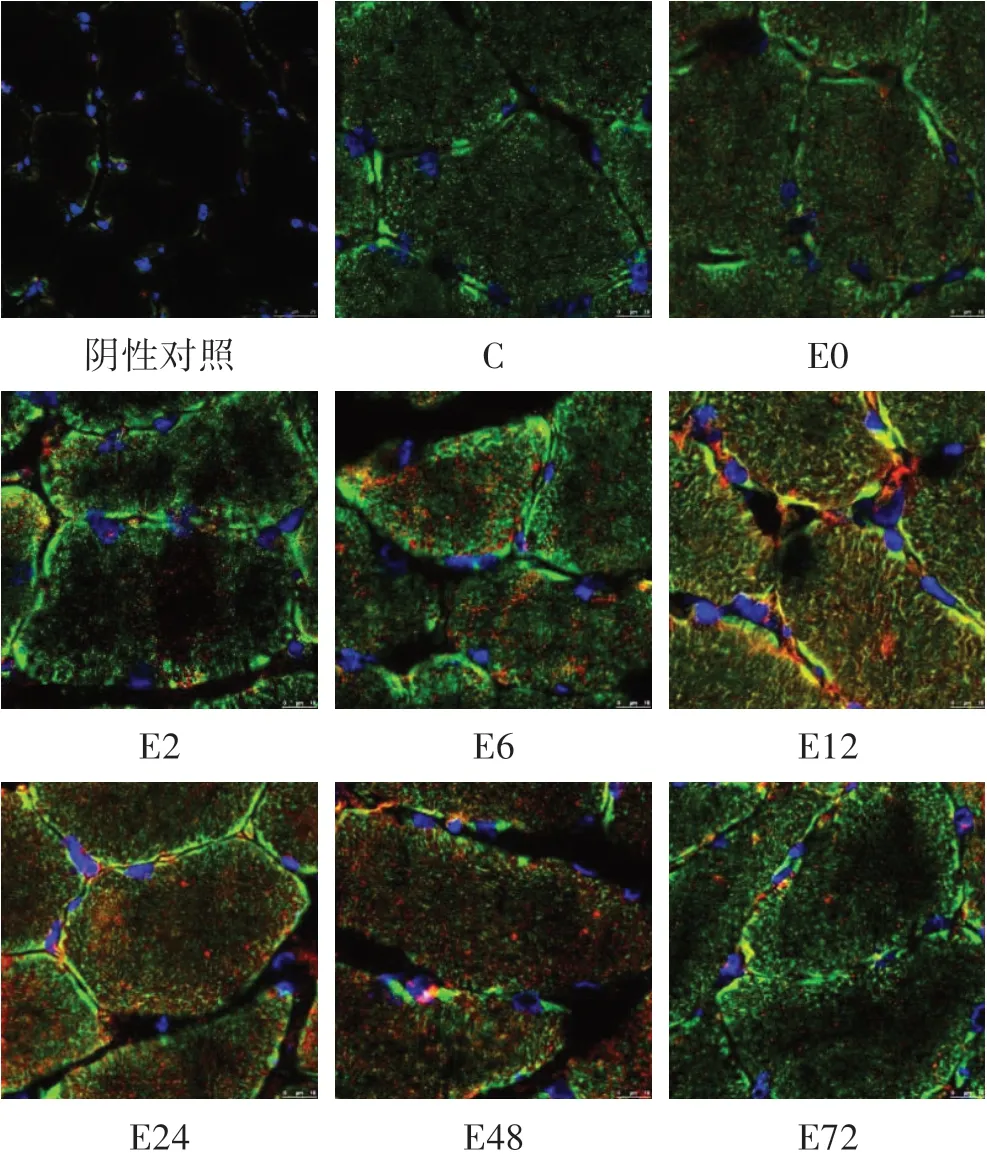
图2 运动后不同时相下骨骼肌TOMM20/DRP1共定位Figure2 The Colocalization of Skeletal Muscle TOMM20/DRP1 at Different Time Phase after Exercise
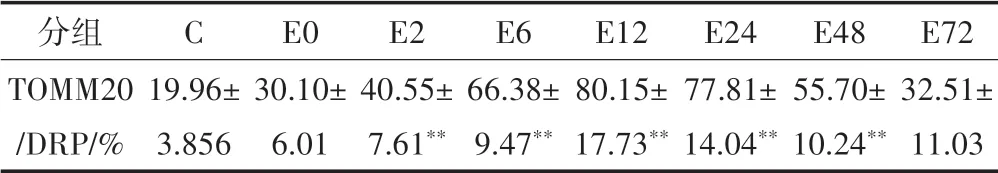
表2 运动后不同时相线粒体TOMM20/DRP1共定位比值变化(n=8)Table2 Changes in Co-Localization Ratio of Mitochondria TOMM20/DRP1 at Different Time Phases after Exercise(n=8)
2.3 大负荷运动后不同时相下线粒体DRP1蛋白变化
线粒体DRP1 蛋白的表达量是检测线粒体分裂程度的重要指标,Gel-pro分析软件对蛋白图像的分析显示,运动后不同时相呈现不同程度变化,运动后0 h 开始升高,在运动后12 h达到最高值并持续到24 h,之后出现降低现象,整体呈现为先升高再降低趋势。运动后0、2、6、12、24、48 和72 h 组与安静组相比差异均具有统计学意义(P<0.05或P<0.01)(见图3)。
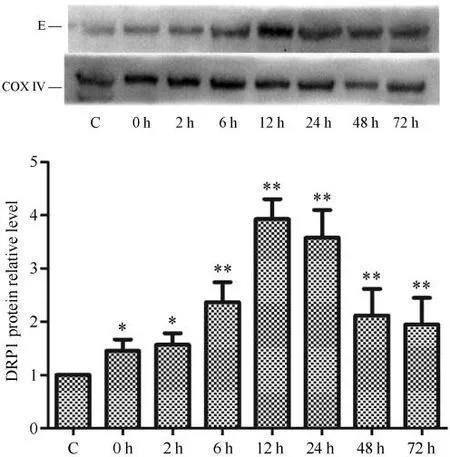
图3 运动后不同时相下骨骼肌线粒体DRP1蛋白表达Figure3 Expression of DRP1 in Skeletal Muscle Mitochondria at Different Phases after Exercise
2.4 大负荷运动后不同时相下骨骼肌FUNDC1蛋白表达量变化
Gel-pro分析软件对蛋白图像的分析显示,在运动后不同时相略有变化,但变化趋势不明显。单因素方差分析显示,运动未对FUNDC1指标产生显著影响(P>0.05),除运动后72 h 与安静对照组具有显著性差异外(P<0.05),其余时相差异均无统计学意义(P>0.05)(见图4)。
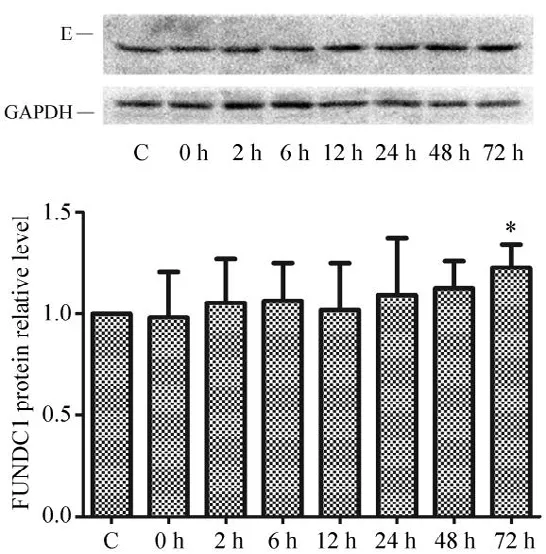
图4 运动后不同时相下骨骼肌FUNDC1蛋白表达Figure4 Expression of FUNDC1 in Skeletal Muscle in Different Phases after Exercise
2.5 大负荷运动后不同时相骨骼肌FUNDC1 与OPA1的相互作用
Gel-pro分析软件对蛋白图像的分析显示,在运动后不同时相下,FUNDC1与OPA1的结合呈不同程度变化,安静对照组最高,运动后即刻开始逐渐降低,在运动后12 h达到最低值,并持续到24 h,之后开始升高,整体呈现先降低再升高趋势。提示,骨骼肌FUNDC1 与OPA1 结合为安静时的正常状态。单因素方差分析结果显示,运动对FUNDC1/OPA1指标产生显著影响(P<0.01)。运动后所有时相组与安静对照组相比差异均有统计学意义(P<0.05 或P<0.01)(见图5)。
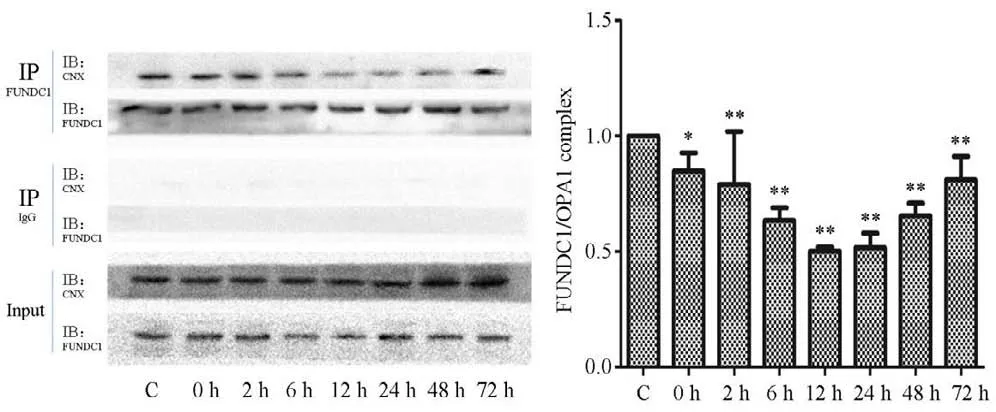
图5 运动后不同时相骨骼肌FUNDC1/OPA1蛋白结合量Figure5 The Binding Amount of FUNDC1/OPA1 in Skeletal Muscle of Different Phases after Exercise
2.6 大负荷运动后不同时相骨骼肌FUNDC1与CNX的相互作用
Gel-pro分析软件对蛋白图像的分析显示,在运动后不同时相下,FUNDC1与CNX的结合呈不同程度变化,运动后0 h 开始逐渐升高,在运动后2 h 达到最高值,6 h 虽有降低但依然显著高于安静对照组(P<0.01),之后开始降低,整体呈现为先升高再降低趋势,其峰值数值在FUNDC1/OPA1 结合之后。提示,运动后骨骼肌FUNDC1 后于CNX 结合。单因素方差分析结果显示,运动对FUNDC1/CNX 指标产生显著影响(P<0.01)。运动后0、2 和6 h 组与安静对照组相比差异均有统计学意义(P<0.01)(见图6)。
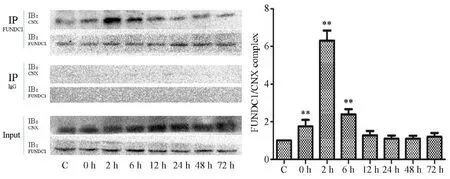
图6 运动后不同时相骨骼肌FUNDC1/CNX蛋白结合量Figure6 The Binding amount of FUNDC1/CNX in Skeletal Muscle of Different Phases after Exercise
2.7 大负荷运动后不同时相骨骼肌FUNDC1 与DRP1的相互作用
Gel-pro分析软件对蛋白图像的分析显示,在运动后不同时相下,FUNDC1 与DRP1 的结合呈不同程度变化,运动后0 h 开始逐渐升高,在运动后12 h 达到最高值并维持到24 h,两时相均值显著高于其他时相(P<0.01),之后开始降低,整体呈现先升高再降低的趋势,与线粒体DRP1 的趋势相似。单因素方差分析结果显示,运动对FUNDC1/DRP1 指标产生显著影响(P<0.01)。运动后6、12、24、48 和72 h 组与安静对照组相比差异均有统计学意义(P<0.05或P<0.01)(见图7)。
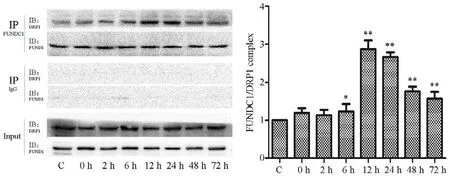
图7 运动后不同时相骨骼肌FUNDC1/DRP1蛋白的结合量Figure7 The Binding amount of FUNDC1/DRP1 in Skeletal Muscle of Different Phases after Exercise
3 分析与讨论
线粒体是维持生物体众多生理活动的基础,在ATP 生成过程中起到重要作用[9],线粒体分裂可以将受损线粒体从完整结构上分离下来,通过后续融合途径修复损伤或自噬途径清除受损部分,是维持线粒体质量的重要方式[10],决定线粒体的形态、数量及分布。
透射电镜可以观察骨骼肌线粒体超微结构。S.B.ONG[11]研究发现,在心脏缺血再灌注后线粒体心肌细胞出现线粒体片段化现象,有大量细小的线粒体存在,是线粒体分裂的直观证据,目前在骨骼肌中直接观察线粒体片段化现象的研究较少。实验室前期发现,大负荷运动后骨骼肌线粒体出现肿胀、嵴结构不清晰现象,在运动后一段时间逐渐加重[12],疑似和线粒体的分裂有关。为了验证一次大负荷运动后线粒体是否存在片段化现象,本实验首先使用透射电镜对运动后不同时相下骨骼肌线粒体超微结构进行观察。发现,一次大负荷运动后即刻骨骼肌线粒体未有明显的线粒体片段;运动后6 h 有线粒体肿胀、变圆,部分膜结构不清晰;运动后12 h 线粒体分布更不均匀,肌原纤维间积聚大量线粒体片段,出现不同体积的细小线粒体,此时线粒体片段化程度最为严重;运动后24 h肌原纤维间细小线粒体数量开始减少,虽然仍较大较圆但膜结构较清晰,嵴变多而密,片段化程度有所降低;运动后48 h 线粒体片段化程度远远小于运动后12 h的表现,可能此阶段线粒体融合能力远大于线粒体分裂能力,使得线粒体片段明显减少;运动后72 h 线粒体形态已经基本恢复到正常水平,肌原纤维间未观察到明显细小线粒体,但略有缺失。
透射电镜观察到线粒体明显的片段,说明可能存在线粒体分裂现象。为了进一步验证大负荷运动后骨骼肌线粒体是否出现分裂,本研究用TOMM20标记线粒体,并与线粒体分裂的重要指标蛋白DRP1 进行免疫荧光双标实验,共定位百分比增多则表明线粒体分裂现象加强。刘慧君[13]研究表明,对小鼠进行一次性中等负荷运动,DRP1 指标在运动1 和1.5 h 其mRNA 水平以及蛋白表达水平都出现升高现象,而线粒体融合蛋白出现降低,说明在运动过程中骨骼肌线粒体趋向于分裂。漆正堂[14]发现,8 周间歇训练可以明显降低线粒体膜DRP1 蛋白表达,提高线粒体融合蛋白Mfn2 表达,认为低强度的运动训练对各类蛋白均无影响。C.JAMART[15]研究发现,小鼠在禁食状态下进行低强度运动,发现DRP1在运动后明显增加,并且和饮食状态无关。A.GARNIER[16]研究发现,经过长期有氧运动训练后,骨骼肌线粒体氧化磷酸化能力明显增加,DRP1 基因表达也出现增高,进行长期的有氧训练可以提高骨骼肌线粒体Mfn2 和DRP1 表达。从以上研究可以发现,长期运动训练和一次性运动所得到的结果差异较大,并且不同的运动形式所检测的结果也存在一定偏差,说明运动对线粒体分裂的影响存在较多因素。以上研究中也同样存在一定不足,大多集中在骨骼肌细胞DRP1 的检测中,除漆正堂外均未进行线粒体膜上DRP1 的检测,可能真正转移到线粒体上的DRP1 才是发挥作用的重要部分。因此,本研究通过对线粒体外膜标记蛋白TOMM20 和DRP1 免疫荧光共定位,检测DRP1是否转位到线粒体上,并进行线粒体上DRP1 的Western Blot 半定量,明确线粒体分裂程度。实验结果表明,运动后共定位百分比增多,在12 h达到最高值,并持续到24 h,之后逐渐降低。
透射电镜和免疫荧光双标的实验结果均表明,在运动后骨骼肌线粒体出现分裂现象,但对于分裂的程度还不能准确的呈现。为了确定分裂程度,本研究使用Western Blot对线粒体分裂指标DRP1进行半定量检测。DRP1蛋白量检测发现,大负荷运动后0 h相比于安静对照组虽然未有明显差异,但均值已经开始增加,同样在12~24 h达到峰值,之后逐渐降低,72 h已接近安静对照组水平。实验结果均与电镜观察基本一致,说明一次大负荷运动可引起骨骼肌线粒体分裂。需要指出的是,在运动后72 h免疫荧光共定位和蛋白半定量分析的结果都高于安静对照组,但前者已经不具有显著性差异,后者却存在显著性差异,说明此时骨骼肌线粒体虽然出现恢复,但依然未完全达到安静时水平。出现不一致的原因可能是,免疫荧光共定位是多个切片统计的结果,在进行定量分析时存在一定误差,而Western Blot是骨骼肌线粒体整体浓度的计算,在细微差别上半定量的蛋白分析相比更为准确一些。通过以上结果可以发现,一次大负荷运动后骨骼肌线粒体的结构出现变化,并呈时相性变化,在12~24 h 分裂现象明显,同时线粒体的分裂蛋白也达到峰值,说明DRP1 是大负荷运动后骨骼肌线粒体分裂过程的重要参与蛋白。
线粒体分裂是复杂的生物过程,受一系列蛋白的精确调控。FUNDC1是一种哺乳动物中定位在线粒体上高度保守的跨膜蛋白,由155 个氨基酸构成[17],可与LC3 相互作用介导线粒体自噬,在调控线粒体分裂和自噬中发挥了重要作用[18]。在细胞实验中,用低氧或FCCP 处理后发现,FUNDC1 引起线粒体分裂[19-20]。V.D.BLIEK[21]研究指出,FUNDC1的长期调节是通过mi‐croRNA的表达实现的,而短时间的FUNDC1可以通过PGAM5 或是ULK1 来调节自身的磷酸化水平发挥作用。为了明确一次大负荷运动后骨骼肌线粒体分裂的过程是否和FUNDC1 蛋白的表达量有关,本研究中对FUNDC1 蛋白表达量进行了检测,发现在一次大负荷运动后,骨骼肌FUNDC1 蛋白在不同时相下变化趋势并不明显,运动并未对该蛋白产生显著影响。这和Bliek的研究结果类似,说明一次性的大负荷运动导致线粒体分裂增多可能并不是通过提高FUNDC1的表达量实现的,还需进一步研究。在运动后72 h,FUNDC1蛋白与安静对照组相比,出现显著升高,可能是由于运动所引起的因素更为广泛,与细胞实验单一干预处理所呈现的结果并不完全相同。但考虑到运动后DRP1的变化主要是在72 h 之前,并且在此前的时相中FUNDC1表达并未有明显变化,所以本研究认为,运动后FUNDC1 发挥作用并不是由于表达量的改变,而是通过其他方式导致运动后骨骼肌线粒体的分裂。
W.WU等[22]研究发现,FUNDC1是低氧刺激下线粒体片段化的必需蛋白,沉默FUNDC1或DRP1、CNX等蛋白均能发现线粒体延长。林春霞[23]研究发现,在低氧处理后的细胞线粒体分裂过程中,FUNDC1 和CNX、DRP1 出现相互作用,结合峰值的先后时序认为FUNDC1 招募DRP1 导致线粒体分裂。M.CHEN 等[24]通过FCCP或是亚硒酸盐处理细胞后诱导线粒体分裂,发现敲低FUNDC1后能够使FUNDC1与OPA1的结合下降,线粒体分裂现象减少,线粒体融合能力明显改善,同时也指出FUNDC1和OPA1在正常状态下通过带电荷的赖氨酸残基锚定在一起。由此发现,FUNDC1与OPA1、CNX、DRP1等蛋白相互作用引起了线粒体的分裂。根据以上文献研究结果推测,在大负荷运动后,FUNDC1与OPA1、CNX、DRP1等蛋白的结合可能是发挥作用的重要过程,因此本研究对这些蛋白进行了免疫共沉淀检测。发现,运动后蛋白结合的趋势变化非常明显,在不同时相下所结合蛋白量也具有明显差异,说明一次性大负荷运动后FUNDC1介导的线粒体分裂主要是与这些蛋白的结合作用实现,这和用FCCP处理的细胞实验中的结果类似。实验结果进行峰值时相比较发现,FUNDC1 与OPA1、CNX、DRP1 等蛋白峰值时相的数值也显著高于其他时相点,在峰值出现先后顺序上,安静状态和运动后0 h 时相点FUNDC1 与OPA1结合能力最强,在2 h和6 h时相点FUNDC1与CNX的结合最强,此时FUNDC1/OPA1 的结合能力已经开始下降,在12 h 和24 h 时相点FUNDC1 与DRP1 的结合能力达到最高,而此时相下FUNDC1/CNX、FUNDC1/OPA1等结合能力均已较低,说明FUNDC1/OPA1是正常状态下的结合形式。运动后,FUNDC1 开始与内质网蛋白CNX 暂时性结合,猜测此过程可能主要是把FUNDC1 聚集到内质网-线粒体结合部位,为下一步DRP1的聚集提供位点。之后FUNDC1与CNX逐渐分离,开始与DRP1 结合,并聚集DRP1 到线粒体与内质网连接部位,开始收缩切割完成线粒体分裂。
本研究通过透射电镜、免疫荧光、Western Blot、免疫共沉淀等发现,大负荷运动会导致线粒体出现分裂现象,且呈时相性变化,并初步明确其分裂过程主要是通过FUNDC1 与OPA1、CNX、DRP1 等蛋白的先后结合实现。建议在进行后续的相关研究时可着重对12~24 h 进行深入探究,也可尝试改变FUNDC1 与其他蛋白的结合程度,将进一步提高对线粒体自身修复和骨骼肌功能恢复的认识。
4 结 论
一次大负荷离心运动后,大鼠运动性骨骼肌损伤部位线粒体结构发生变化,出现分裂现象,分裂程度以及分裂蛋白DRP1 的表达均呈时相性的动态变化,在运动后即刻逐渐加剧,12、24 h最为明显,48、72 h逐渐恢复,其分裂的过程为运动后蛋白FUNDC1 与OPA1 分离,转而与CNX 结合,之后聚集DRP1 到线粒体上导致分裂发生。
