线粒体介导骨骼肌重塑在运动抵御癌症恶病质中的作用研究进展
2021-01-22漆正堂丁树哲
张 雪,漆正堂,丁树哲
(1.上海体育学院附属体育职业技术学院,上海200237;2.华东师范大学体育与健康学院,上海200241)
恶病质是一种复杂的多因素综合征,以进行性体质量下降及肌肉减少伴或不伴脂肪减少为特点,可导致进行性多器官功能损害,其中癌症恶病质最为常见,是20%肿瘤患者死亡的原因。现代久坐不动的生活方式破坏人们“离不开身体活动”的遗传天性,因此,肥胖、2 型糖尿病、肿瘤等代谢性疾病相继出现[1]。肿瘤恶病质以能量耗损、炎症、肌量流失为主要特征。运动可能弥补了现代生活“身体活动不足”的缺陷,使能量消耗水平与遗传基因匹配,同时阻止肌量流失,抑制癌症恶病质发生、发展[2]。抗阻训练、有氧训练或相互结合作为治疗癌症的运动手段在乳腺癌[3]、肺癌[4]、前列腺癌[5]和肝癌[6]的治疗中均有体现,在生理、病理、代谢、分子适应等方面也表现出积极影响。骨骼肌是运动作用的直接靶向器官,运动引起的骨骼肌一系列适应性反应通过某种直接或间接机制,抵抗癌症恶病质发展进程。众多研究[7-8]表明,恶病质状态下肌萎缩与线粒体呼吸链活性降低、线粒体解耦连蛋白增加和线粒体功能失调有关。诸多研究[9-10]也表明,运动可通过重编程骨骼肌线粒体,修复肌纤维进而防止肌萎缩。因此,本文推测运动可通过修复恶病质状态下的骨骼肌线粒体,重塑骨骼肌功能进而阻止癌症恶病质发生发展,以下将对其机制进行探讨。
1 癌症恶病质骨骼肌萎缩机制
1.1 能量耗损
癌症恶病质是典型的能量失衡症:能量摄入减少、消耗增多,静息代谢率提高,体质量下降。研究[11]发现:癌症患者的骨骼肌线粒体氧化磷酸化被抑制,线粒体氧化能力下降;线粒体膜流动性改变,线粒体功能受损。
过氧化物酶体增殖物活化受体γ 辅激活蛋白⁃1α(peroxisome proliferator ⁃ activated receptor gamma coactivator⁃1 alpha,PGC⁃1α)是目前已知调控线粒体生物发生最为关键的转录因子。PGC⁃1α 表达上调促进快肌纤维向慢肌纤维转化,对骨骼肌细胞钙循环进行调节;促进血管生成,提高骨骼肌的摄氧量、重塑神经肌肉接点;促进线粒体合成、脂肪合成和骨骼肌对葡萄糖的再利用,改善骨骼肌代谢[12]。肾衰竭恶病质中骨骼肌PGC⁃1α、线粒体转录因子(transcription factor A,Tfam)和线粒体融合蛋白(mitofusin⁃2,Mfn2)均下降,肌量下降同时伴随骨骼肌细胞自噬增加[11,13]。在肺癌鼠模型中发现,荷瘤后1 周小鼠腓肠肌PGC⁃1α蛋白表达量下降40%,视萎缩蛋白1(optic atrophy type 1,Opa1)下降45%;线粒体分裂蛋白1(mitochon‐drial fission 1,Fis1)蛋白表达量在荷瘤4 周后上升80%,线粒体动态平衡被打破[11]。在恶病质状态下骨骼肌线粒体自噬相关蛋白Bnip3 表达上调,线粒体生物发生PGC⁃1α 和线粒体融合蛋白Mfn2下调,线粒体分裂先于恶病质肌萎缩发生[11]。以上研究均表明,恶病质微环境中骨骼肌线粒体合成、线粒体动态平衡和线粒体自噬均发生紊乱,线粒体质量控制失衡。因此,在恶病质肌萎缩发生前重塑线粒体功能,可能是预防其发生的有效机制之一。
在恶病质状态下,骨骼肌线粒体ATP 生成减少,能量代谢稳态失衡。研究[14]发现,在肿瘤鼠模型中,骨骼肌ATP 合成速率下降,线粒体质子电化学梯度在恶病质微环境下被打乱。在正常情况下线粒体抑制肌质网Ca2+释放,调控钙释放单位的氧化还原反应。肌质网和线粒体的双向交流为Ca2+的释放和再摄取、ATP 的产生和再利用以及骨骼肌的生物合成提供了强有力的控制平台。在癌症发展期,骨骼肌钙泵处于激活状态,肌质网释放大量Ca2+,ATP消耗猛增。在癌症病理状态下因线粒体功能受损,氧化磷酸化被抑制,ATP 生成减少,肌质网 Ca2+⁃ATP 酶供应不足,肌质网摄取Ca2+能力下降,导致胞内Ca2+超载;同时,从肌质网释放到胞浆中的大量Ca2+向线粒体转运,迫使线粒体膜通透性转运孔(mitochondrial permeability tran‐sition pore,MPTP)过度开放,H+也随之进入线粒体基质,加剧ATP 合成障碍[15]。肌浆中钙超载,引起肌原纤维过度收缩,肌纤维断裂,进而发生肌萎缩[16]。可见,减缓肌质网Ca2+释放,避免线粒体Ca2+超载,是预防恶病质状态下骨骼肌能量耗尽和疲劳发生的重要机制[17]。
1.2 炎症反应
炎症反应也是癌症病人能量代谢异常的主要原因[18]。由感染等引发的炎症分为可控性炎症或急性、一过性炎症,以及非可控性炎症或慢性炎症。由病毒或细菌急性感染引起短暂的一过性炎症降低癌症的发生率是病原相关分子模式因子(pathogen⁃associated molecular patterns,PAMP)激活宿主模式识别受体,包括 Toll 样受体(toll⁃like receptors,TLR)、NOD 样受体(NOD⁃like receptor,NLR)和RIG⁃Ⅰ受体(RIG⁃I⁃like receptor,RLR)等,活化先天免疫并引发抗肿瘤T细胞反应,从而引发抗肿瘤免疫保护[19]。与之相反,慢性感染引发的非可控性炎症或慢性炎症,动物实验和临床分析均表明会引发多种肿瘤,如胃癌、肝癌、乳腺癌等[18]。炎症也是损伤相关分子模式(damage⁃associated molecular patterns,DAMP)激活的先天免疫反应,与肌少症密切相关[19]。与炎症相关的蛋白复合体感受PAMP 和 DAPM,激活Caspase⁃1,形成炎性体分子复合体,促进促炎因子白介素⁃1β(interleukin⁃1β,IL⁃1β)和白介素⁃18(interleukin18,IL⁃18)成熟及分泌,从而介导炎症的发生[20-21]。在恶病质状态下,骨骼肌线粒体 ROS 过量生成,诱导 NLRP3(NLR family,pyrin do‐main containing 3)和IL⁃1β 生成。线粒体DNA、线粒体融合蛋白、线粒体抗病毒信号通路(mitochondrial antiviral⁃signaling protein,MAVS)均调节 NLRP3 活性,募集炎性小体转位到线粒体[22]。受损线粒体在胞浆中循环,加入恶病质炎症微环境,促使肌细胞坏死。
诸多研究[23-24]表明,白介素⁃6(interleukin6,IL⁃6)在慢性疾病的炎症发展及引起骨骼肌功能紊乱中扮演重要角色。近年来,对于IL⁃6 的研究[25-26]已突破原有生理病理学的认识,认为IL⁃6作为内分泌因子在骨骼肌代谢过程中也起到非常重要的作用。IL⁃6 是多效应因子,同时具有促炎和抗炎效应[27]。在多个肿瘤模型中发现,IL⁃6 可激活骨骼肌信号转导、转录激活因子 3(signal transducer and activator of transcription 3,STAT3)和细胞外调节蛋白激酶(extracellular regu‐lated protein kinases,ERK1/2),调控骨骼肌线粒体稳态,进而调节肌细胞数量[28]。研究[29]发现,特异性敲除大鼠骨骼肌PGC⁃1α,骨骼肌组织和血浆中IL⁃6、肿瘤坏死因子α(tumor necrosis factor,TNFα)等促炎因子含量明显增加,说明PGC⁃1α可抑制炎症反应,但具体机制尚不明确。推测:PGC⁃1α 作为调控线粒体生物发生最为关键的转录因子,通过调节线粒体合成和线粒体融合,提升线粒体健康水平,抑制ROS⁃NLRP3炎性小体分泌IL⁃1β、IL⁃6 等促炎因子,从而抑制炎症反应。研究[30]发现,肿瘤发展期骨骼肌TNF⁃α、IL⁃1β和IL⁃6 还可通过ATP 依赖的泛素化通路加剧蛋白水解,引起肌萎缩。此外,肿瘤微环境下的炎症因子还可诱导一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达,线粒体大量一氧化氮(nitric oxide,NO)生成也可进一步抑制氧化磷酸化,破坏骨骼肌的收缩功能[30]。可见,线粒体功能异常导致的炎症反应在癌症恶病质肌萎缩中发挥着重要作用。
1.3 肌量流失
癌症恶病质机体蛋白降解增加、合成减少是恶病质最常见症状[31]。泛素-蛋白酶体系统(ubiquitin⁃proteasome system,UPS)是骨骼肌蛋白水解的重要通路,也是癌症恶病质骨骼肌消耗的主要途径[32]。基因测序表明,癌细胞基因组中存在多个基因发生点突变,致使蛋白质编码序列改变多个突变蛋白表达[33]。大量突变蛋白的存在致使正常的泛素化调控蛋白降解变得异常活跃,原有的蛋白质合成机制被打破,正常蛋白质复合体的形成受影响,最终触发泛素化介导其降解[34]。在依赖 ATP 的泛素⁃蛋白酶体中,E3 泛素连接酶附着于赖氨酸残基上,通过靶向26S 蛋白酶体促进肌肉蛋白水解[35]。肌萎缩盒F蛋白⁃1(Atrogin⁃1)和肌肉特异性环指基因1(muscle⁃specific ring finger 1,MURF1)是E3 泛素连接酶的主要组分,激活促进底物蛋白的泛素化,促使更多蛋白转运到蛋白酶体降解,发生肌萎缩,是癌症恶病质骨骼肌萎缩的重要标记物[36]。胃癌病人泛素化蛋白mRNA 表达是对照组的2~3 倍,细胞内大量蛋白被UPS 降解,肌量流失,引起肌肉萎缩[37-38]。
相关研究[39-40]表明,Atrogin⁃1 和 MURF⁃1 在癌症恶病质患者及动物模型中均表达升高,促进骨骼肌蛋白降解,促使肌发生萎缩。临床研究[41]发现,胃癌病人的泛素化蛋白mRNA 表达是对照组的2~3 倍,体质量低于对照组8%~13%。即使在炎症疾病中,肿瘤坏死因子⁃α(tumor necrosis factor,TNF⁃α)也可通过上调泛素载体蛋白(UbcH2/E220k)提高UPS 活性,促进骨骼肌蛋白分解代谢[42]。其原理是 TNF⁃α 与表面受体结合,激活 NF⁃kB 通路,编码 Atrogin⁃1 和 MURF1基因转录,降解肌原纤维[43],而 NF⁃kB 通路又可通过E3 泛素系统保持线粒体完整性防止细胞凋亡[44]。研究[45]发现,在心肌线粒体的MURF1调节氧化反应;在对 MURF1 肌细胞定位的研究[46]中发现,转染后的MURF1 多定位在线粒体碎片上。可见,泛素化蛋白修饰与线粒体受损密切相关。
恶病质状态下骨骼肌蛋白除分解代谢加强外,合成代谢减少也是恶病质肌萎缩的原因。胰岛素促进氨基酸向骨骼肌转运,增加骨骼肌蛋白合成和抑制蛋白降解;胰岛素敏感性降低影响骨骼肌对氨基酸的摄取,抑制蛋白质合成[47]。胰岛素样生长因子⁃1(insulin⁃like growth factor,IGF⁃1)是又一重要蛋白调节因子。研究[48]发现,IGF⁃1 所产生的多种生物学效应主要是通过激活磷脂酰肌醇3 激酶(phosphatidylinoskol 3⁃kinase,P13K)/Akt 信号通路发挥作用,而 Akt 激活能维持线粒体的正常功能,进而调节蛋白转运和合成。癌症恶病质骨骼肌IGF⁃1 表达下调,蛋白合成速率降低[49];转基因鼠过表达的IGF⁃1 可抑制蛋白泛素化调节的肌萎缩[50],均可能与恶病质状态下线粒体稳态被打破有关,有待进一步研究。
此外,在癌症恶病质全身炎性反应状态下,IL⁃6水平升高可诱导泛素-蛋白酶体系统引起骨骼肌蛋白降解,同时增加解偶联蛋白表达,引起能量消耗。升高的 IL⁃6 参与了 UPS 的激活[51],进而诱导 E3 泛素连接酶Atrogin⁃1和MURF⁃1表达相应增加,而在线粒体膜上也存在包括 Atrogin⁃1 和 MURF⁃1 在内的多种泛素连接酶。研究[52]发现,在细胞质内加入蛋白酶体抑制剂后线粒体膜上的UCP2、UCP3 异常增加,而解偶联蛋白UCP2、UCP3 介导的质子泄漏现象,使线粒体电子传递产生的质子电化学势能被质子漏消耗,破坏膜两侧的电化学梯度,将质子电化学势能转化为热量散失,引起能量消耗和代谢紊乱,促进癌症恶病质的形成[53]。研究[54]发现,接种腹水瘤后大鼠骨骼肌中的UCP2 和UCP3 mRNA 水平明显升高,在结肠癌、乳腺癌患者中也发现其表达上调。
以上研究表明,癌症恶病质骨骼肌能量耗损、炎症反应与肌量流失均与线粒体异常有关。同时,能量代谢紊乱、促炎因子的分泌和蛋白降解以线粒体为中枢形成肿瘤微环境相互影响,加快肌细胞凋亡和肌纤维损伤,加重恶病质肌萎缩发展。因此,修复恶病质状态下线粒体结构与功能,重塑线粒体健康网络,是抵御癌症恶病质的关键,而运动很可能是修复癌症恶病质状态下骨骼肌异常线粒体的重要手段。
2 运动通过线粒体质量控制重塑骨骼肌
线粒体是双层膜包裹的细胞器,在真核细胞中扮演重要角色,它是脂肪酸氧化、三羧酸循环和氧化磷酸化等重要生理生化过程发生的主要场所。线粒体处于持续动态变化,对维持细胞功能至关重要,如能量代谢和细胞凋亡等。线粒体的融合和分裂被认为是调节线粒体网络健康程度的重要保障。处于应激状态或受损的线粒体需被标记并选择性地降解,以防止其与健康的线粒体整合。功能异常的线粒体会影响生物合成通路,使细胞产生过量的ROS 并激活细胞调亡通路。线粒体质量控制即线粒体生物发生、线粒体动态变化(融合与分裂)和线粒体自噬可确保线粒体数量及质量的相对稳定[55]。在肿瘤细胞中,激活的PGC⁃1α 引起线粒体呼吸加强,激活无效循环,促使能量消耗增加[56];但在恶病质中,骨骼肌PGC⁃1α、线粒体转录因子(transcription factor A,Tfam)和线粒体融合蛋白(mitofusin⁃2,Mfn2)均下降,肌量下降还伴随着骨骼肌细胞自噬的增加[11,13]。可见,在恶病质环境中线粒体质量控制相关基因在肿瘤与骨骼肌中差异化表达。骨骼肌细胞是终末分化细胞,不具有无限增殖分化能力,不发生癌变。骨骼肌是运动作用的直接器官,运动应激下骨骼肌线粒体“重生”进而重塑骨骼肌功能可能是运动抵御恶病质肌萎缩的重要机制。修复恶病质状态下线粒体,关键在于重建线粒质量控制。
2.1 PGC⁃1α介导骨骼肌线粒体质量控制与运动
运动可通过上调PGC⁃1α 重构Ca2+转运,促使骨骼肌PGC⁃1α降低肌钙蛋白表达进而诱导肌质网减少Ca2+释放,促进快肌纤维向慢肌纤维转化,增强骨骼肌线粒体有氧氧化能力[57]。Padrao 等[58]研究发现,35 周中等强度跑台训练后,乳腺癌鼠骨骼肌PGC⁃1α 表达上调,氧化磷酸化增强,骨骼肌ATP 合成速率增加。在癌症恶病质发展进程中,糖酵解增强、乳酸生成增多,骨骼肌线粒体结构与功能被破坏[59]。在肥胖、糖尿病、癌症恶病质病理发展早期阶段,均发现骨骼肌乳酸生成增多,能量代谢异常[60-61]。Serge等[62]研究发现,在肌肉收缩过程中,PGC⁃1α 可抑制糖酵解,减少乳酸生成,抑制瓦博格效应(Warburg effect)。在运动应激条件下,细胞质中的PGC⁃1α 移位至细胞核内并通过与NRF1 和NRF2 共同转录线粒体组成蛋白及线粒体转录因子A(mitochondrial transcription factor A,Tfam),而Tfam 是参与线粒体DNA 复制、转录以及拟核形成的重要因子。另外,在运动应激下,PGC⁃1α 移位至线粒体并与Tfam 结合形成复合物,从而促进线粒体DNA 的转录和复制。由此可见,运动可通过PGC⁃1α 增加线粒体数量和质量,增强骨骼肌有氧氧化能力,抑制乳酸生成,重建良性的肌细胞生成环境,抵御恶病质肌萎缩。
运动还可调节线粒体自噬重塑骨骼肌功能。耐力联合抗阻运动降低LC3B⁃I/II 比例,通过调节线粒体自噬,增强线粒体功能,增加骨骼肌肌量[63]。另一项比较化疗与中等强度运动在抵抗癌症恶病质肌萎缩的研究发现,早期进行运动干预可逆转因恶病质引起的骨骼肌线粒体自噬增加,恢复线粒体功能,增加骨骼肌肌量和肌力[64]。同一课题组研究还发现,中等强度运动预防恶病质肌量流失与运动引起的低水平骨骼肌氧自由基(Reactive Oxygen Species,ROS)、羧蛋白和线粒体自噬流相关[65]。Pin 等[66]研究发现,低强度耐力运动后荷瘤组小鼠骨骼肌PGC⁃1α mRNA和蛋白表达均显著上升,自噬相关蛋白表达LC3B 和Bnip3 显著下降,受损线粒体被清除,线粒体结构和功能恢复,肌量流失减少。可见,运动可通过PGC⁃1α调节线粒体自噬清除损伤线粒体,修复恶病质状态下骨骼肌受损线粒体,进而恢复肌肉功能。
2.2 IL⁃6、泛素化介导线粒体质量控制与运动
IL⁃6 是调节恶病质状态下骨骼肌线粒体质量重塑的重要因子。研究发现,有规律的运动让恶病质状态下的骨骼肌,即使IL⁃6过表达也不会发生肌量丢失和代谢紊乱[67]。癌前期患者体质量下降,过表达的IL⁃6促使骨骼肌PGC⁃1α和线粒体融合蛋白Mfn1、Mfn2表达下调,线粒体数目未发生变化;在癌变过程中,线粒体分裂蛋白FIS1表达上调,线粒体内容物减少。在IL⁃6 诱导恶病质模型中发现,虽然血液循环中保持高水平的IL⁃6,中等强度运动可逆转因IL⁃6 诱导引起的线粒体失调,抑制恶病质发展[68]。即使在非恶病质状态下,IL⁃6 也可直接激活骨骼肌 DRP⁃1 和 FIS1 表达[69]。以上研究表明,运动并未通过降低IL⁃6水平抑制炎症,但可逆转因IL⁃6 引起的线粒体功能异常,重塑恶病质状态下的骨骼肌。运动似乎可使骨骼肌对恶病质炎症环境“脱敏”,让骨骼肌不被其肿瘤微环境影响,进而恢复肌细胞各组件包括线粒体的正常运转。这可能与IL⁃6 是多效应影响因子有关,IL⁃6 同时具备“促炎”和“抗炎”效应。在恶病质发生发展期,IL⁃6 促进炎症反应;运动干预后,IL⁃6 转变角色,抑制炎症反应。运动如何让IL⁃6“化弊为利”,具体机制有待进一步研究。
此外,研究[70]显示,规律运动可显著降低机体UPS 活性,抑制 MuRF1 和 MAFbx 的表达及骨骼肌蛋白降解,改善骨骼肌萎缩。有氧训练抑制骨骼肌蛋白泛素化,逆转因恶病质引起的肌萎缩[70-72]。抗阻运动降低骨骼肌泛素化相关基因atrogin⁃1 和MuRF⁃1 mRNA 表达,减缓肌萎缩速度[73]。低强度运动通过抑制UPS 通路,增加低氧诱导因子(hypoxia⁃inducible factor⁃1alpha,HIF⁃1α)和磷酸化腺苷酸活化蛋白激酶(AMP activated protein kinase,AMPK),阻止因癌症恶病质引起的肌量流失[74]。AMPK 是一种保守的细胞和线粒体能量感受器,能磷酸化丝氨酸/苏氨酸蛋白激酶⁃失调 51 样激酶⁃1(uncoordinated 51 like kinase⁃1,ULK⁃1),而后者是启动细胞自噬和线粒体自噬的关键调控分子。泛素-蛋白酶体系统还可通过调节线粒体蛋白质更新(turnover)和/或蛋白活性控制线粒体的蛋白质平衡,这也是线粒体质量控制的一种重要机制。UPS 受损和线粒体功能失调均与癌症显著相关,有效的UPS 对于维持线粒体健康至关重要。目前关于线粒体蛋白泛素化在恶病质肌萎缩中的研究较少,基于泛素化通路在维持线粒体健康中的作用以及运动抑制骨骼肌泛素化,从而阻止肌萎缩的研究基础,将来可进行运动介导蛋白泛素化在修复恶病质状态下线粒体功能的作用研究,进一步明确运动的抗癌机制。
总之,虽运动精准治疗癌症的具体运动效应尚未明确,美国癌症协会仍建议癌症病人治疗期每周进行150 min 中等强度或75 min 高强度运动。癌症恶病质患者仍可通过运动提高肌力和体能,阻止体质下降。本文总结线粒体介导运动抵御癌症恶病质肌萎缩的作用机制见图1。
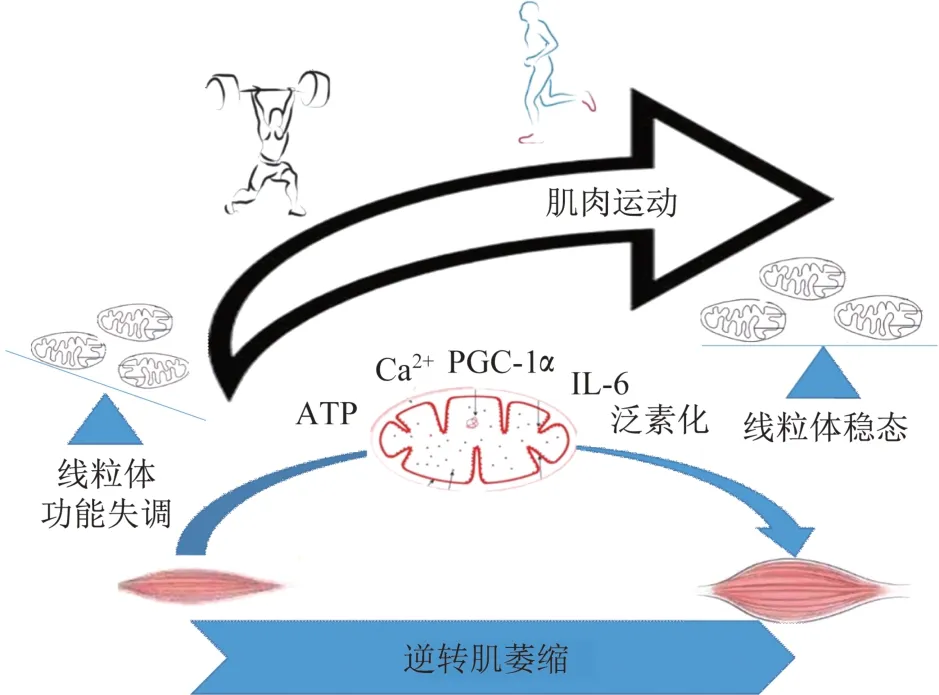
图1 运动促进恶病质状态下线粒体骨骼肌稳态Figure 1 Increased muscle use improves skeletal muscle mitochondrial homeostasis in cachectic conditions
3 结论与展望
近年来,骨骼肌线粒体在恶病质肌萎缩中的作用逐步成为新的研究靶点,癌症恶病质状态下骨骼肌线粒体功能异常引起能量代谢异常、炎症反应和肌量流失。在恶病质微环境中,运动可通过重塑线粒体保持骨骼肌代谢稳态和逆转肌萎缩,但仍有以下问题有待解决:①运动中生成的乳酸与肿瘤细胞的代谢产物乳酸,对骨骼肌和肿瘤的代谢意义不尽相同;②蛋白泛素化在恶病质肌萎缩发生发展中起着关键作用,在维持线粒体功能中也发挥作用,运动如何调控线粒体泛素化进而阻止恶病质状态下肌萎缩发生,需进一步探明。同时,运动干预作为治疗手段也面临巨大的挑战,在癌症发展早期,为癌症恶病质患者提供个性化且有效的靶向运动方案,进行基于运动反应组学分析的精准运动干预极为重要。
作者贡献声明:
张 雪:提出论文主题,设计论文框架,撰写、修改论文;
漆正堂:审核、指导修改论文;
丁树哲:提出选题思想。
