米诺环素对脂多糖诱导的肺微血管内皮细胞炎症损伤的抑制作用
2021-01-22吴伟斌林欣雨祝春燕
罗 超,吴伟斌,林欣雨,祝春燕
(绍兴文理学院1.元培学院,3.附属医院,浙江 绍兴 312000;2.肇庆医学高等专科学校,广东 肇庆 526020)
急性肺损伤(acute lung injury,ALI)是一类临床高发病率、高死亡率的肺部炎症性疾病,其发病与过度炎症反应、败血症、气体交换受损、肺泡毛细血管屏障破坏和肺水肿等密切相关[1-2]。研究表明,ALI的发病机制主要为活性氧簇(reactive oxygen species,ROS)的积累以及过度的氧化应激和炎症反应,其分子机制可能与炎症信号的激活有关,如丝裂原活化蛋白激酶、蛋白激酶和NF-κB信号通路等[3-4]。肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMEC)是肺气血交换的物质基础,也是肺部最早受到炎症攻击的效应细胞[5]。炎症刺激一方面增加PMEC细胞壁的通透性,引起肺部蛋白渗出及水肿;另一方面,炎症损伤的血管内皮细胞大量分泌肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin 6,IL-6)、IL-8和细胞间黏附分子1(intercellular cell adhesion molecule-1,ICAM-1)等炎症细胞因子,进一步攻击肺组织并诱导大量中性粒细胞的聚集,导致肺组织的氧化损伤和炎症反应,促进肺损伤的发展[6-7]。
多聚(ADP-核糖)聚合酶-1〔poly(ADP-ribose)polymerase-1,PARP-1〕对炎症反应具有直接促进作用,参与NF-κB等多种炎症信号传导通路的调控,促进多种炎症因子的表达和释放[8],在脑膜炎、结肠炎、肾炎、关节炎和慢性阻塞性肺疾病等多种炎症性疾病的发生发展过程中起到重要的作用[9]。米诺环素(minocycline)是一种半合成的第二代四环素类抗生素,临床上被广泛用于治疗各种感染性及炎症疾病,在各类支气管肺炎、细菌性肺炎等治疗中也有应用。近年来,多项研究显示,米诺环素具有明显的PARP-1抑制作用,如米诺环素可通过抑制PARP-1而保护缺血再灌注心肌细胞的炎症损伤[10-11]。本研究以脂多糖(lipopolysaccharide,LPS)诱导的肺微血管内皮细胞为炎症模型,研究其通过调控PARP-1通路对ALI发病过程中肺微血管内皮细胞炎症损伤的抑制作用,并探讨其抗炎作用机制。
1 材料与方法
1.1 药物、试剂和仪器
米诺环素,大连美仑生物技术有限公司。M131培养基、胎牛血清、谷氨酰胺和微血管细胞生长因子(microvascular growth supplement,MVGS),美国Gibco公司;LPS,美国Sigma公司;CCK-8检测试剂盒和ROS检测试剂盒,上海碧云天生物;TNF-α、IL-6、IL-8和ICAM-1 ELISA检测试剂盒,深圳达科为生物技术有限公司;BCA蛋白定量试剂盒和ECL发光液,杭州弗德生物;兔抗人PARP-1、磷酸化P65(phosphoralated p65,p-P65)、磷酸化IκB激酶β(phosphorilated IκB kinase β,p-IKKβ)和磷 酸化抑制蛋白 κB(phosphorilated inhibitor of κB,p-IκBα)多克隆抗体购于美国Affinity Biosciences公司;辣根过氧化物酶标记的山羊抗兔IgG抗体,美国Jackson Immuno Research公司。生物倒置显微镜,日本Olympus公司;CO2细胞培养箱和多功能酶标仪,美国Thermo Scientific公司;电泳仪及转移装置,美国Bio-Rad公司;流式细胞仪,美国Beckman公司。
1.2 细胞和分组
人PMEC(HPMEC-ST1.6R)[12],德国美因兹大学病理研究所,培养于含20%胎牛血清、谷氨酰胺2 mmol·L-1和5% MVGS的M131培养基,置5% CO2,37℃培养箱中培养,2~3 d换液1次,待细胞生长至70%~80%融合度后进行传代,4~6 d传代1次。
据文献和预实验结果[13-14],将实验细胞分为4组,即细胞对照组、LPS组(LPS 10 mg·L-1作用24 h),LPS+米诺环素10和25 μmol·L-1组(米诺环素和LPS 10 mg·L-1同时加入,作用24 h)。
1.3 CCK-8法检测细胞存活率
调整细胞密度为1×108L-1,加入96孔板内,每孔100 μL,置 37℃,5% CO2培养箱培养 24 h后按1.2分组加药处理;作用24 h后,每孔加入CCK-8试剂20 μL,置细胞培养箱内继续孵育;4 h后用酶标仪于450 nm测定吸光度(A450nm)值,计算细胞存活率。存活率(%)=(加药组A450nm-空白A450nm)/(细胞对照组A450nm-空白A450nm)×100%。
1.4 ELISA检测炎症因子水平
调整细胞密度为1×108L-1,加入96孔板内,每孔100 μL,置37℃,5% CO2培养箱培养24 h后,按1.2分组加药处理,作用24 h,收集细胞上清液,采用ELISA测定细胞培养液中TNE-α,IL-6,IL-8和ICAM-1水平。按试剂盒说明操作,酶标仪测定A450nm值,根据标准曲线计算炎症因子浓度。
1.5 流式细胞仪检测ROS水平
每孔1×106细胞接种6孔板,按1.2分组加药处理24 h后,细胞收集后悬浮于终浓度为10 μmol·L-1的DCFH-DA中,37℃细胞培养箱内孵育20 min,孵育完毕后用不含血清培养基洗涤细胞3次,流式细胞仪检测,以DCF荧光强度反映细胞内ROS水平。
1.6 Western印迹法检测PARP-1,p-P65,p-IKK β和p-I κB α蛋白表达水平
每孔1×106细胞接种12孔板,按1.2分组加药处理24 h后,收集各组细胞,用RIPA裂解液裂解细胞,离心取上清,以BCA蛋白定量试剂盒测定总蛋白浓度,然后进行SDS-PAGE电泳分离蛋白并转膜,5%脱脂奶粉封闭1 h,兔抗人PARP-1,p-P65,p-IKKβ和p-IκBα多抗(1∶1000)4℃孵育过夜;洗膜后,室温下加辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶5000)孵育1 h,最后通过ECL化学发光法显影成像,利用Image J软件进行蛋白相对积分吸光度分析,以β肌动蛋白为内参,以目标蛋白与β肌动蛋白积分吸光度值比值表示PARP-1,p-P65,p-IKKβ和p-IκBα蛋白相对表达水平。
1.7 统计学分析
2 结果
2.1 米诺环素对LPS诱导的人肺微血管内皮细胞存活率的影响
CCK-8实验结果(图1)显示,与细胞对照组相比,LPS组细胞存活率显著降低(P<0.01);与LPS组相比,LPS+米诺环素10和25 μmol·L-1组细胞存活率显著升高(P<0.01)。
2.2 米诺环素对LPS诱导的人肺微血管内皮细胞TNE- α,IL-6,IL-8和ICAM-1释放的影响
如图2所示,LPS 10 mg·L-1损伤使PMEC出现明显的炎症反应,与细胞对照组相比,细胞培养液中TNE-α,IL-6,IL-8和ICAM-1含量显著升高(P<0.01)。与LPS组相比,LPS+米诺环素10和25 μmol·L-1组细胞培养液中TNE-α,IL-6,IL-8和ICAM-1含量显著降低(P<0.01),提示米诺环素10和25 μmol·L-1对LPS诱导的肺微血管内皮细胞炎症损伤有保护作用。

Fig.1 Effect of minocycIine on ceII viabiIity of human puImonary microvascuIar endotheIiaI ceIIs(hPMECs).Cells were protected by minocycline 10 and 25 μmol·L-1and treated with LPS 10 mg·L-1for 24 h.±s,n=5.**P<0.01,compared with cell control group;##P<0.01,compared with LPS group.
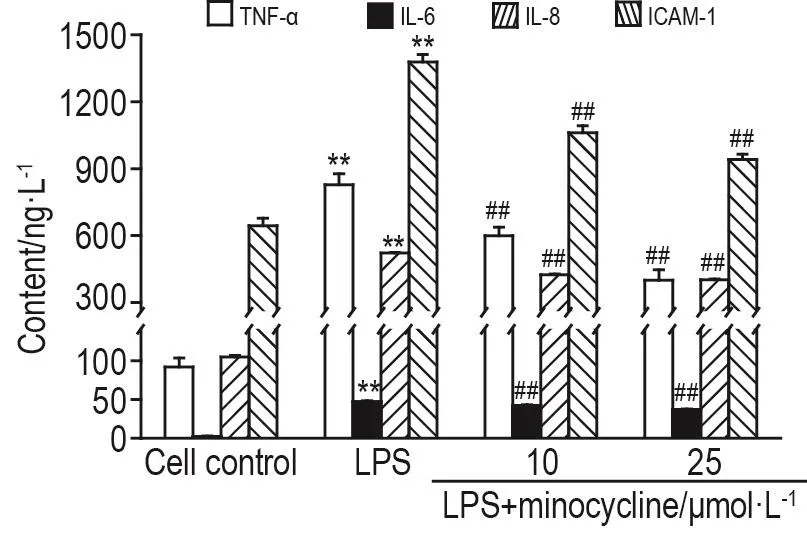
Fig.2 Effect of minocycIine on tumor necrosis factorα(TNF- α),interIeukin-6(IL-6),IL-8 and interceIIuIar ceII adhesion moIecuIe-1(ICAM-1)reIease in hPMECs induced by LPS.See Fig.1 for cell treatment.±s,n=5.**P<0.01,compared with cell control group;##P<0.01,compared with LPS group.
2.3 米诺环素对LPS诱导的人肺微血管内皮细胞ROS生成的影响
流式细胞术结果显示(图3),与细胞对照组相比,LPS刺激诱导PMEC ROS表达升高(P<0.01)。与LPS组相比,LPS+米诺环素10和25 μmol·L-1组细胞ROS水平显著降低(P<0.05)。
2.4 米诺环素对LPS诱导的人肺微血管内皮细胞PARP-1,p-P65,p-IKK β和p-I κB α蛋白表达的影响
Western印迹法结果显示(图4,图5),与细胞对照组相比,LPS损伤能显著增加PARP-1蛋白表达(P<0.01),并使NF-κB通路磷酸化激活,p-IKKβ,p-IκBα和p-P65蛋白表达升高(P<0.01)。与LPS组相比,LPS+米诺环素10和25 μmol·L-1组能够显著抑制LPS诱导的细胞PARP-1蛋白表达和NF-κB通路激活(P<0.01)。

Fig.3 Effect of minocycIine on reactive oxygen species(ROS)IeveI in hPMECs induced by LPS.See Fig.1 for cell treatment.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with LPS group.
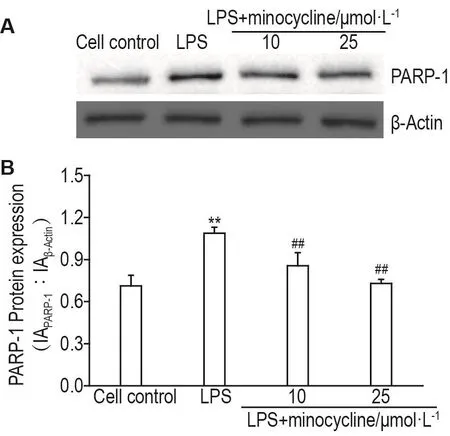
Fig.4 Effect of minocycIine on protein expression of poIy(ADP-ribose)poIymerase-1(PARP-1)in hPMECs induced by LPS detected by Western bIotting.See Fig.1 for cell treatment.IA:integrated absorbance.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with LPS group.

Fig.5 Effect of minocycIine on protein expressions of phosphoriIated IκB kinase β (p-IKK β),phosphoriIated inhibitor of kappa B (p-I κB α),and phosphoriIated P65(p-P65)in hPMECs induced by LPS detected by Western bIotting.See Fig.1 for cell treatment.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with LPS group.
3 讨论
肺部过度炎症反应是ALI的主要病理机制,PMEC是肺气血交换的物质基础,也是肺部最早受到炎症攻击的效应细胞,失控的炎症反应导致PMEC损伤凋亡,通透性增加,继而破坏肺泡-毛细血管屏障,导致大量富含蛋白质的液体渗出而引起肺水肿。此外,肺泡-毛细血管屏障的破坏是各类炎症细胞向肺组织移行、富集的基础[15-17]。可见,控制PMEC炎症损伤,抑制其凋亡和通透性增加,可有效缓解ALI肺水肿的发生和发展,并可抑制炎症细胞向肺组织富集。
炎症因子是炎症发展过程中的重要介质,受到炎症损伤PMEC可分泌大量促炎因子(TNF-α和IL-6等)、趋化因子(IL-8等)和黏附分子(ICAM-1等)。TNF-α和IL-6都是重要的早期炎症损伤因子,TNF-α是炎症的重要启动子,是ALI最先出现的细胞因子,可诱导IL-6和IL-8等炎症因子的分泌,促进炎症反应;IL-6是最强内源性炎症因子,在ALI中,IL-6可直接损伤内皮细胞,导致血管通透性增加[5,18]。IL-8和ICAM-1对ALI发展过程中中性粒细胞的激活及向肺组织聚集具有重要的影响,中性粒细胞的激活、黏附、趋化、迁移和脱颗粒均可导致相应的肺泡功能损伤,并进一步通过释放多种介质加重肺损伤[19-20]。本研究结果显示,米诺环素可抑制LPS诱导的PMEC TNF-α,IL-6,IL-8和ICAM-1等炎症因子的释放,缓解细胞炎症损伤,抑制细胞凋亡,可有效缓解ALI发病过程中的进一步炎症级联扩大反应,中性粒细胞聚集和肺组织损伤等,对ALI的病情发展起到延缓和治疗作用。许多研究表明,ROS对ALI的发病机制具有重要的影响,炎症过程中ROS的增加在ALI全身性炎症反应的发展和局部表现中均发挥了重要作用[21-22]。血管内皮细胞的氧化应激与其炎症损伤和细胞凋亡密切相关,过度表达的ROS一方面破坏了体内氧化与抗氧化的平衡,造成细胞的损伤与凋亡[23];另一方面,细胞的氧化应激又是PARP-1活化的关键因素,继而进一步激活一系列的炎症反应[24]。本研究发现,米诺环素对LPS诱导的肺微血管内皮细胞ROS表达具有显著的抑制作用,可通过对ROS表达的调控继而抑制ALI过程中PMEC的氧化应激损伤和PARP-1活化。
PARP-1与许多调控炎症基因表达的转录因子密切相关,如 NF-κB、NF-AT、活化蛋白-1、沉默信息调节因子1和核呼吸因子-1等[8,25]。NF-κB是第一个被阐述与PARP-1调控炎症相关的转录因子,NF-κB激活也是PARP-1调控炎症的中心途径,活化的PARP-1可激活IKKβ,使其磷酸化生成p-IKKβ,活化的IKK-β 可继而磷酸化 IκB,使其从NF-κB三聚体(P65/P50/IκBα)上脱落,使得NF-κB由抑制状态被激活,NF-κB的P65亚基磷酸化(p-P65)并进入细胞核与DNA上特异性位点结合,调节免疫、炎症等多种靶基因的表达[26-29]。Western印迹结果表明,米诺环素可通过抑制LPS诱导的PMEC PARP-1表达,继而抑制IKKβ和IκBα的磷酸化激活,最终抑制了P65的磷酸化激活,从而下调ALI细胞NF-κB信号通路,抑制细胞炎症损伤和炎症因子的表达。
综上所述,米诺环素可通过抑制PARP-1的表达,从而抑制IKKβ的磷酸化激活,继而导致IκB不能磷酸化活化,无法从NF-κB三聚体上脱落,最终抑制NF-κB的活化,从而抑制LPS诱导的PMEC的一系列炎症反应,有望成为ALI等肺部炎症性疾病治疗的新选择,其抗炎作用机制及对ALI动物模型的治疗作用待深入研究。
