喜树碱类药物纳米递送系统的构建研究
2021-01-22简娜
简娜
( 广东省轻工业技师学院,广东 广州510000)
近年来肿瘤疾病的发病率不断增加,成为危害人类生命健康的重要疾病之一,每年有诸多人群死于癌症,因此应对癌症疾病已成为各国卫生部门的一项重要任务[1]。在当前的临床治疗水平下,医生主要使用手术联合放化疗的方式进行治疗,虽然放疗能够获得较好的效果,但需要花费患者较长的治疗时间与高昂的费用,并且还将导致患者产生较多的并发症,不利于患者的健康与康复[2]。化疗是一种全身性疗法,在肿瘤治疗中具有重要作用[3]。对目前的药物进行观察可知,喜树碱类药物能够与拓扑异构酶I 进行选择性的结合,并且该药物是一种广谱抗肿瘤药物,可用于诸多肿瘤疾病的治疗,因而被医学界重点关注[4]。
1 喜树碱类药物的发现与来源
喜树碱是一种喹啉类天然生物碱,主要由珙桐科旱莲属植物喜树的根、皮、果实中被提取,对于诸多肿瘤疾病均具有良好的治疗效果,并且将不会导致患者产生较大的副作用。通过相关中医学家发现可知,喜树的根、皮、果实均可入药,例如联合使用3-5 钱的喜树根皮与1-3 钱由果实制成的针、片剂,对于治疗银屑病具有良好的效果;再例如将9-15g 的与3-9g 的果实联合使用,能够获得良好的清热解毒、散结消症的效果。
2 新型多功能喜树碱类药物主动靶向递送系统
医学界于二十世纪八十年代发现了EPR 效应,经过不断实践,目前临床中已将EPR 效应作为靶向纳米药物设计的黄金标准;然而通过研究发现,虽然患有同种疾病,但由于不同患者具有不同的特点,因而会表现出较大的差异,因而若单纯依据EPR 效应将无法获得充足的靶向作用,因而无法使患者获得良好效果[6]。
3 基于CMC/BSA 的CPT 与131I 复合纳米递送系统的构建方式
为确保联合治疗方式能够获得更进一步的效果,近年来纳米载体成为药物的联合递送中的常用方式。通过研究显示,基于纳米载体的联合治疗策略的原理在于通过纳米载体所具有的独有特点,使药物的使用量能够有效的减少,并且能够使药物的使用频率获得显著降低,以便能够提升药物在肿瘤部位的累积良,降低副作用,最终使患者获得最佳的治疗效果。但通过临床实践显示,在上述纳米载体中,仅有较少的载体能够被应用于肿瘤疾病的治疗,原因在于纳米载体并未具有良好的生物相容性。因此需要采取有效的措施对上述情况进行解决[7]。目前临床中研究人员开始积极研发基于CMC/BSA 的CPT 与131I 复合纳米递送系统,现对构建方式进行如下论述:
3.1 131I-BSA/CMC 纳米凝胶的制备
将1.0mg 的131I-BSA 与2.0mg 的CMC 分别与1ml 的去离子水进行混合,之后利用稀盐酸与氢氧化钠分别对调整BSA 与CMC 溶液的pH 值,使其剂量保持于3.5 与7.0。搅拌约30min后充分混合CMC 与BSA 溶液,直至其质量比达到4:1。然后利用稀盐酸将混合物溶液的pH 值调节至5.0,并进行约1h 的缓慢搅拌。最后,将此混合溶液进行加热,温度为70℃,1h 后可获得均匀分散的纳米凝胶。BSA/CMC 纳米凝胶的制备过程同上述论述。
3.2 CPT 负载与体外释放
首先,将5.0mg 的CPT 与1ml 无水乙醇进行混合,并与4.0mg/ml 的CMC 溶液进行混合,将其pH 值控制在7.0。然后,将CMC、CPT 混合物溶液与131I-BSA 水溶液进行混合,直至BSA与CMC 的质量比为4:1。将131I-BSA、CMC、CPT 混合物溶液的pH 值控制在5.0,并进行约30min 的缓慢搅拌。将此混合溶液进行加热,温度为70℃,1h 后可获得负载CPT 的131I-BSA/CMC 纳米凝胶。 BSA/CMC-CPT 纳米凝胶的制备方式与131IBSA/CMC-CPT 相同。采取透析法检测纳米凝胶的体外药物释放情况,简言之将10mg 的负载CPT 的纳米凝胶与10mlPBS溶液进行充分混合,并剑气3500 Da 的透析袋中。随后将透析袋浸没于装有500ml 相同pH 值的PBS 溶液中。在规定的时间点内分别抽取2ml 样品,随即补充2ml 新鲜PBS。过滤后,采取高效液相色谱对样品中药物浓度进行测定,药物累计释放量的具体的计算公式如下所示:
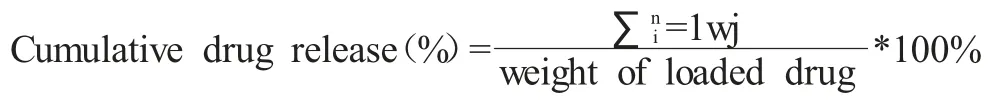
3.3 溶血性研究
文献方法是目前临床中常用的检测所制备纳米凝胶的溶血性的方式。取1ml 新鲜鼠血,将其放置于盛有EDTA-Na2的玻璃管中,进行约10min 的搅拌,以便能够将纤维蛋白质除去,获得脱纤血液。然后,加入10ml 的生理盐水,离心处理后进行血细胞沉淀。使用PBS 溶液进行反复洗涤,直至上清液澄清。随后,使用0.9%的NaCl 溶液将RBC 配制成2%的细胞悬液,分析其溶血特性。将制备的纳米凝胶BSA/CMC 及BSA/CMC-CPT,PE125K、PBS 与1%TritonX-100 分别加入至RBC 细胞悬液中,收集上清液,并对其在540nm 处的吸光度(A)进行测定。溶血率的计算公式如下所示:
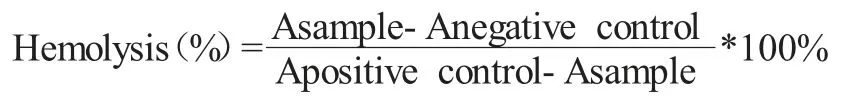
3.4 药代动力学检测
将正常C57BL/6 小鼠随机分为3 组,每组各6 只。每组经尾静脉分别注射131I、131I-BSA/CMC 纳米凝胶粒子、131I-BSA/CMC-CPT 纳米凝胶粒子,在特定的时间点分别提取小鼠眼眶取血,将其放置于离心管中,进行离心处理后取上层血清,使用自动伽马计数仪对样品的放射性进行测量。
4 结果
4.1 负载CPT 纳米凝胶的制备与表征
BSA 与CMC 作为天然高分子材料,良好的生物相容性与可生物降解性是其主要特点,可作为首选的药物载体材料。疏水性药物CPT 在BSA/CMC 纳米凝胶形成的过程中通过疏水相互作用与BSA 内部的疏水微区结合,从而实现对CPT 的高效负载,具体见表1。

表1 纳米凝胶粒子的粒径、电位、载药量
经研究发现,BSA/CMC 与BSA/CMC-CPT 纳米凝胶均具有规则的球形外貌,粒径分布范围较窄。相比于BSA/CMC 纳米凝胶相比,负载CPT 后的BSA/CMC-CPT 纳米凝胶的粒径稍微增大。
4.2 体外药物释放
为模拟生理环境及肿瘤弱酸性环境,将载药纳米凝胶粒子分别置于pH 值为7.4 与5.0 的PBS 溶液中,通过结果可知,纳米凝胶粒子均展示出缓慢而持续的释放药物,未发现药物突释现象发生,如图2 所示。
4.3 溶血性研究
使用不同浓度的样品对RBCs 进行处理,然后在541nm 处测定上清液中血红蛋白的释放量。通过研究显示,TritnX-100 能够完全释放RBCs 血红蛋白。制备的纳米凝胶粒子在0.1mg/ml与1.0mg/ml 浓度下均表现为极低的血红蛋白释放量,明显低于同剂量的PEI,由此说明制备的纳米凝胶粒子裂解红细胞的能力较弱,表明其生物相容性较好[8]。
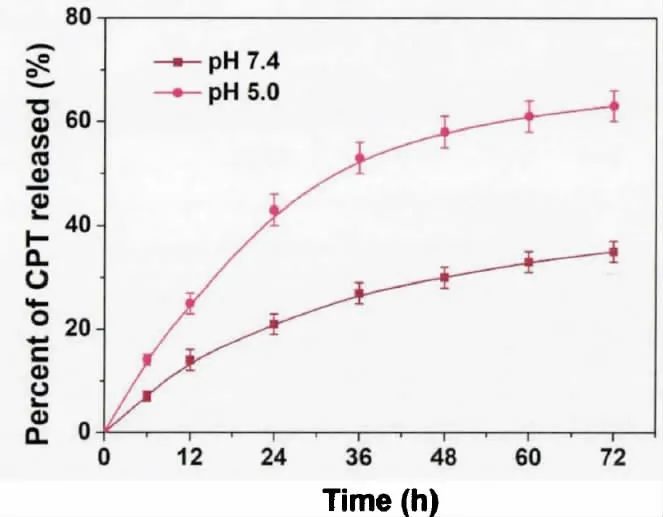
图2 纳米凝胶的体外药物释放
