胎儿膈疝出生后体外膜肺氧合辅助治疗10例分析
2021-01-21吕俊健何秋明钟微林土连夏波彭艳芬吴强李嘉骅邹鹏建余家康
吕俊健, 何秋明, 钟微, 林土连, 夏波, 彭艳芬, 吴强, 李嘉骅, 邹鹏建, 余家康
广州市妇女儿童医疗中心 1新生儿外科监护室, 2小儿外科(广东广州 510623)
先天性膈疝(congenital diaphragmatic hernia, CDH)是由于膈肌发育不良而导致腹腔脏器经膈肌缺损疝入胸腔的一种先天性疾病,重症膈疝者病死率达60%以上[1],主要死亡原因是肺发育不良和肺动脉高压。一氧化氮(NO)吸入广泛应用于新生儿持续性肺动脉高压的治疗,却无法缓解CDH伴发的肺动脉高压,未能减少其体外膜肺氧合(ECMO)使用比例及提高生存率[2]。因此,对于常规治疗失败的膈疝,需要ECMO辅助以渡过呼吸衰竭及肺动脉高压的危险期[3]。现将我院2018—2019年开展的10例胎儿膈疝出生后ECMO辅助治疗情况报告如下。
1 资料与方法
1.1 一般资料 2018年1月至2019年12月本院新生儿外科接收的胎儿期确诊CDH,出生后接收ECMO辅助治疗的患儿10例。本研究获本单位伦理委员会批准以及患儿家属签署知情同意书。
1.2 研究方法
1.2.1 产前评估 根据超声测量肺面积-头围比值(LHR)、LHR实测值与预测值的比值(o/eLHR)、磁共振(MRI)测量胎儿总肺容积(TFLV)、TFLV实测值与预测值的比值(o/eTFLV)、预测肺容积比(PPLV)进行CDH分度,轻度为:LHR>1.4,或o/eLHR>45%,或TFLV>40 mL,或o/eTFLV>35%,或PPLV>28.55%;重度为:LHR<1.0,或o/eLHR<25%,或TFLV<20 mL,或o/eTFLV<25%,或PPLV<15%;两者之间为中度CDH[4-7]。
1.2.2 常规治疗方案 患儿在出生后即在分娩室进行气管插管,转入监护室后呼吸机辅助呼吸,低血压者给予容量支持及血管活性药物应用,肺动脉高压者使用NO吸入治疗等综合治疗措施。
1.2.3 ECMO指征[8]经积极常规治疗,患儿病情符合以下其中一项可予ECMO置管:(1)无法维持导管前SpO2>85%或导管后SpO2>70%;(2)有效通气下pH值仍<7.15,动脉血PaCO2持续上升;(3)吸气峰压>28 cmH2O、平均气道压>17 cmH2O才可维持SpO2>85%;(4)pH<7.15且乳酸≥5 mmol/L;(5)低血压治疗无效,12~24 h内尿量<0.5 mL/(kg·h);(6)氧合指数≥40维持>3 h。
1.2.4 ECMO模式及置管 10例患儿均使用静脉-动脉ECMO模式,选取右侧的颈总动脉和颈内静脉切开直视下插管,颈总动脉插管管径为8Fr,颈内静脉插管管径为10Fr(仅病例4低体重儿使用6Fr/8Fr)。
1.2.5 ECMO管理 按照《新生儿呼吸衰竭体外膜肺氧合支持专家共识》[9]进行管理。
2 结果
2.1 产前评估情况 10例患儿均在孕24周前发现胎儿膈疝,根据胎儿超声和MRI评估肺部及肝脏疝入情况,9例患儿(其中病例7拒绝MRI检查)达到中至重度膈疝,见表1。
2.2 患儿出生后治疗情况 10例患儿,男6例,女4例,胎龄33~40+5周,出生体重1 960~3 840 g。ECMO辅助年龄中位时间在出生后28(3,218)h, ECMO运行时长中位时间为7.3(3.6,40.2)d,8例患儿完成膈肌修补手术,7例患儿成功撤离ECMO,见表2。
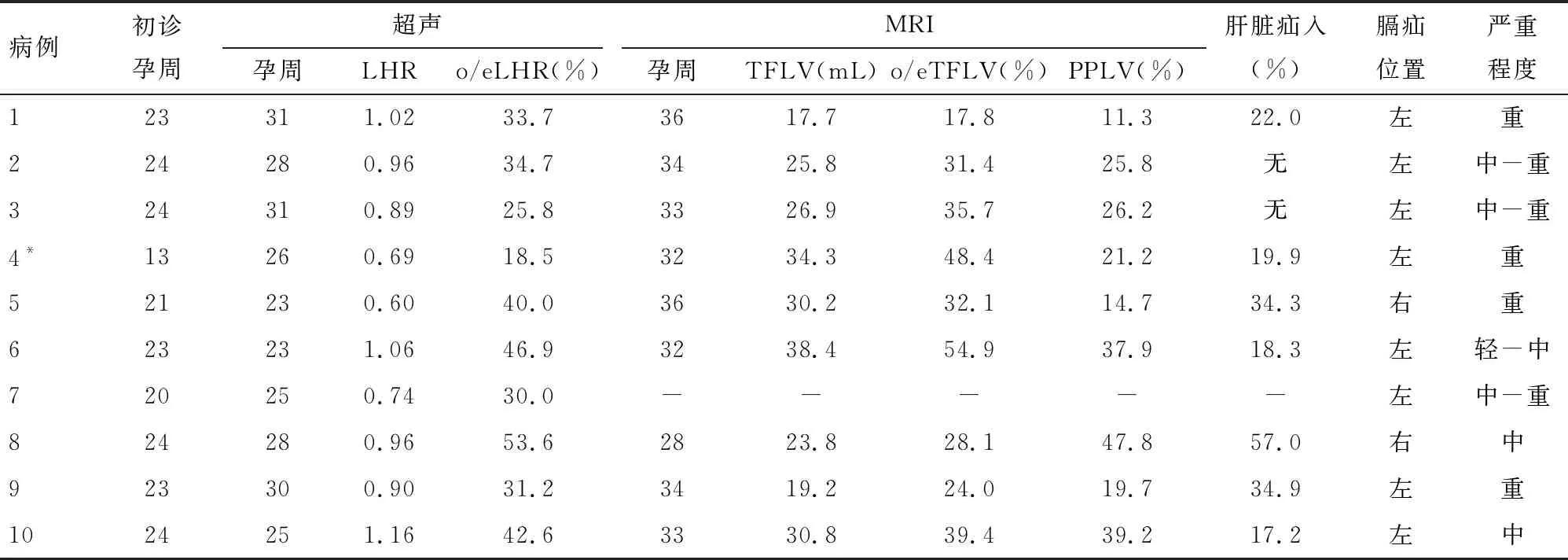
表1 10例患儿产前评估情况

表2 10例患儿出生后治疗情况
3 讨论
3.1 产前评估胎儿CDH严重程度 评估胎儿CDH严重程度可指导胎儿期及生后治疗措施选择,根据评估情况告知孕妇患儿出生后需面临的治疗、疗效、费用、风险等,对于预后良好的胎儿,避免不必要的人工流产。对于中重度胎儿CDH,可指导产前干预,如皮质类固醇类药物应用或胎儿镜下气管球囊栓塞术等,进行孕期准备并在有能力处理或治疗CDH的医疗机构分娩。
超声测量LHR、o/eLHR目前作为CDH产前评估被广泛应用,在早期诊断及评估有不可替代的作用,其在孕12~32周时对预后的预测准确性较高,但孕>32周对预后评估的应用价值有限,不同地方的数据差异大[10-11]。部分转诊到我院的胎儿CDH胎龄已>32周,缺乏孕早中期LHR的数据;而且超声测量LHR、o/eLHR有最大径线法、轮廓描记法等测量方法,测量者技术的影响比较大[2],存在一定的局限性。在32周后胎儿肺的肺容积进入平台期,此后肺容积接近出生时的水平[12],因此,在孕32周后测量TFLV值能更准确反映出生时的肺发育情况。Lee等[5]研究认为,孕32~34周时应用胎儿MRI测量TFLV对胎儿生后生存率和ECMO使用率具有较高的预测价值。本团队既往研究[7]认为,胎儿期MRI测量PPLV有对死亡及肺动脉高压有预测价值。且MRI测量可重复回顾,受测量者影响较少,因此MRI在孕后期的评估优于超声,这与Bebbington等[13]结论一致。当超声与MRI测量值在不同分度时,根据测量值的发展趋势及孕后期的MRI测量值为主要依据对CDH胎儿进行讨论后分度。
3.2 合理控制出凝血功能是ECMO辅助治疗CDH的关键 出血和血栓形成,是ECMO运行的重要并发症之一,其关系到存活率的下降[14-15]。本研究中10个病例中ECMO运行时间最长为40.2 d,其中主要并发症是出凝血功能异常导致,如颅内出血、心包填塞、弥散性血管内凝血(DIC)等;且有CDH患儿需要在ECMO运行时手术,控制良好的出凝血功能是治疗的关键。
输液及监测管道管理:(1)ECMO置管全身肝素化前留置中心静脉通路、动脉监测通路,避免ECMO置管后进行血管穿刺及引流管(胃管、胸腔引流管、尿管等)的不恰当更换诱发出凝血障碍;(2)每次更换管道需讨论后慎重进行。
膈肌修补的围术期准备:术前控制活化凝血时间(ACT)在160~180 s,纤维蛋白原>1.5 g/L,活化部分凝血活酶时间50~80 s,血小板>100×109·L-1,红细胞压积30%~35%,术前1 h应用氨基己酸100 mg/kg,术后20 mg/(kg·h)持续约24 h[16]。值得注意的是,凝血指标的改变趋势在与肝素使用量不一致时,需寻找原因,如合并DIC、感染、管道血栓等。
3.3 膈肌修补的时机 在ECMO辅助治疗中,膈肌修补术时机仍存在争议:Kays等[17]认为CDH患儿在ECMO置管及肝素化前手术能减少出血等并发症,增加存活率。Fallon等[18]通过46病例分析,认为ECMO运行的早期(<72 h)修补手术能减少ECMO治疗时间及并发症发生率。Partridge等[19]通过77例CDH病例回顾性分析指出:ECMO辅助前、中、后手术的存活率分别为66%、44%、100%。总体而言,ECMO辅助期间进行膈肌手术,并发症发生率高且存活率较低,但现实情况是比较复杂的,如病例1、9在生后3、4 h即需ECMO辅助,ECMO辅助前无手术机会,而且并不是所有ECMO辅助治疗病例均能撤离ECMO,长时间的ECMO辅助将增加并发症发生率和家属的心理及经济负担。通过对本研究10例患儿的回顾,本团队暂制订:对于产前评估中度或中-重度CDH患儿、ECMO辅助5~7 d内病情稳定、肺部复张、ECMO支持下降,可撤离ECMO后行修补膈肌手术;否则在ECMO辅助中2周内进行手术修补。
CDH患儿撤离ECMO并不是治疗的结束,而是另一治疗阶段的开始,在存活5例患儿随访中,我们注意到患儿存在不同程度的氧依赖、肺动脉高压、营养不良等情况,因此将来需建立多学科团队进行ECMO辅助治疗后的CDH患儿进行随访。
