肿瘤类器官模型的建立及应用
2021-01-21罗宝花张永斌刘晓秋师长宏
罗宝花,张永斌,刘晓秋,师长宏
(1. 广州中医药大学科技创新中心/实验动物中心,广州 510405;2. 空军军医大学实验动物中心,西安 710032)
人体肿瘤研究常用的动物模型主要有人源肿瘤细胞系移植(cell-derived xenograft,CDX)模型和人源肿瘤组织异种移植(patient-derived xenograft,PDX)模型。CDX模型是将人体肿瘤细胞先在体外二维培养环境下进行培养,经过筛选、传代,形成稳定的肿瘤细胞系,然后注射到免疫缺陷小鼠体内建立的模型;该模型的建立操作简单,且肿瘤细胞可在体外无限增殖,便于进行基因编辑操作,但是肿瘤细胞在体外培养过程中,会被含血清培养基诱导发生转化,对培养环境进行适应和选择,从而失去原发肿瘤细胞的异质性[1-2]。PDX模型是将患者来源的肿瘤细胞或组织移植入免疫缺陷小鼠体内建立的模型,较好地保留了肿瘤干细胞和基质成分,生长环境更接近原发肿瘤,能够较好地维持原发肿瘤的特性;但是在小鼠体内传代过程中,人源性肿瘤基质会逐渐被鼠源性基质代替,从而改变肿瘤微环境,逐渐丢失原发肿瘤的异质性,不适用于低恶性或慢性进展的肿瘤研究,而且其总体移植成功率低,实验周期长,费用高,限制了该模型的应用[1-3]。因此,需要建立更好的动物模型来进行人体肿瘤研究,以促进人们对肿瘤的认识。
类器官技术是近年来最重要的科学进展之一,是一类具有广泛应用前景的体外培养技术。运用该技术建立的肿瘤人源类器官(patientderived organoids,PDO)是一种来源于肿瘤特异性干细胞的三维(three dimensions,3D)多细胞团,具有和来源肿瘤组织高度相似的生物学特性。它不仅培养成功率高,周期短,可以在体外大量扩增,进行基因编辑操作,而且遗传稳定,长期传代后仍然能够准确再现肿瘤的异质性,可同时建立配对的正常组织类器官以进行对照分析。与CDX和PDX模型相比(表1),PDO模型既同时具备了二者的优势,又弥补了它们的不足[1-4],近年来已被广泛应用于肿瘤研究。
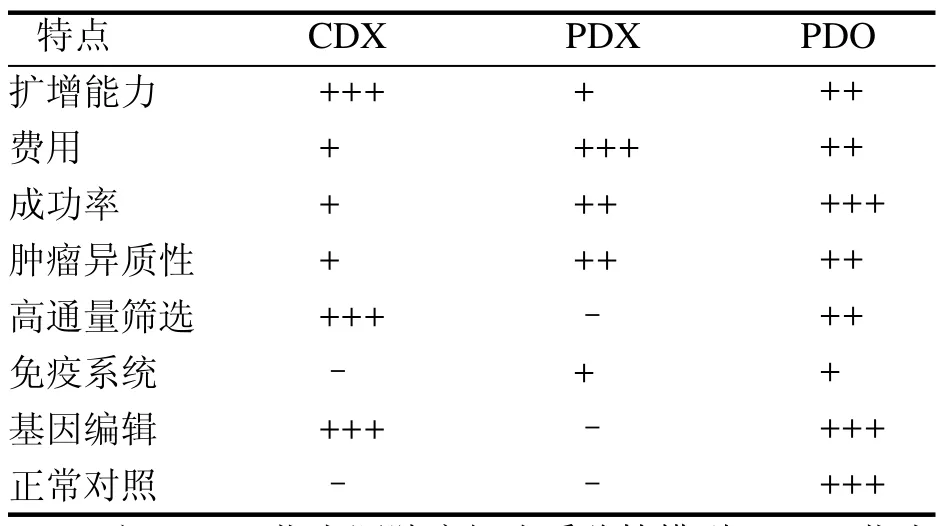
表 1 CDX、PDX和PDO肿瘤模型的比较Table 1 Comparison of CDX, PDX and PDO tumor models
1 肿瘤类器官的发展简史
20世纪90年代,Lindberg等[5]和Pellegrini等[6]利用人角膜缘干细胞成功在体外培养出3D眼角膜结构,首次实现了人源性细胞的3D培养。2009年,Clevers研究团队在Nature杂志上首次报道了肠道类器官体系的建立,开启了类器官研究的新时代[7]。2011年,Sato等[8]运用类器官技术率先建立了肿瘤类器官。2015年,全球首个肿瘤类器官库被建立[9]。自此以后,研究者们逐渐建立起各种肿瘤的类器官库[10-21](表2)。
2 肿瘤类器官模型的建立方法
2.1 培养体系
培养肿瘤类器官首先要制备出含肿瘤干细胞的悬液,然后将其置于一个支持介质(多为基质胶Matrigel或基底膜提取物)上,待其固化后加入合适的培养基进行3D生长,培养数日后,就可形成与原发肿瘤结构和功能相似的3D多细胞团,之后每1~2周传代1次。其培养关键是要在体外人为地模拟出体内肿瘤微环境,诱导干细胞自主完成类器官的自组装过程。
体外培养体系一般由生长调节因子和细胞外基质两部分组成,其中细胞外基质多选用基质胶(Matrigel)[22]。但实际上,培养不同的肿瘤类器官,甚至同一肿瘤类器官的不同亚型,需要的培养基条件不尽相同[8],因此应将不同的培养基条件进行不同组合,以寻求最佳的培养方案,提高培养成功率。如Kopper等[21]在培养卵巢癌各种亚型衍生的肿瘤类器官时发现,在液体硫乙醇酸盐(fluid thioglycollate,FT)培养基中加入氢化可的松、forskolin和调节蛋白(heregulin)β-1可以明显提高卵巢癌类器官的衍生效率;同时他们还观察发现,Wnt(一类分泌型糖蛋白)生态位因子并不是所有肿瘤亚型必需的。此外,有研究发现,肿瘤类器官的生长速度较其对应正常组织类器官的生长速度慢,可能是由于有丝分裂异常或细胞死亡所致[23]。因此,在体外培养肿瘤类器官时,要避免混杂其中的残余正常组织形成的类器官过度生长,应使用选择性培养基或纯化的肿瘤细胞样本进行肿瘤类器官培养[8]。如Nanki等[24]用Nutlin-3(一种鼠双微体基因2拮抗剂)选择性培养基来抑制正常胃类器官的增殖,从而获得含TP53基因突变的纯胃癌类器官。
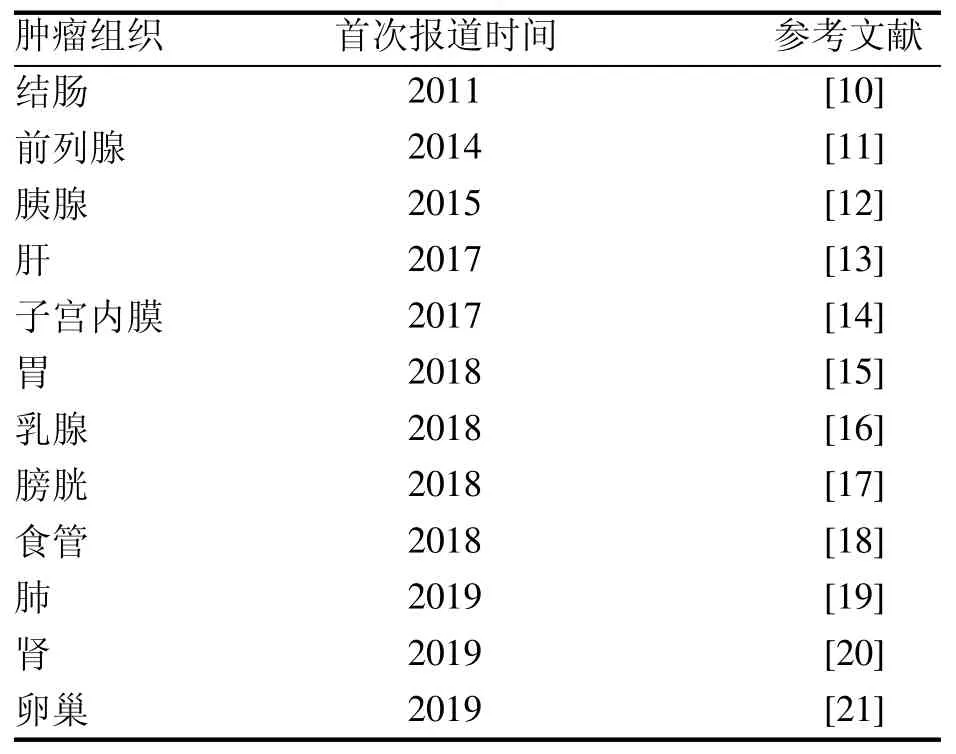
表 2 肿瘤类器官库Table 2 Tumor organoids biobank
2.2 已建立的肿瘤类器官模型的特点
肿瘤来源的类器官可以通过手术切除或活检的方式从实体肿瘤或循环肿瘤细胞中建立,与需要大样本量的PDX模型不同,PDO可以从来源于针活检的小样本量培养形成,具有很高的建模成功率,而且所需时间短,传代稳定,经体外长期培养后仍可保留原发肿瘤的体内特征,具有与来源肿瘤相同的组织形态学、遗传学特征及肿瘤标志物。此外,PDO还可以根据需要移植入免疫缺陷小鼠建立PDX模型,在免疫缺陷小鼠内表现出与原代肿瘤细胞相同的致瘤能力,以及侵袭、转移等临床特性。表3总结了目前已建立的肿瘤类器官的特征。
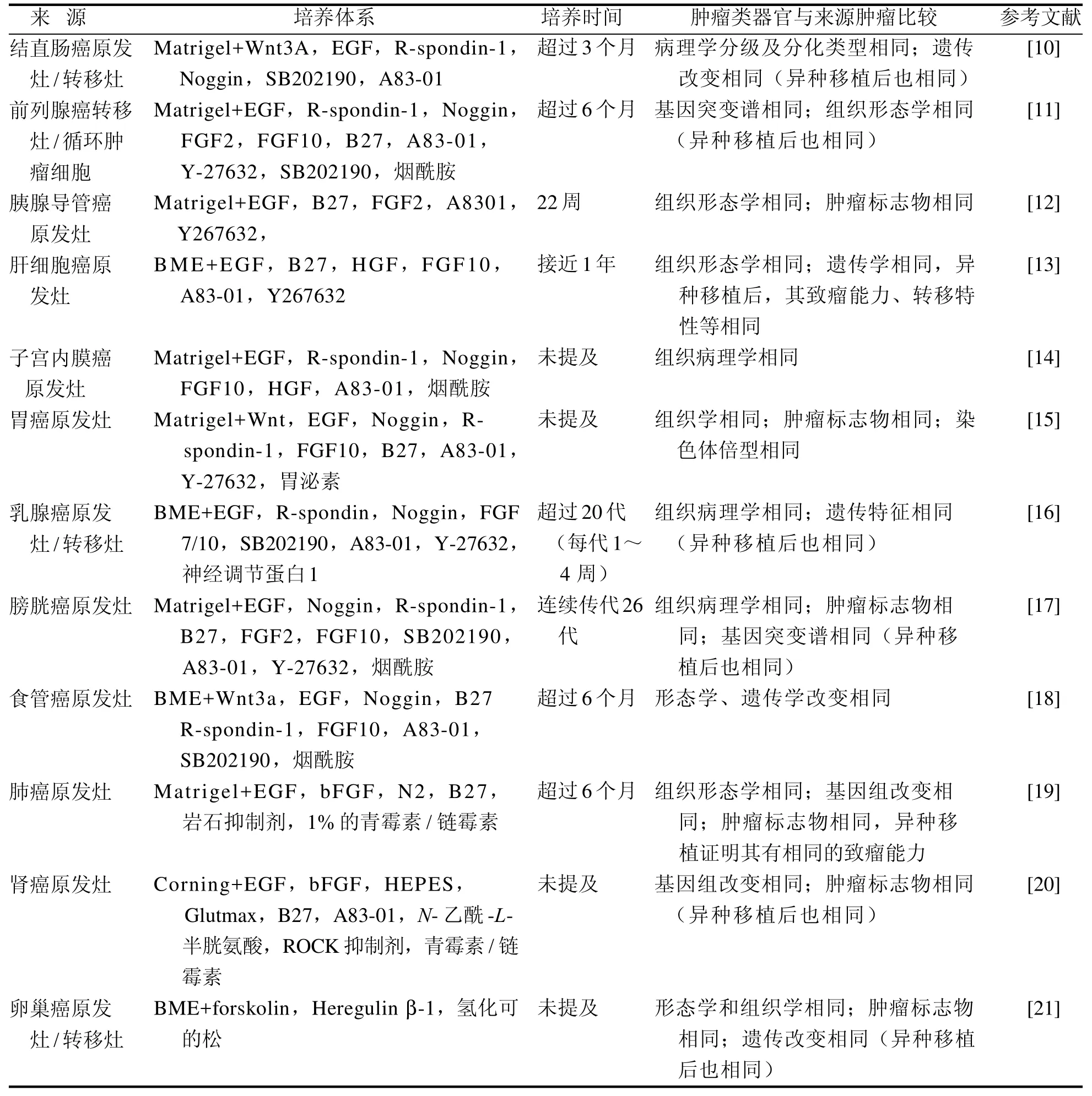
表 3 已建立的肿瘤类器官的特征Table 3 The characteristics of established tumor organoids
3 肿瘤类器官模型的应用前景
与传统肿瘤模型相比,肿瘤类器官模型具有诸多优势,可作为肿瘤研究的理想模型,在肿瘤研究领域具有广泛的应用前景。
3.1 用于研究肿瘤的发生和发展机制
肿瘤的发生、发展、恶化,再到病灶转移是一个相互关联的过程,了解该过程中每一步的具体作用机制对于肿瘤的防治具有重要意义,这需要构建肿瘤发生和发展不同阶段的体外模型;传统肿瘤模型暂且无法实现,而应用类器官技术有望实现突破。通过模拟体内肿瘤微环境,针对肿瘤发展的所有阶段(包括正常时期、侵袭前期、侵袭期和转移期)都可建立相应的类器官,从而进行相关的机制研究。
3.1.1 认识传染性病原体与肿瘤发生的关系 许多肿瘤的发生与病原体感染密切相关[25],但病原体是如何导致肿瘤发生的过程尚不清楚。运用类器官技术,建立不同病原体与类器官的共培养体系,可用来研究这些过程。如Buti等[26]在幽门螺杆菌和胃类器官的共培养体系中发现,幽门螺杆菌的毒力因子CagA通过与p53-2凋亡刺激蛋白(apoptosis stimulating protein of p53-2,ASPP2)结合,诱导p53降解,使p53促细胞凋亡的活性丧失,同时诱导细胞极性复合物PAR重塑,使细胞极性丧失,促进上皮细胞-间充质细胞转化,从而导致胃癌的发生和转移。此外,类器官-病毒共培养模型也可以用于肿瘤发生和发展机制的研究。Ramani等[27]在脑类器官和Zika病毒的共培养体系中观察发现,感染Zika病毒后,脑类器官中特异性神经元基因的表达上调。上述共培养体系使得研究病原体诱导特异性基因表达调控肿瘤的发生、发展成为可能。
3.1.2 识别导致肿瘤进展的驱动突变 肿瘤的发生是大量基因突变不断累积的结果,但只有其中的少数突变会导致肿瘤进展[28],称为驱动突变。肿瘤的异质性使真正的驱动突变难以被识别,类器官技术有望解决这一难题。类器官技术的突出优点是能够同时建立来源于同一患者的正常组织类器官和肿瘤组织类器官,其中正常组织类器官的遗传信息相对稳定,可作为研究肿瘤突变的良好对照模型[29],通过比较肿瘤类器官与正常组织类器官的基因表达情况可以推断出可能的驱动突变,然后加以验证。例如Chio等[30]发现,核因子E2相关因子2(nuclear factor E2-related factor 2,NRF2)在同一患者胰腺癌类器官中的表达水平较正常胰腺类器官高;当利用基因编辑技术敲低NRF2基因表达后,胰腺癌类器官的生长受到抑制,而正常胰腺类器官的生长不受影响,说明NRF2很可能是胰腺癌的驱动突变基因。上述模型的研究结果提示,肿瘤的发生与驱动突变密切相关,这些突变可能可以作为肿瘤防治的潜在靶点。
3.2 用于药物筛选并指导个体化治疗
异质性是肿瘤研究面临的一个重大难题,也是开展肿瘤个体化治疗的重要原因之一[1]。过去最常用的癌症药物筛选模型是肿瘤细胞系,它可以在体外无限增殖,进行高通量药物筛选;但是在传代过程中,肿瘤细胞会对二维培养环境进行适应和选择,丢失亲本肿瘤的异质性,导致药物临床前实验结果和临床试验疗效存在较大差异,不能有效评估肿瘤药物的疗效和安全性。而PDX模型虽可在短期内较好地保留肿瘤异质性,但其操作复杂、培养周期长且费用昂贵,不适用于药物高通量筛选。与传统的药物筛选模型相比,肿瘤类器官模型不仅可以在体外稳定传代,大量扩增,满足药物高通量筛选的要求,而且可以较好地维持原发肿瘤的异质性,具有更精确的药物反应预测优势,可以更好地指导个体化治疗。Vlachogiannis等[15]利用胃肠道肿瘤类器官库与相应的临床试验进行比较,证实肿瘤类器官可以准确地预测药物疗效;分析数据显示,肿瘤类器官有着100%敏感性、93%特异性、100%阴性预测值和88%阳性预测值。Roerink等[31]通过对结直肠癌类器官进行“批量”单细胞测序和药物疗效观察,发现来自同一患者甚至具有相似突变特征的肿瘤细胞对同一化疗药物的反应也不尽相同。这些模型证实了肿瘤类器官对药物反应具有精确预测优势,甚至还具有在个体患者中揭示异质性的潜力。
类器官模型用于药物筛选的另一突出优势是源自同一患者的肿瘤组织和正常组织都可以在体外培养形成类器官,对两者先后进行药物敏感性试验和药物毒性测试,可以筛选出专门针对肿瘤细胞而不损伤健康细胞的药物,从而减少药物对病人的毒性作用。
3.3 促进肿瘤免疫治疗
免疫治疗旨在利用人体免疫系统杀灭肿瘤细胞,其效能依赖于肿瘤相关基因突变产生的抗原(即新抗原)负荷,足够的免疫原性才能触发有效的免疫应答[32-33]。然而,多数情况下,患者在肿瘤新抗原诱导下产生的免疫应答强度是不够的。近年来有研究发现,肿瘤类器官与免疫细胞共培养可以实现效应T细胞的体外激活和扩增。例如Dijkstra等[34]研究发现,源于同一患者的肿瘤类器官与外周血淋巴细胞共培养可以产生CD8+T细胞,而且由于新抗原的存在,可刺激CD8+T细胞持续增殖,成功建立了效应T细胞的体外富集方法。此外,他们还证实了这些效应T细胞能够有效识别和杀死肿瘤细胞,而不杀伤正常组织细胞。因此,可以通过将体外激活扩增的大量效应T细胞移植入原患者体内,强化患者对肿瘤细胞的免疫应答,从而实验肿瘤免疫治疗[35]。还有研究证实,胸腺类器官可为体外有效扩增效应T细胞提供更接近体内生理状态的微环境[36]。这些研究结果均说明,肿瘤类器官技术可以有效活化效应T细胞,增强肿瘤特异性免疫应答水平,促进人体免疫系统杀灭肿瘤细胞。
3.4 与液体活检联合应用
液体活检是近几年迅速发展的一项生物技术。与传统组织活检相比,液体活检以非侵入性为主要特点,具有无创性和实时性。液体活检以血液样本作为主要分析材料,在获取患者少量血液后,分离出循环肿瘤细胞,再利用二代测序技术制定个性化的治疗方案,致力于肿瘤的早期诊断、监测,并指导治疗。循环肿瘤细胞是因自发或诊疗操作而从原发肿瘤实体或转移病灶脱落到外周血循环中的一类肿瘤细胞,其数量变化、细胞表型、扩增能力和药敏测试等指标与肿瘤的早期发现、分级、转移及预后等密切相关[37-38]。长期以来,肿瘤内部的异质性是传统组织活检难以攻克的难题之一,液体活检有望在这一问题上实现突破。循环肿瘤细胞可作为有创性活组织检查的替代品,用于肿瘤异质性研究。但液体活检在循环肿瘤细胞的检测和富集上存在缺陷,获取的循环肿瘤细胞较少,不能满足研究需要。肿瘤类器官可以从小样本量培养形成,恰好可以避免这一问题。2014年,Gao等[11]证实了利用来源于患者外周血的少量循环肿瘤细胞进行肿瘤类器官培养的可行性;并且通过全外显子组测序发现,来源于循环肿瘤细胞的前列腺癌类器官保留了与原发肿瘤相一致的分子多样性,包括TMPRSS2-ERG融合、SPOP突变、SPINK1过表达和CHD1丢失。液体活检联合肿瘤类器官将为攻克肿瘤异质性难题提供一个新的研究策略。
4 肿瘤类器官模型的局限性
尽管肿瘤类器官模型有着诸多优势,但仍存在一些局限性。(1)体外培养体系缺少体内肿瘤微环境成分,如基质细胞、免疫细胞、神经和血管等,不能完全代表肿瘤在体内所处的环境。如何在体外培养体系中重建肿瘤微环境,将是未来研究的一个方向。(2)类器官培养体系含有各种成分,可能对实验结果造成不确定的影响。(3)肿瘤类器官培养技术尚未成熟,培养条件复杂,更简单、高效的培养方案仍需进一步摸索。(4)截至目前,已报道的肿瘤类器官模型大多属于上皮来源,只有一例属于非上皮来源[39]。类器官技术是否适用于非上皮来源的肿瘤类器官培养,仍需进一步探索。
5 结语
肿瘤类器官模型体外培养成功率高,所需形成时间短,成本低,传代稳定,可以较好地再现原发肿瘤的体内特征及异质性,可以进行相关遗传操作,而且可以冷冻保存后再复苏培养,这些特点使各种肿瘤类器官库得以建立,为大量实验研究提供了充足的数据支持。虽然目前肿瘤类器官仍存在一些局限性,但随着研究的不断深入、技术的不断革新,相信肿瘤类器官模型会在肿瘤研究方面发挥越来越重要的作用。
