焦化污染土壤中降解甲苯的厌氧反硝化菌群结构
2021-01-21王建伟李亚男张国凯王国英岳秀萍
王建伟,李亚男,张国凯,饶 竹,王国英,王 迪,岳秀萍
(1.太原理工大学 环境科学与工程学院,太原 030024;2.中海国亚环保工程有限公司,太原 030012;3.国家地质实验测试中心,北京 100037)
焦化土壤中最常见的污染物质主要成分是BTEX和其他芳烃类物质[1-2]。BTEX属于单环芳烃类物质,包括苯、甲苯、乙苯和二甲苯,这类物质对人体中枢神经系统有抑制作用[3],在人类繁殖生育过程中也会产生毒性[4-6]。这些有害物质通过煤气净化和焦油加工排放出来,给周围土壤环境带来了极其严重的污染。
国内外研究表明,在焦化土壤中,污染物不仅降低了土壤微生物的多样性,还改变了其群落结构和组成,使得降解性微生物成为了优势菌群[7]。随着煤炭深加工对土壤造成污染的问题越来越受到重视,一些相应的土壤治理措施得到应用,治理措施主要有3类:物理法、化学法和生物法[8]。其中,利用土壤中微生物修复技术来治理污染土壤受到了广泛关注[9-10]。微生物修复技术机理是土壤中的降解菌群对污染性有机物进行吸附、降解和转化以降低污染物浓度或使其反应生成无害物质。BTEX在土壤中具有垂直迁移渗透能力[11],当其下渗一定深度后,土壤多为缺氧或者厌氧环境,这就给土壤微生物厌氧降解BTEX提供了条件。在厌氧条件下,甲苯作为BTEX中的简单有机物,可以通过各种电子受体被微生物降解[9,12],其中硝酸盐作为常规电子受体有很大优势。苯甲酸作为BTEX反应过程的中间产物[13-14]同时参与甲苯降解菌液对照能够更好分析焦化土壤微生物菌群特性。
因此,本实验主要研究在硝酸盐厌氧条件下,通过降解甲苯或苯甲酸的反应过程,来富集焦化厂污染土壤中的微生物。与此同时,本实验利用高通量测序技术手段对降解菌群结构多样性和组成进行分析。
1 材料和方法
1.1 材料
1.1.1样品采集
采集山西省太原市小井峪一处废弃的煤化所焦化厂排污沟内覆土10~15 cm以下的土壤样品。该土壤样品用于富集厌氧微生物来进行降解试验,取样后立刻带回实验室储存于4 ℃冰箱内,直至使用。
1.1.2培养基
富集培养基菌液由以下物质组成:Na2HPO4·7H2O(7.90 g/L),KH2PO4(1.50 g/L),NH4Cl(0.30 g/L),NaCl(23.00 g/L),KNO3(0.51 g/L),MgSO4·7H2O(0.10 g/L),EDTA(0.25 g/L),ZnSO4·7H2O(0.12 g/L),CaCl2(0.03 g/L),MnCl2·4H2O(0.03 g/L),FeSO4·4H2O(0.04 g/L),(NH4)6Mo7O24·4H2O(0.03 g/L),CuSO4·5H2O(0.01 g/L),CoCl2·6H2O(0.02 g/L),以上培养基均使用超纯水进行配制,然后通入氩气(压强0.4 MPa,15~20 min)来吹脱溶液中溶解氧。培养基及所用血清瓶、枪头等操作材料用高压蒸汽灭菌锅在121 ℃下灭菌30 min,最终使培养基成为无菌厌氧实验条件。
1.2 富集菌液的建立
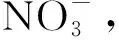
1.3 化学分析


1.4 细菌的多样性分析
1.4.1细菌DNA提取和PCR扩增
DNA提取:参照OMEGA试剂盒E.Z.N.ATMMag-Bind Soil DNA Kit使用说明书的步骤进行操作。提取后,用琼脂糖凝胶电泳检测DNA完整性。
PCR扩增:第一轮扩增利用Qubit2.0 DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应加入的DNA量。通过如下引物进行土壤富集菌液细菌DNA的PCR扩增:341F引物,CCTACGGGNGGCWGCAG;805R引物,GACTACHVGGGTATCTAATCC. PCR反应体系为2×Taq master Mix 15 μL,PCR primer F (10 μmol/L) 1 μL,Primer R (10 μmol/L) 1 μL,Genomic DNA 10~20 ng,超纯水30 μL. PCR扩增的反应条件:在95 ℃条件下扩增3 min;94 ℃条件下扩增 30 s,45 ℃ 条件下扩增20 s,65 ℃条件下扩增30 s,做5次循环;在94 ℃条件下扩增20 s,55 ℃条件下扩增20 s,72 ℃条件下扩增30 s,做20次循环;在72 ℃条件下扩增5 min,最后冷却至10 ℃.PCR扩增结束后,进行第二轮扩增。第二轮扩增引入Illumina桥式PCR兼容引物,PCR反应体系为2×Taq master Mix 15 μL,Primer F (10 μmol/L)1 μL,Primer R (10 μmol/L) 1 μL,Genomic DNA 20 ng,超纯水30 μL. PCR扩增的反应条件:在95 ℃条件下扩增3 min;在94 ℃条件下扩增20 s,在55 ℃条件下扩增20 s,在72 ℃条件下扩增30 s,做5次循环;在72 ℃条件下扩增5 min,最后冷却至10 ℃. PCR结束后,对其产物进行琼脂糖凝胶电泳检测。
1.4.216S rDNA测序数据处理
16S rDNA测序由上海生工公司完成,通过原始序列数据进行质控过滤,得到3个样本(Back,Toluene,Benzoate)处理后高质量序列读数。再使用Usearch去除预处理后序列中非扩增区域序列和靶区域外序列,最后得到3个样本(Toluene,Benzoate,Back)剩余序列数目。通过OTU(operational taxonomic unit)操作单元分类法将3个样本菌种、菌属的相似性进行归类,用Venn图来统计样本中共有和独有的OTU的数目,直观地展现出3个样品(Back,Toluene,Benzoate)的OTU数目组成。
采用Naïve Bayesian assignment算法对每条序列在不同层级水平上计算其分配到此rank中的概率值,当概率值大于0.8时,此分类结果可信。同时基于Bergey’s taxonomy后分为6层,依次为域(domain)、门(phylum)、纲(class)、目(order)、科(family)、属(genus)。最后根据分类学分析结果数量,统计在各个分类层级水平上的3个样品(Back,Toluene,Benzoate)的群落组成。
2 结果与讨论
2.1 富集菌液中微生物对甲苯或苯甲酸的降解
在菌液富集期间,甲苯或苯甲酸(电子供体)在硝酸盐(电子受体)还原条件下完全反应时,若不考虑细胞生长代谢,硝化反应过程化学计量方程式如下。
甲苯:
苯甲酸:
在第8 d,向活性菌液中添加相应的甲苯(或苯甲酸)和硝酸盐,而背景对照菌液中只添加硝酸盐。在第16 d中,背景对照菌液中硝酸盐被消耗约0.46mmol/L之后基本保持变化,但在活性菌液中,甲苯和苯甲酸分别被消耗约0.10 mmol/L,基本被全部降解。在本实验中,甲苯和苯甲酸的降解率与硝酸盐的消耗量比值分别为1∶8.7和1∶5.9,这说明原甲苯菌液土壤中仍有少量有机物与硝酸盐完全反应。图1表明,在活性菌液中,硝酸盐能够生成亚硝酸盐,之后又完全反应。在灭活对照菌液中,底物浓度基本保持不变。在背景对照和灭活对照菌液中,没有亚硝酸产生。
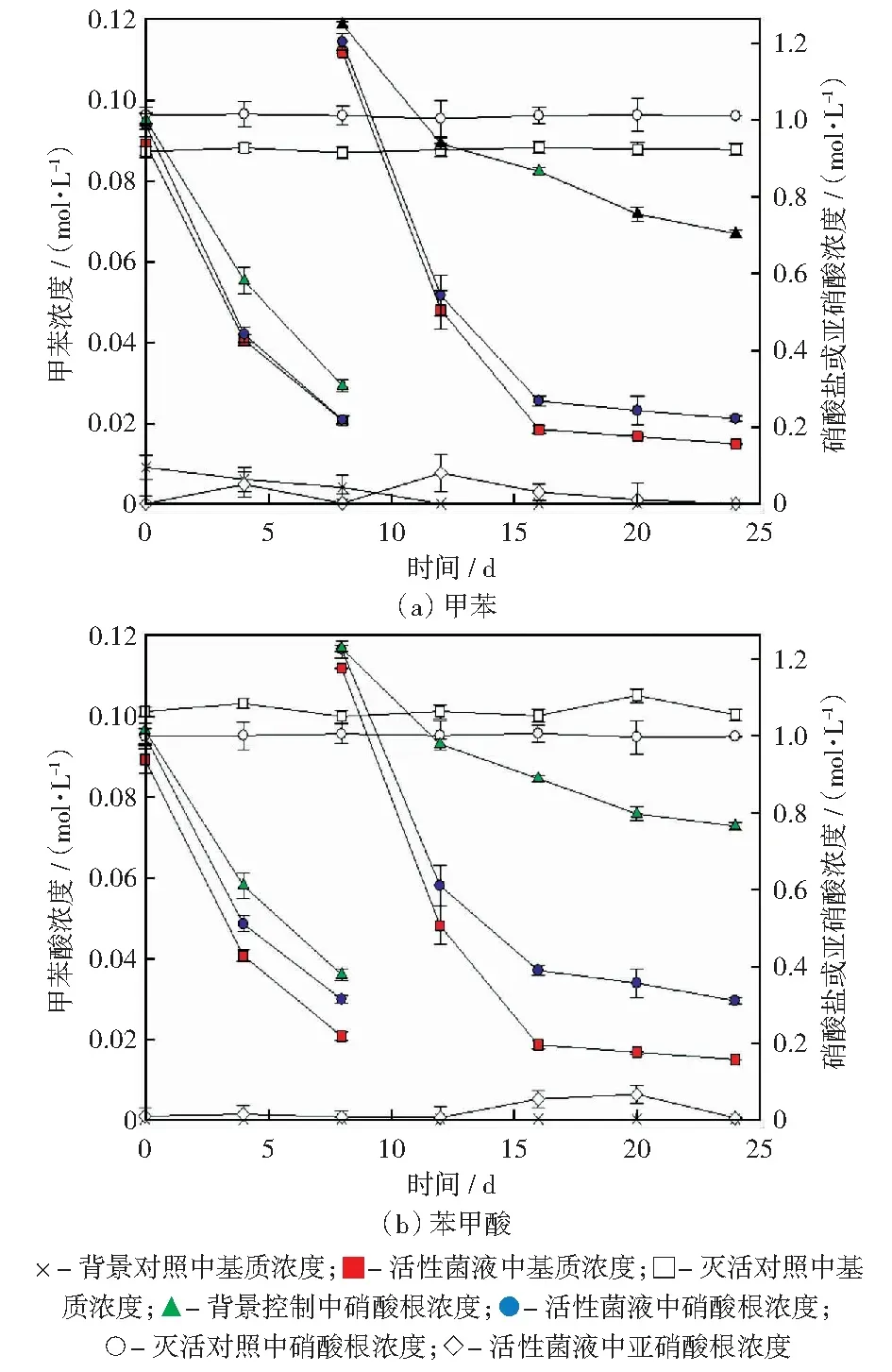
图1 富集菌液中的基质降解和硝酸根还原过程Fig.1 Substrate degradation and nitrate-reducing process in enrichment solution
2.2 样品测序操作单元分类及菌群多样性分析
3个样本(Back,Toluene,Benzoate)的高通量测序共得到183 690条高质量序列,平均长度为421.24 bp.以97%相似度划分,共得到8 382个OTU,见表1.在焦化土壤富集菌液中,3个样本(Back,Toluene,Benzoate)中检测得到的序列数分别为65 216、61 101、57 373.背景对照样本中含有3 502个OTU,降解甲苯和苯甲酸菌液中分别含有2 776个OTU和2 551个OTU. 3个样品覆盖率值均为0.96,说明绝大部分的样品基因序列在测序后被组装得到,测序结果能够较准确地反映样品的生物菌群特性。
香农指数(Shannon index)指数通常用来分析微生物样品的生物菌群多样性,香农指数越大,说明样品生物多样性越高[15]。在表1中,由Ace指数和Chao1指数可看出,背景对照指数均大于降解苯甲酸菌液指数和降解甲苯溶液指数。3个样本(Back,Toluene,Benzoate)香农指数分别为3.80、3.43、2.91,说明降解甲苯和苯甲酸的生物多样性明显都比背景对照低。
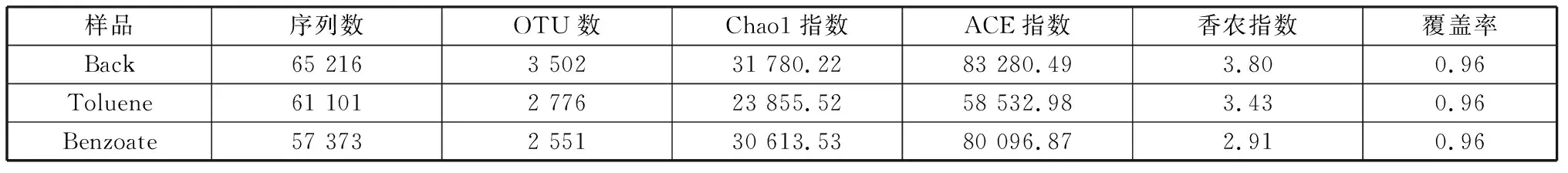
表1 微生物群落多样性指数Table 1 Microbial community diversity index
在土壤富集菌液中,利用Venn图对3个样本(Back,Toluene,Benzoate)的OTU进行相互归类比较,如图2所示,甲苯菌液和背景对照中OTU共享数量为161个,各自独有OTU数分别为2 615和3 344. 甲苯菌液和苯甲酸菌液共享的OTU数241个,各自拥有OTU数分别为2 535和2 310. 苯甲酸菌和背景对照共有的OTU数125个,各自特有的分别为2 426和3 380. 由OTU层面来看,3个样本(Back,Toluene,Benzoate)存在相似的OTU类型较少,表明样品间主要菌种类型很可能差别较大,同时相似OTU的不同含量也可能造成菌种比例及菌群结构差异。

图2 细菌群落操作单元结构Venn图Fig.2 Venn plot of bacterial community structure
2.3 细菌群落组成和菌群结构差异性
2.3.1菌群在门上组成和结构差异的分析
利用16S rRNA宏基因组测序序列,进一步分析微生物群落在门水平上群落结构丰度和菌群组成。3个土壤样品(Back,Toluene,Benzoate)的8 382条OTU分属10个门,15个纲,25个科,34个目,44个属,见图3.图3(a)中可观察到样品菌门上的分类,其中低于1%的部分合并为other. 3个样本(Back,Toluene,Benzoate)中变形菌门(Proteobacteria)占3个样本(Back,Toluene,Benzoate)的丰度较大,分别为55.65%、67.21%和62.44%,这主要因为Proteobacteria菌能长期生活在含有大量芳香族有机物的焦化土壤中[16-17]。在厌氧反硝化富集焦化土壤菌液中,降解甲苯的主要菌门为Proteobacteria、Firmicutes和Deinococcus-thermus,相对丰度分别为67.21%、22.52%和8.16%,这与文献研究得出厌氧降解甲苯菌群基本一致[18],推断出这三个菌门的细菌是富集菌液厌氧反硝化降解甲苯的重要菌群。在图3(a)中,降解苯甲酸样本的菌门主要为Proteobacteria、Firmicutes、Ignavibacteria、Deinococcusthermus、Bactercidetes和Actinobacteria,相对丰度分别为62.44%、7.54%、13.15%、8.89%、4.24%和1.28%,这包括了降解甲苯菌液中主要的菌门种类,这由于苯甲酸和甲苯降解过程的共代谢模型[19]。其中,从图3(a)可看出,与背景控制的菌门相比,降解甲苯菌液的三个菌门中Proteobacteria、Firmicutes和Deinococcus-thermus菌丰度分别增长了20.77%、142.67%和17.41%,Firmicutes菌的丰度增加量显著,从而说明降解甲苯菌液中菌种的优势门为Firmicutes.而相较于背景控制菌液,降解苯甲酸菌液样本中Proteobacteria、Ignavibacteria、Deinococcus-thermus和Bactercidetes菌丰度分别增加了12.20%、8.00%、8.89%和7.61%,但Fimicutes和Actinobacteria菌分别减少了18.75%和60.10%,这说明降解苯甲酸的优势菌门为Proteobacteria.在以甲苯或苯甲酸为碳源的焦化污染土壤富集菌液中,Proteobacteria门菌的相对丰度都最高,是能够降解广泛有机污染物生物除氮的主要细菌菌落[20]。3个样本(Back,Toluene,Benzoate)中大部分的细菌群落菌门均已分析(相对丰度分别为5.24%、2.11%和2.46%的微生物未分类以及未鉴定)。

图3 细菌群落结构分布Fig.3 Composition of the bacterial community structure
2.3.2菌群在纲上结构差异的分析
通过高通量测序检测三个样品(Back,Toluene,Benzoate)共得到15种细菌纲类,将低于1%和未检测到的菌群归于other,剩下主要菌群有12种,见图3(b).图3(b)为纲水平上的分类,背景对照中纲排序前三的菌群依次为α-proteobacteria、β-proteobacteria、Ignavibacteria,相对丰度分别为20.92%、17.77%、12.15%.降解甲苯土壤菌液中菌群纲类前三排序依次为α-proteobacteria、γ-proteobacteria、Bacilli,相对丰度分别为38.93%、20.47%、17.32%,是背景对照土壤中菌群相对丰度的1.86倍、1.87倍、2.14倍。降解苯甲酸土壤样本菌液中前三类纲排序为β-proteobacteria、Ignavibacteria、γ-proteobacteria,同时分别相对丰度为46.10%、13.15%、9.54%,是背景对照土壤中菌群相对丰度的2.59倍、1.08倍、0.87倍。其中,α-proteobacteria、γ-proteobacteria、Bacilli是降解甲苯土壤中的优势纲,而降解苯甲酸土壤中优势纲为β-proteobacteria.在3个样品中Proteobacteria主要包括α-proteobacteria、β-proteobacteria、γ-proteobacteria. α-proteobacteria和β-proteobacteria相对丰度较高,在缺氧或厌氧条件下,Proteobacteria的α-及β-纲的菌株能够使苯类物质在硝酸盐条件下发生还原反应[21],β-proteobacteria经常利用有机物分解产生的氨气、甲烷等营养物质。从图3(b)中观察到,α-proteobacteria、β-proteobacteria、γ-proteobacteria、Bacilli和Deinococci纲是降解苯甲酸和降解甲苯土壤中共同拥有的纲类,其中α-proteobacteria、γ-proteobacteria、Bacilli在甲苯降解菌液中的相对丰度比苯甲酸降解菌液的分别增加了33.00%、10.93%、10.02%,而降解甲苯土壤菌液中β-proteobacteria和Deinococci的相对丰度比苯甲酸菌液减少了38.33%和0.73%.这充分说明了各类纲在底物不同的条件下,菌种对菌液环境的适应性不同,各类菌种为了适应各自的能源环境而表现出来的微生物群落结构存在差异(相对丰度分别为5.24%、2.11%和2.46%的微生物未分类以及未鉴定)。
2.3.3菌群在属上结构差异的分析
为了能够进一步细化微生物菌群结构的差异性和菌群组成,以菌属为研究对象,2个样品(Toluene,Benzoate)共检测到44种细菌菌属。将低于1%和未检测到的菌属归于other,剩下主要菌属有16类,如图4所示。甲苯降解菌液中前三位菌属相对丰度排序:Exiguobacterium>Phyllobacterium>Citrobacter,分别占Deinococci、α-proteobacteria、γ-proteobacteria百分比为95.40%、41.70%、48.85%,Exiguobacterium是甲苯降解菌液的优势菌属。这充分说明在Deinococci纲中,Exiguobacterium菌属在甲苯降解土壤菌液环境中生存能力极强[16]。Phyllobacterium和Citrobacter菌属分别在α-proteobacteria纲和γ-proteobacteria纲中,相比其他菌属适应甲苯降解菌液能力较强。苯甲酸降解菌液菌属相对丰度排前三位的依次是:Azoarcus>Ignavibacterium>Truepera,分别占β-proteobacteria、Ignavibacteria、Deinococci百分比为86.96%、100%、99.78%,表明苯甲酸土壤菌液中Azoarcus为优势菌属,Azoarcus、Ignavibacterium、Truepera菌属在各自纲水平群落结构中占主要地位。2个土壤菌液样品(Toluene,Benzoate)共同享有的菌属包括Exiguobacterium、Citrobacter、Truepera、Acinetcbacter、Limnobacter、Pseudomonas,其中Exiguobacterium菌属在两种土壤菌液中相对丰度较高,说明Exiguobacterium属在两种菌液中能以甲苯或苯甲酸作为能源物质,进行自身细胞新陈代谢而增殖。此外,SHIM et al[22]培养Pseudomonas菌在纤维床生物反应器中缺氧降解苯系物。Exiguobacterium和Pseudomonas菌在富集海洋沉积物降解BTEX中也能得到[23]。甲苯降解菌液独有的微生物菌属有Phyllobacterium、Aquamicrobium、Thauera、Anaxybacter、Stappia、Alkaliphilusd,而苯甲酸降解菌液独有的菌属为Azoarcus、Ignavibacterium、Moheibacter、Parvibaculum、Lamia,其中Azoarcus是焦化污染土壤中厌氧反硝化降解苯甲酸的最主要菌属。LI et al[24]等应用基于16S rRNA基因的DGGE技术,甲苯脱氮降解菌中Azoarcus并不显著,而苯甲酸降解菌液中最佳匹配菌Thauera、Azoarcus和Thauera具有反硝化降解芳烃类有机物的能力[24]。在焦化土壤中,微生物菌落结构是一个具有差异的结构,环境中基质的不同导致微生物多样性也不同。在整个甲苯或苯甲酸降解过程中,很可能是好几种细菌起重要作用,也可能是许多微生物的共同协作来参与反应。因此,焦化土壤富集菌液中微生物菌群参与过程以及降解甲苯或苯甲酸的功能性基因特性需要探究,为厌氧修复焦化土壤技术层面增加依据。
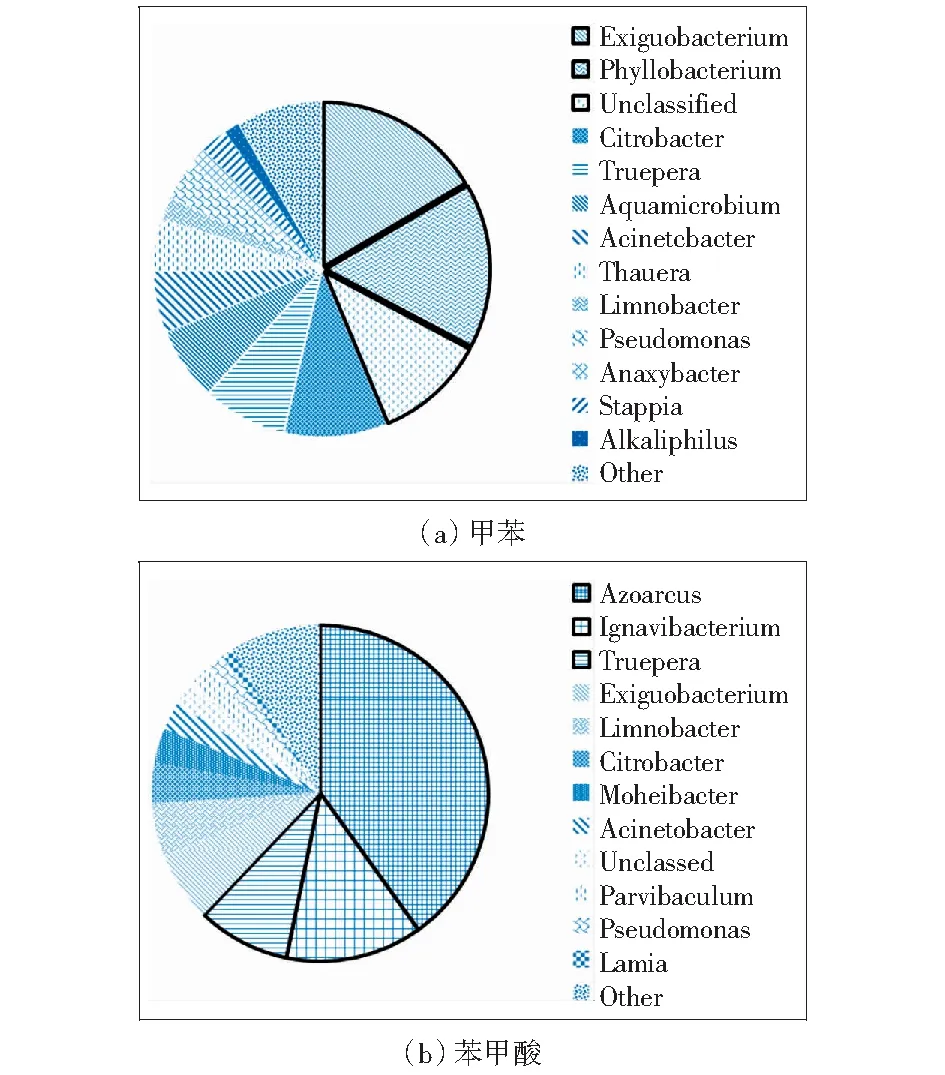
图4 细菌群落结构在属水平上的组成Fig.4 Composition of the bacterial community structure at genus level
3 结论
1) 在富集焦化污染土壤菌液过程中,微生物降解甲苯或苯甲酸与消耗硝酸盐的反应过程是同步进行的,本实验甲苯和苯甲酸的降解量与硝酸根的反应量实际比值分别约为1∶8.7和1∶5.9,这个数据和理论计量学比率在合理程度上可认为相近。
2) 在120 d厌氧脱氮富集焦化污染土壤菌液过程中,活性菌液微生物降解甲苯和苯甲酸的微生物菌群结构多样性都比背景对照样本中少一些,且两者之间菌群差异较大。焦化土壤中主要菌门为Proteobacteria,反硝化菌液中降解甲苯的优势门为Firmicutes,而降解苯甲酸菌液中的优势门为Proteobacteria.
3) α-proteobacteria、γ-proteobacteria、Bacilli是降解甲苯土壤中的优势纲,而降解苯甲酸土壤中优势纲为β-proteobacteria.
4)Exiguobacterium是甲苯降解菌液的优势菌属,而苯甲酸土壤菌液中Azoarcus为优势菌属,相对丰度分别为16.53%和40.09%.
