无花果多糖分离纯化工艺及抗氧化性能研究
2021-01-20蔡惠钿张逸
蔡惠钿,张逸
(1.华南农业大学 食品学院,广州 510642;2.华农(潮州)食品研究院有限公司,广东 潮州 521000)
无花果是桑科榕属开花植物,产于地中海沿岸,属亚热带落叶小乔木。近些年来,由于其广泛的观赏、食用价值,得到了大力培育和利用。
以无花果为原料的保健品食品不仅营养价值丰富,而且风味更加美味,相关的工艺技术研究多有报道。胡舰等[1]采用响应面法优化了无花果复配生姜汁嫩化狮子头的工艺。谭海刚等[2]利用无花果进行果醋酿造,研究了无花果果醋的最佳酿造工艺。无花果中包含大量营养物质如氨基酸、矿物质、维生素等,可以在分离纯化中保留下来,提高了无花果的利用效率。从王宇晴等[3]应用快速溶剂萃取法提取灵芝多糖的研究中可以看出,多糖分离纯化与温度密切相关,无花果作为一种保健型调味品,其多糖分离纯化最佳温度也是固定的,因其味道淡雅,已经得到广大消费者喜爱。
目前,国内无花果多糖分离纯化研究大多停留在实验阶段,其以生产工艺优化为主,各类产品繁多,应用于工业化生产较少。国外无花果多糖分离纯化研究主要是酵母菌研究,工业化生产规模较小,使用仪器分析方法测定的抗氧化活性结果并不具有代表性,实际应用价值较低。因此,为了丰富无花果市场,研究无花果多糖的分离纯化工艺及其抗氧化性能,对指导人们合理饮食,提高人体抗病能力,促进人体健康具有重要意义。
1 材料与设备
1.1 材料
无花果:由山东滨州永大三合无花果开发有限公司提供,品种为紫果,经过压榨后获取无花果残渣,在50 ℃条件下烘干无花果汁,粉碎后使用20目筛选备用。
试剂:浓硫酸,来自祁县汇鸿源化工公司;无水乙醇,来自济南双盈化工有限公司;石油醚,来自江苏省海安石油化工厂;氯仿,来自鲁西化工集团股份有限公司;正丁醇,来自山东诺尔化工有限公司;丙酮,来自南京建满化工有限公司;NaCl,来自无锡市亚泰联合化工有限公司;NaOH,来自临沂多彩化工有限公司;HCl,来自德州润昕实验仪器有限公司。
用水:由东莞市佰纯水处理设备有限公司生产的蒸馏水。
1.2 设备
高效液相系统 深圳市宝安区松岗天瑞环保设备厂;电子分析天平 河南省泰斯特仪器有限公司;蒸发仪 巩义市宇翔仪器有限公司;真空泵 深圳市炜圣钛电子有限公司;水浴锅 泰州市诚倍教学设备有限公司;超滤系统 东莞市绿城水处理设备有限公司;冷冻干燥机 江西南翔空压机有限公司。
2 试验方法
2.1 无花果多糖提取
从山东滨州永大三合无花果开发有限公司随机选取无花果,粉碎后得到50 g无花果渣。对无花果的干燥处理步骤如下:
检查无花果,尽可能确保无花果都没有伤痕,并且表面无其他物质,并在干燥之前清洗无花果[4-6]。用木锤或者普通的擀面杖敲击无花果,并尽可能保持完整,既不要捣成泥状或碎成很多块,也不要破坏它的果核,让它的果肉裂开[7-9]。然后将无花果浸入冷水中,需要完全淹没,确保没有露出来的[10-11]。这时可以用平底锅或其他比较重的东西将浮上来的压下去,之后使其中的水结成冰,然后降压,冰就会直接升华为水蒸气,从食品中逸出[12]。
经过干燥处理后,再用石油醚脱脂3次。之后向其中加入500 mL蒸馏水,在100 ℃温度下萃取3 h,过滤,再萃取滤渣,合并为滤液[13]。经浓缩至1/4的原体积后,需将浓缩后滤液中的蛋白质去除。在6次去蛋白后,缓慢加入4倍体积的由济南双盈化工有限公司生产的无水乙醇进行滤液沉淀,离心12 h后在4 ℃温度下采集沉淀物,由此获得无花果粗多糖[14]。
采用分子量为10 kDa的扁平纤维素超滤膜,将无花果多糖溶于水中进行超滤[15]。在60 ℃以下,采集分子量大于10 kDa的部分浓缩成1/4的原体积。慢慢加入无水乙醇,搅拌,在75%的浓度下,静置12 h,在3000 r/min的条件下离心,然后用无水乙醇和丙酮进行沉淀,冷冻干燥,由此获取无花果多糖。
2.2 无花果多糖理化性质分析
2.2.1 多糖测定
将100 mg粗多糖样品准确称量,制成10 mL的水溶液。粗多糖的吸光度与粗多糖样品的吸光度基本一致,其含量按标准方程计算[16]。多糖测定公式:

(1)
2.2.2 理化性质
经水提醇沉淀,去蛋白,除去小分子杂质,冷冻干燥后得到无花果多糖。表面呈淡灰色,无臭,易溶于水, pH值4.2,难溶于甲醇、乙醇、丙酮、醚等有机溶剂中。
碘-碘化钾反应为阴性,表明经水提醇后的无花果不含淀粉;茚三酮反应为阴性,表明产品无花果中不含有蛋白质; UV光谱分析表明无花果多糖在260,280 nm时,没有特征表示明显吸收蛋白质和核酸;在192 nm时,有一个吸收峰,表示糖的特征性吸收峰,见图1。

图1 无花果多糖的紫外光谱Fig.1 UV spectra of fig polysaccharides
无花果的阳性结果是含糖的,由多糖测定公式计算得到无花果多糖得率,采用苯酚-硫酸法测定总糖含量。在浓硫酸条件下,多糖经水解转化为单糖脱水。假如无花果试样中含有0.1 mol三糖、0.1 mol二糖和0.1 mol单糖,经硫酸处理后可转化为0.6 mol脱水单糖。再加入酚类物质,酚类物质与脱水的单糖形成彩色化合物,利用吸收光度法测定处理液中单糖含量。由此可知,苯酚-硫酸法实际测定的是总糖。
2.3 去除多糖中的色素
试验选取了S-8、NKA-9为极性树脂,AB-8、D-101为弱极性树脂,D3520为中极性树脂,X-5为非极性树脂。
从测定结果的对比中可以看出,考虑了极性和分子量,AB-8树脂对一般颜料和有机物质都有一定的吸附特性,并且有一定的孔径,比表面积大,比重大,纯化后的多糖回收率较高。综合考虑各种因素,确定高纯度的AB-8型树脂为最佳纯化树脂,不同孔径树脂对多糖纯度和回收率分析情况见表1。

表1 不同孔径树脂对多糖纯度和回收率分析情况Table 1 Analysis of polysaccharide purity and recovery rate by resins with different pore sizes
由表1可知,使用AB-8树脂,无花果多糖纯度达到最高,为75%;使用AB-8树脂和NKA-9树脂,多糖回收率达到最高,为70%。因此,选用AB-8树脂去除多糖中的色素效果最好。
2.4 去除蛋白质
无花果蛋白组分多糖的提取采用传统的 Sevag法和3%三氯乙酸法,而苯酚-硫酸法用于测定多糖含量,而双缩脲法用于测定蛋白质含量。不同方法除蛋白质成分比较见表2。

表2 不同方法除蛋白质成分比较Table 2 Comparison of protein components removed by different methods
由表2可知,使用 Sevag法和3%三氯乙酸法多糖损失率相差3%,其中Sevag法多糖损失率较高;而3%三氯乙酸法去除率较高,同样比Sevag法高3%。但是,使用3%三氯乙酸法易潮解,溶于水、乙醇、乙醚,试验更加方便。
2.5 NaCl洗脱
盐对多糖的纯化效果较差,但加入盐可增加树脂对杂质的吸附性,但浓度不能过高,否则会给以后透析带来较大影响。NaCl是一种白色晶体粉末,溶于丁烷后变成等离子体,该物质易溶于水,在酒精中分散的 NaCl能形成胶体。氯化氢的存在使其在水中的溶解度下降,在浓盐酸中几乎不溶,不易溶于乙醚。
基于此,不同浓度NaCl对多糖纯化的影响分析见图2。

图2 不同浓度NaCl对多糖纯化影响分析Fig.2 Analysis of the influence of NaCl with different concentration on the purification of polysaccharides
由图2可知,当NaCl浓度为0.01,0.05 mg/mL时,无花果多糖纯度在60%以下;而当NaCl浓度为0.02,0.03,0.04 mg/mL时,无花果多糖纯度在60%以上,且当NaCl浓度为0.03 mg/mL时,无花果多糖纯度最高,为76%,经综合考虑,最终选用0.03 mg/mL的NaCl溶液。
2.6 无花果多糖的分离纯化
因为无花果是多糖的混合物,为了得到均匀的成分,用AB-8型离子交换树脂进行分离,无花果用0.03 mg/mL的NaCl溶液进行梯度洗脱。再用苯酚-硫酸法测定无花果洗脱液中多糖,AB-8柱层析色谱图见图3。

图3 AB-8柱层析色谱图Fig.3 AB-8 column chromatography
由图3可知,在管数分别为10~20,20~30,30~40,40~50时出现多糖馏分,选用0.03 mg/mL NaCl溶液进行梯度洗脱,在管数为10~20,30~40时出现脱峰,说明这两个时期无花果多糖的分离纯化效果较好。
3 抗氧化性能试验结果与分析
3.1 清除超氧阴离子自由基
超氧自由基是一种常见的自由基,其氧化能力很强。超氧阴离子自由基的清除量是测定抗氧化活性时常用的一项重要指标。
通过周期性的介孔硅胶与烟酰胺腺嘌呤二核苷酸相互作用产生超氧阴离子, 硝基四氮唑蓝通过还原作用产生最大吸收量。在该吸收条件下,研究超氧阴离子去除率的吸收变化,吸收度值越小,清除率越高。超氧阴离子的清除活性见图4。
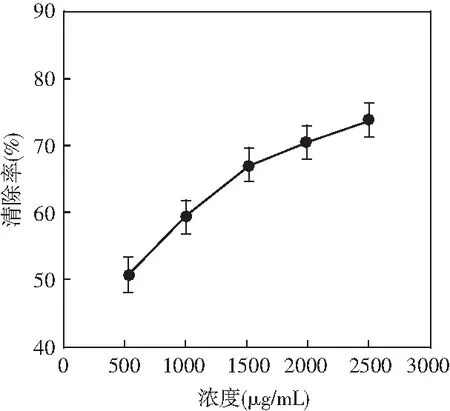
图4 超氧阴离子的清除活性分析Fig.4 Analysis of scavenging activity of superoxide anions
由图4可知,随着浓度增加,超氧阴离子的清除效率也随之增加,当浓度为500 μg/mL时,清除效率达到最低,为50%;当浓度为2500 μg/mL时,清除效率达到最高,为75%。根据分析结果,无花果清除超氧阴离子效率最高为75%。
3.2 清除羟基自由基
羟基自由基·OH 是一种非常活跃的活性氧,有很强的氧化能力。由于邻二氮菲-Fe2+溶液反应生成的羟基自由基·OH在空气中被氧化成邻二氮菲-Fe3+,此时溶液呈橙红色。随着溶液不断反应,最大吸收峰消失,此时可以在溶液中继续添加邻二氮菲-Fe2+,通过褪色程度来衡量羟基自由基·OH的清除效果。
配制不同浓度的无花果,测定其对羟基自由基·OH的清除率,结果见图5。
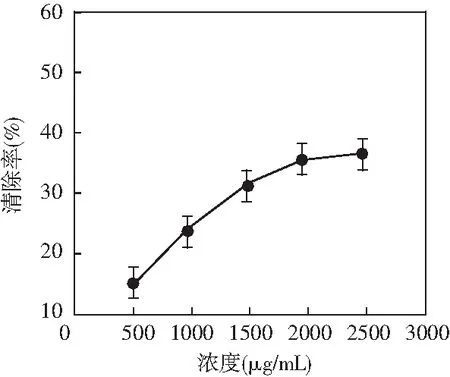
图5 羟基自由基·OH的清除率Fig.5 The scavenging rate of hydroxyl radicals
由图5可知,无花果多糖在处理过程中存在一定清除羟基自由基·OH能力,随着溶液浓度增加,清除率逐渐增强,根据分析结果可知,无花果多糖清除羟基自由基的最高效率为38%。
3.3 还原能力测试
抗氧化剂提供电子,以自身的还原作用清除羟基自由基·OH。还原力越强,抗氧化能力越强;在铁氰化钾体系中,Fe3+在抗氧化剂促进下被还原为Fe2+,Fe2+在AB-8柱层析色谱图中被发现。吸收度值越大,还原性越强。无花果多糖的还原能力测定结果见图6。

图6 无花果多糖的还原能力测定结果Fig.6 Determination results of reducing capacityof fig polysaccharides
由图6可知,无花果多糖图像显示了一定的还原能力,并且随浓度的增加逐渐增强。在1000 μg/mL浓度下,还原量最大,吸光度在0.05左右,达到最高。
3.4 试验结论
无花果中多糖组分还原能力与单糖还原端暴露量有关,如果纯化单糖的还原端组分未暴露,那么将直接影响其还原效果。无花果多糖还具有还原铁离子作用,随着无花果溶液浓度增加,还原程度越高,并且抑制羟基自由基·OH无规则转移,保障羟基自由基·OH能够转变为更加稳定的产物,使无花果在反应过程中自动终止羟基自由基·OH一系列的反应。
通过上述测试内容可知,当浓度为2500 μg/mL时,无花果多糖清除超氧阴离子效率最高为75%。当浓度为2500 μg/mL时,无花果多糖清除羟基自由基的最高效率为38%。在1000 μg/mL浓度下,还原量最大,吸光度在0.05左右,达到最高。说明纯化后的无花果多糖抗氧化活性明显强于未纯化的无花果。原因在于多糖的活性与分子量、溶解性、黏度和结构有关,多糖类分子量越大,越不利于跨膜行动,多糖分子进入生物体进行生物活动的可能性就越低。小分子多糖更容易结合,而过低的活性位点和过低的分子量会阻碍活性聚合结构的形成,相对分子质量适宜的多糖活性高。
4 结束语
无花果的营养价值很高,多糖是无花果果实的主要活性成分。无花果多糖的提取、分离纯化方法随着科学技术的进步也在不断更新。相信在未来无花果多糖生产中将出现更加高效、环保的新技术。
试验结果表明,粗多糖具有很强的清除超氧阴离子自由基的能力,还具有很强的还原能力,由此说明无花果具有很强的抗氧化能力。但是,该试验只对其体外抗氧化作用进行了部分研究。接下来可通过在其他物质上试验来研究其在有机体内清除自由基的效果。
