女贞子改善家禽肝脏损伤的作用机制
2021-01-20张云露张海涵谷雪玲谢凯桓宋泽和
张云露,张海涵,谷雪玲,谢凯桓,宋泽和,贺 喜
(湖南农业大学动物科学技术学院,饲料安全与高效利用教育部工程研究中心,湖南家禽安全生产工程技术研究中心湖南畜禽安全生产协同创新中心,湖南长沙 410128)
女贞子为木犀科植物女贞(Ligustrum lucidum Ait)的干燥成熟果实,别名冬青子,主要分布在我国湖南、四川、江苏、浙江和陕西等地,是治疗肝病最常用的补肝中药之一[1]。齐墩果酸(OA)是女贞子的主要活性成分之一,具有护肝、免疫调节、抗氧化和抗炎等生物活性功能[2]。在我国OA 已被作为治疗人类肝脏疾病的非处方口服药物,其最重要的药理特性是对急性化学性肝损伤和慢性肝纤维化及肝硬化的保肝作用,具有药理活性强、易获得、生产成本低等优点[3]。
肝脏是保障家禽正常生产的主要器官,也是脂肪酸代谢的中心器官,在营养过剩和肥胖的情况下,肝脏脂肪酸代谢发生改变,通常会使肝细胞内甘油三酯堆积,并导致非酒精性脂肪肝(NAFLD)的发生[4];肝脏还是关键的前线免疫组织,含有体内最大的网状内皮细胞吞噬系统,是机体与外界交互的重要屏障[5]。在家禽生产中,病毒、细菌、寄生虫、营养代谢紊乱及饲养管理不当均能引起肝脏损伤,导致肝炎、脂肪肝、肝硬化或纤维肝等,从而降低家禽的免疫力及生产性能[6]。本文对OA 的护肝作用机理及其研究进展进行综述,以期为女贞子在家禽生产中的应用和推广提供理论支持。
1 家禽肝脏损伤现状
在家禽生产过程中,造成动物机体肝脏损伤的因素有很多。其中,病原微生物侵染或毒素导致的肝损伤最为常见。黄曲霉毒素是曲霉属真菌的次生代谢产物,在家禽饲料中广泛存在,黄曲霉毒素会导致家禽病理性肝炎及肝损伤,生产性能降低从而引起经济损失。研究表明,饲喂含黄曲霉毒素日粮组的肉鸡血清中碱性磷酸酶和谷丙转氨酶显著高于对照组,总蛋白及白蛋白浓度明显低于对照组,表明黄曲霉毒素对肉鸡肝脏会造成显著损伤[7]。禽霍乱由多杀性巴氏杆菌感染引起,给养鸡业造成巨大的经济损失,鸡霍乱的爆发往往伴随着坏死性肝炎[8];禽腺病毒4 型是一种引起严重肝病的肝炎病毒,观察发现该病毒是通过凋亡、自噬和严重的炎症反应诱导肝损伤[9]。由于机体代谢紊乱引起的肝损伤在家禽生产中也时常发生。其中,氧化应激和内质网应激会引起肝细胞凋亡,在不同程度上造成家禽肝脏损伤[10];脂肪肝出血综合征是一种广泛存在于蛋鸡体内的代谢性疾病;NAFLD 的发病率增加通常与肥胖有关,可能由多种因素引起,如营养、激素、环境和代谢[11]。生产管理不当也会导致家禽肝脏的代谢负担过重或异常代谢从而引发肝脏损伤,如在家禽生产中过量给予扑热息痛可能会导致严重的肝损伤及肝坏死[12]。此外,脂多糖、新城疫及镉等均可导致家禽肝脏损伤。由此可见,肝脏作为家禽完成生理代谢的核心器官,在实际生产过程中极易受到外界因素的影响发生损伤或炎症,从而影响到机体生产性能的发挥,成为制约产业发展的潜在因素。
2 肝脏损伤对家禽生产的危害
肝脏是关键的免疫器官,可以检测出通过肠道进入人体的病原体,捕获和清除细菌、病毒及大分子。该器官包含动物体中最大的吞噬细胞集合,是动物与外界之间的重要屏障。肝脏中众多免疫细胞群体之间的动态相互作用是维持免疫平衡和整体组织健康的关键,在没有感染的情况下过度发炎会导致无菌的肝损伤,组织损伤和重塑[13]。家禽肝脏损伤会造成家禽代谢紊乱,免疫力下降,进而影响家禽的存活率、生长性能及产蛋量等。蛋鸡爆发鸡弯曲杆菌性肝炎,会导致产蛋量下降甚至急性死亡[14]。最近,在我国的许多养鸡场中出现了一种暂时称为肝破裂出血综合征(HRHS)的禽类疾病,流行病学数据显示,在带有HRHS 的养殖场中,混合感染多种病毒,HRHS 主要引起腹部积血,肝出血和脾肿大,从而增加鸡的死亡率并降低产蛋率[15]。脂肪肝出血综合征是家禽中最常见的非传染性死亡原因,可造成家禽腹部脂肪增多,产蛋量突然下降,影响产蛋量峰值[16]。此外,肝脏损伤还可影响肠道菌群,进而影响家禽生产性能,肠道屏障的破坏会通过肠肝轴增加肝脏的微生物丰度,肝脏也可通过胆汁酸和IgA 抗体的分泌对肠道微生物群落产生影响[17]。Arab 等[18]研究发现,家禽发生肝硬化时会影响其肠道菌群。因此,保护肝脏健康是家禽养殖过程中不可忽略的问题。
女贞子的主要入药部位为女贞子果,因其对肝脏的滋补作用而被广泛应用[18]。OA 为女贞子的主要活性成分,在临床上主要用于护肝。日粮中添加女贞子可显著降低蛋鸡的死亡率、卵裂率、低密度脂蛋白胆固醇、血清胆固醇、甘油三酯和丙氨酸转氨酶水平,以0.25%的添加量为佳,女贞子可作为提高蛋鸡后期生产性能的有效添加剂[20]。郭晓秋等[21]研究发现,女贞子水煎剂对固始鸡免疫功能有一定促进作用。
3 女贞子保护肝脏的作用机制
OA 是一种具有生物活性的五环三萜化合物,其化学结构式见图1,呈淡黄色,不可挥发,可溶于1-丁醇及乙酸乙酯,较少溶于甲醇、乙醇、2-丙醇、丙酮和水,其溶解度随温度升高而增大[22]。王沛君等[23]利用紫外分光光度法对通过4 种方法从女贞子中提取的OA 含量进行精密测定,发现回流提取法中OA 含量最高,为13.13 mg/g。大鼠经口服OA 后,可被血液吸收,OA在血液中吸收稍快,在45 min 左右达到峰值,经吸收后,OA 被快速清除(t1/2=62.80 min)[24-25]。而在人体中,口服30 mg OA,3 h 后血清中OA 的吸收达到峰值[26]。Yu 等[27]研究设计并合成了2 种OA 前体药物,给6 只大鼠静脉注射OA 前体药物,通过研究其血浆药代动力学和体内生物分布,发现前药随着时间的流逝逐渐减少,大部分前药从粪便中排泄,大多数母体药物在30 min内在体外释放。OA 口服的生物利用度很低,主要是通过被动扩散在肠道进行吸收,肠道黏膜中存在的外排蛋白又将OA 外排到肠腔,会导致其吸收不佳,OA 经注射给药后,主要会分布在脾、肺和肾组织,OA 通过灌胃给药则主要分布在大鼠胃肠道中,其分散体制剂能有效提高溶出度和生物利用度,同时使其浓集于肝脏,对于肝部位疾病有良好的治疗效果[28]。因此在OA 应用与实际畜禽生产时,需考虑其制剂工艺,从而提高其作为饲用添加剂的利用效率。
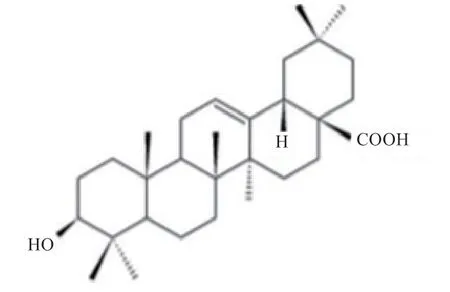
图1 齐墩果酸化学结构式
3.1 通过调节肝脏脂质代谢 脂肪过度沉积会造成NAFLD,未经及时治疗会导致肝脏细胞大量脂肪变性,甚至坏死,该病在家禽生产中常有发生,通常与高脂饮食有关,而OA 可以有效降低肝脏脂肪含量。Nyakudya等[29]研究发现果糖可以诱导大鼠NAFLD,而OA 可以有效预防果糖诱导的NAFLD。OA 可改善大鼠体重/肝脏重量比,并显著降低血浆甘油酸三酯(TGs)和极低密度脂蛋白(VLDL),OA 还降低了胆固醇调节元件结合蛋白的表达和肝内TG,表明OA 可以通过预防肝内脂肪蓄积降低NAFLD 的风险[30]。Djeziri 等[31]用OA 治疗肥胖小鼠,也发现小鼠肝脏脂肪组织减少,并改善了葡萄糖耐量、胰岛素水平、血浆脂多糖、肝胆固醇和TGs 的浓度。肝X 受体(LXRs)和碳水化合物反应元件结合蛋白(ChREBPα/β)是肝新生脂肪形成的关键蛋白,而LXRα是肝X 受体的一种,控制着动物机体重要的生物学和病理生理过程,例如脂质体内平衡。Fan 等[32]试验发现,LXRα在葡萄糖诱导的肝脏脂肪组小鼠中是肝脏脂肪生成和ChREBPα的重要调节剂。Lin 等[33]研究表明,OA 能显著降低LXRα靶基因的mRNA 和蛋白质表达,发现OA 可以选择性地抑制脂肪生产。AMPK 是一种高度保守的代谢主要调节因子,能在细胞和生理水平上恢复代谢压力下的能量平衡,AMPK 的治疗潜力已得到广泛认可,并被广泛用于治疗代谢性疾病,例如糖尿病、肥胖症、炎症和癌症[34]。3-乙酰基油酸是OA 的衍生物,可显著降低高脂饮食大鼠的体重、肝脏重量、血清总胆固醇、甘油三酯及低密度脂蛋白胆固醇水平,并有效改善高脂饮食大鼠肝脏中的脂肪沉积和细胞凋亡,且有研究发现3-乙酰基油酸可能是通过AMPK 相关途径对NAFLD 大鼠高脂血症具有保护作用[35]。肝代谢的微调对于维持全身的动态平衡和预防疾病的发生是必不可少的,过氧化物酶体增殖物受体γ辅助活化因子-1β(PGC-1β)是肝代谢的转录关键因子,具有调节线粒体功能、糖异生和脂代谢的功能,在肝脏中,PGC-1β可促进脂肪酸和甘油三酯合成的相关基因表达,从而加快新生脂肪形成[36]。Chen 等[37]研究表明,PGC-1β是维持肝脏脂质稳态的重要调节器,OA 可以降低PGC-1β的肝表达水平,提示OA 的降血脂作用可能是由miR-98-5p/PGC-1β介导的。由此推测,OA 可通过调节肝脏脂质代谢,预防家禽脂肪肝病的发生,但其作用机制仍需进一步研究。
3.2 提高肝脏抗炎能力 家禽肝炎是一种复杂的疾病综合征,由多种不同因素引起,大部分是由细菌或病毒引起,对家禽生产造成损失。王利等[38]研究发现,女贞子水煎液对雏鸡传染性法氏囊炎有良好的预防效果,推荐使用浓度为50~100 g/L。OA 可以通过作用于炎症细胞因子发挥其抗炎作用,Wang 等[39]连续3 d 给小鼠进行皮下注射OA,预处理结束后对小鼠静脉注射20 mg/kg刀豆球蛋白A(ConA)引起急性肝损伤,发现OA 预处理降低了血清肝酶及炎性细胞因子的释放,提高了过氧化物酶体增殖物激活受体α(PPARα)的表达水平,并可降低c-Jun NH2 末端激酶(JNK)的磷酸化,从而防止了ConA 介导的肝损伤。Djeziri 等[31]研究表明,经过OA 治疗的小鼠,肝脏和脂肪组织中促炎性细胞因子IL-1β和IL-6 有所下调。Li 等[40]也有相似的发现,合成的一系列齐墩果酸类似物均可抑制NO 产生,IC50为2.66~41.7 μmol/L,同时OA 对LPS 诱导的肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素6(IL-6)的产生具有抑制作用。此外,法尼酯衍生物X(FXR)、G 蛋白偶联胆汁酸受体1(GPBAR1)和G 蛋白偶联胆汁酸受体5(TGR5)是3 个重要的胆汁酸受体,OA 还可能是通过激活FXR、GPBAR1 和TGR5 来降低肝脏的炎症反应[41]。因此,虽然OA 在家禽上的研究不多,但其显著的抗炎作用可减少家禽生产中炎症的发生,保护肝脏功能,并具有新型饲料添加剂的开发潜力。
3.3 其他 OA 主要通过调节脂质代谢、抗炎作用发挥护肝作用。此外,OA 还可通过其他途径发挥其肝脏保护作用。研究发现,OA 减弱了肝癌细胞的迁移和侵袭能力,并抑制小鼠的肿瘤细胞增殖,OA 还可激活诱导型一氧化氮合酶(iNOS),进而促进一氧化氮的产生,表明iNOS 可能是OA 的潜在靶点[42]。OA 可以降低肝癌HepG2 细胞的活力,IC50 为30 μmol/L,OA 还可引起HepG2 细胞形态的显著变化并有抑制其集落形成的潜力,并通过阻断JNK/p38 信号通路抑制肝癌细胞的迁移和侵袭[43]。另外,还可以利用OA 对胆汁酸转运蛋白的良好亲和力设计并合成一系列OA 的衍生物,其中2 种OA 衍生物具有对肝癌细胞的选择性细胞毒性,例如HepG2 和BEL-7402 细胞[44]。OA 增加了小鼠细胞核中的Nrf2 蛋白,OA 可能是直接通过Nrf2 激活介导了MRP2、MRP3 和MRP4 表达的影响,减轻了小鼠阻塞性胆汁淤积[45]。OA 衍生物可以防止CCl4 诱导的肝纤维化的发展[46]。OA 预处理可抑制缺血性再灌注损伤(IRI)后血清转氨酶水平和肝组织学评分的升高,并显著上调了肝脏中Sesn2、PI3K、Akt 和HO-1 的表达,该保护机制可能与OA 诱导的HO-1/Sesn2 信号通路有关[47]。综上所述,OA 通过其他途径同样能发挥有效的护肝作用,但其在家禽生产中的应用研究较少,在保护家禽肝脏健康等方面的作用机制也有待进一步的探索与研究。
虽然小剂量OA 对肝脏有保护作用,但高剂量和长期使用OA 可导致肝损伤,表现为胆汁淤积。这种矛盾的肝毒性作用不仅发生于OA,还发生于其他OA 型三萜类化合物,OA 使用时间和剂量对肝保护和肝毒性的能力有差异[41]。中草药引起的肝毒性逐渐被人们认识并受到全球关注。鉴于OA 作为膳食补充剂及其作为替代药物的使用,还应深入了解它的肝毒性,进一步了解其对肝脏保护的机制。
4 小 结
肝脏在家禽生产中发挥着重要作用,肝脏健康是家禽生产中面临的主要问题之一。女贞子具有良好的护肝作用,女贞子提取物可以有效提高家禽生产性能,这可能与OA 的护肝作用密切相关,但其在家禽生产中的应用较少,其使用时间和剂量等问题仍需进一步研究。
