有氧运动通过心肌细胞吞运内皮细胞来源外泌体抑制细胞凋亡
2021-01-20吴方南田振军
吴方南,李 卓,田振军*
(1.陕西师范大学 体育学院暨运动生物学研究所,陕西 西安 710119;2.西安交通大学生命科学与技术学院,陕西 西安 710049)
心肌梗死(myocardial infarction,MI)是危害人类生命健康的严重疾病之一,MI后心肌出现缺血缺氧和炎症反应,心脏梗死区出现缺血性坏死,伴随心肌细胞凋亡,导致心功能明显下降(Jinatongthai et al.,2017;Reed et al.,2017)。心梗的预防和康复手段是国内外临床医师和学者们高度关注的问题。临床研究发现,适宜的运动训练改善MI心脏心功能,降低心肌梗死的复发率及死亡率(Asaria et al.,2017)。动物实验证实,运动训练抑制心肌细胞凋亡,促进血管新生并减缓心肌纤维化,增强大鼠心功能(Cai et al.,2018;Xi et al.,2016),因此,适宜的运动锻炼能作为心梗后康复的有效手段,但运动康复的作用靶点及其机制仍需研究完善。
外泌体(exosome)是由细胞分泌产生的大小为30~150 nm的小膜泡。多种细胞在正常及病理状态下产生核内体,经细胞内溶酶体微粒内陷产生多囊泡体,多囊泡体外膜与细胞膜融合后释放到细胞外环境形成外泌体,因此在机体的血液、汗液、尿液、唾液等体液中存在大量的外泌体(El Andaloussi et al.,2013;Tkach et al.,2016)。研究发现,外泌体是细胞间通讯的重要途径,作为生物信息的载体,其包含诸多miRNAs、DNA和蛋白质等生物信息物质。现有研究认为,外泌体可作为载体递送蛋白,调节细胞内通讯,促进心脏肥大(Datta et al.,2017);心包液中的外泌体富含的miRNAs具有促进血管新生的作用(Beltra‐mi et al.,2017);外泌体也可以作为蛋白药物载体,运输特定靶点蛋白(Cho et al.,2018;Dougherty et al.,2017)。外泌体作为参与体内细胞间运输、信息交换和物质循环的重要载体,鲜见其在运动促进心梗心脏的康复中发挥重要作用的研究。
外泌体作为囊泡运输调节机制的重要途径,在体内循环、免疫、神经调节等生理过程中发挥重要作用。研究表明,不同运动方式均可激活体内能量代谢关键蛋白激酶AMPK,对此,在细胞实验中,采用AMPK激动剂AICAR干预,模拟细胞的运动刺激(Narkar et al.,2008),探讨AICAR干预促进H9C2细胞吞运HUVEC细胞来源外泌体抑制细胞凋亡的可能途径。
1 材料与方法
1.1 主要仪器和试剂
主要仪器:Bio-Rad电泳仪及凝胶成像系统、Leica倒置荧光显微镜、Olympus正置光学显微镜、VINNO6心动彩超仪、小动物运动跑台等。
主要试剂:AICAR(selleck,S1802)、LPS(Sigma,L4130)、PKH26(上海宇玫博)、外泌体抽提试剂盒(上海宇玫博)、CD9(abcam,ab236630)、CD81(abcam,ab79559)、Bcl-2(CST,#15071)、Bax(abcam,ab32503)、cleaved-Caspase3(abcam,ab2303)等。
1.2 动物分组及运动方案
动物分组:在西安交通大学动物饲养中心购得C57/BL6小鼠24只,随机分成3组,每组8只。分组包括假心梗组(S组)、心梗组(MI组)和心梗运动组(ME组)。适应性饲养1周后对MI组和ME组进行左心室冠状动脉前降支结扎(left anterior descending of the coronary artery,LAD)手术制备心梗模型,S组小鼠仅开胸穿线,不结扎,作为手术对照。
运动方案:术后休息1周,对ME组小鼠进行6周跑台运动,运动方案为:12 m/min,60 min/天,5天/周×6周(Schefer et al.,1996)。
1.3 小鼠心动超声检测及取材
心动超声检测:小鼠运动结束后异氟醚麻醉,备皮后手术台固定,使用小鼠超声探头获取心脏长轴M型超声图,测量左心室收缩末期内径(left ventricular internal dimension systole,LVIDs)和左心室舒张末期内径(left ventricular internal dimension diastolic,LVIDd),软件计算左心室短轴缩短率(fractional shortening,FS)和射血分数(ejection fractions,EF)。
心脏取材:6周运动结束24 h后,小鼠进行异氟醚麻醉并固定,低温环境开胸迅速摘取心脏于液氮或甲醛保存。液氮冻存的心脏组织用于分子检测,甲醛固定的组织用于形态学检测。
1.4 石蜡切片Masson和TUNEL染色
Masson染色:心脏组织甲醛固定48h后,流水冲洗4 h,进行常规石蜡包埋和切片操作,严格按照Masson染色试剂盒操作说明进行心脏Masson染色。光学显微镜观察并拍照,Image Pro Plus软件统计胶原容积百分比(collagen volume fraction%,CVF%)。
TUNEL检测:严格按照TUNEL凋亡检测试剂盒操作说明进行。5 μm石蜡切片脱蜡脱水,滴加蛋白酶K置于湿盒中,37℃孵育30 min,PBS清洗5 min×5次,于湿盒中37℃避光孵育TUNEL检测液1 h,PBS清洗5 min×5次,封片剂封片,荧光显微镜下观察阳性颗粒。
1.5 HUVEC和H9C2细胞培养及分组
细胞培养方法:采用10%FBS DMEM培养基于37℃CO2恒温培养箱培养大鼠心肌细胞(H9C2),采用不含外泌体的细胞培养基培养人脐静脉内皮细胞(human um‐bilical vein endothelial cells,HUVEC)。在干预细胞前统一更换为不含牛血清及外泌体的培养基,使用AMPK激动剂(acadesine,AICAR)模拟细胞水平运动效应,脂多糖(lipopolysaccharides,LPS)诱导细胞损伤模型。
细胞干预分组:使用无外泌体培养基培养HUVEC细胞,提取外泌体;使用外泌体(exo)、AMPK激动剂(AICAR,2 mmol/L,24 h)、脂多糖(LPS,10 μg/mL,4 h)干预H9C2细胞,将H9C2细胞分为正常组(H9C2),+LPS+exo组,+AICAR+LPS+exo组。
1.6 外泌体提取及鉴定
100 mm培养皿培养HUVEC细胞,在HUVEC细胞长至对数生长期时更换为无外泌体培养基继续培养,24 h后收集细胞培养基。按照外泌体提取试剂盒抽提外泌体。提取后的外泌体分别进行纳米颗粒示踪分析(Nanoparti‐cle Tracking Analysis,NTA)鉴定和Western Blotting检测。
取20 μL外泌体并按体积比例加入5×loading buffer后100℃变性,Western Blotting检测外泌体标志蛋白CD9、CD81、TSG101,连续上样3次排除误差。粒径结果和Western Blotting结果显示,抽提到的外泌体分布在100~150 nm,且外泌体marker鉴定结果为阳性,表明HUVEC细胞可分泌产生外泌体(图1)。
1.7 外泌体内吞实验
使用PHK26红色荧光孵育外泌体,将外泌体按照等量体积(96孔板每孔加30 μL外泌体,6孔板每孔加100 μL外泌体)加入H9C2细胞孵育培养24 h,检测H9C2细胞对外泌体的吞运情况。
1.8 培养细胞TNUEL检测
严格按照TUNEL检测试剂盒操作。收集细胞,PBS洗1次,4%多聚甲醛固定细胞30 min后,制备细胞涂片。0.3%PBS稀释的Triton X-100室温孵育样品5 min,PBS洗3次×5 min/次。在样品上加50 μL TUNEL检测液,37℃避光孵育60 min,PBS洗3次×5 min/次,封片。荧光显微镜下观察TUNEL阳性颗粒。
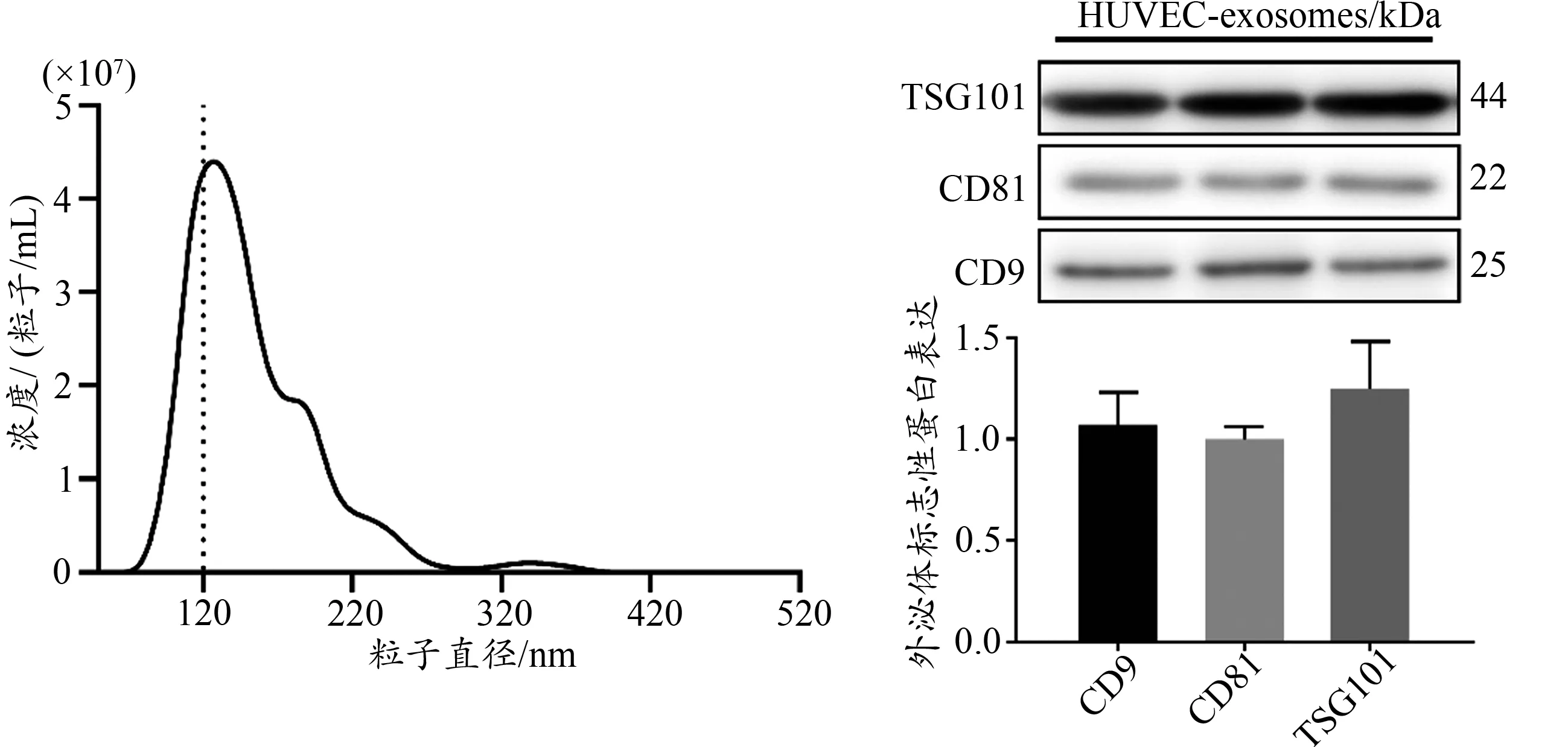
图1 外泌体NTA及Western Blotting鉴定结果Figure 1.NTA and Western Blotting Identification of Exosomes
1.9 培养细胞Hoechst 33342染色
使用标准6孔板培养H9C2细胞,待条件培养完成后更换为无血清培养基,将浓度为100×的Hoechst 33342活细胞染色液稀释为1×,1 mL培养基添加10 μL Hoechst 33342染色液,37℃孵育30~60 min后PBS洗3次。荧光显微镜下观察,细胞核高亮、皱缩则判断为凋亡细胞阳性。
1.10 蛋白提取和Western Blotting
动物蛋白提取:剪取50 mg液氮保存的心脏组织,加入300 μL提前配制的裂解液混合物,冰浴下匀浆,离心取上清进行BCA蛋白定量,后按比例加入5×loading buf‐fer,蛋白变性后用于Western Blotting检测。
细胞蛋白提取:收集细胞蛋白,按比例加入蛋白抽提液,超声震荡破裂蛋白,4℃离心,取蛋白上清,进行BCA蛋白定量。
Western Blotting实验:SDS-PAGE凝胶电泳分离蛋白,湿转法转膜,室温下5%BSA封闭1 h,4℃过夜孵育一抗。次日TBST清洗,室温孵育二抗1 h,再次TBST清洗。滴加ECL发光液,凝胶成像系统发光成像。
1.11 数据统计与处理
Western Blotting结果图片使用Image J进行灰度统计,Hoechst 33342核染色,TUNEL实验计数阳性颗粒数目。使用SPSS进行单因素方差分析(one-way ANOVA),结果以平均数±标准差(M±SD)表示,选择95%置信区间。并使用GraphPad Prism 8进行作图。
2 实验结果
2.1 有氧运动抑制心梗小鼠心肌细胞凋亡
小鼠心脏石蜡切片TUNEL检测(TUNEL阳性颗粒为绿色荧光)细胞凋亡阳性颗粒数目,与S组比较,MI组细胞凋亡数目显著增加(P<0.05);与MI组比较,ME组细胞凋亡数目显著减少(P<0.05,图2)。
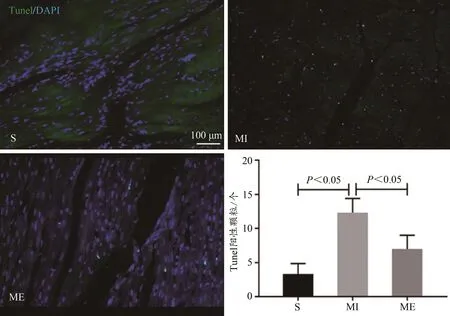
图2 小鼠心肌TUNEL染色观察与统计结果Figure 2.TUNEL Staining Results of Myocardium
提取小鼠心肌蛋白,Western Blotting检测凋亡相关蛋白Bax、Bcl-2和 cleaved-Caspase3,与 S组比较,MI组 Bax/Bcl-2比值和cleaved-Caspase3蛋白表达显著升高(P<0.05);与MI组比较,ME组Bax/Bcl-2比值和cleaved-Caspase3蛋白表达显著降低(P<0.05),表明心梗诱发小鼠心肌细胞凋亡,有氧运动显著抑制心梗后心肌细胞凋亡(图3)。
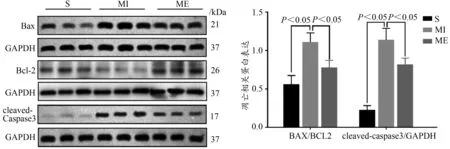
图3 小鼠心肌Bax、Bcl-2和cleaved-Caspase3蛋白表达结果Figure 3.Expression of Apoptotic Proteins Bax,Bcl-2 and cleaved-Caspase3 in Myocardium
2.2 有氧运动降低心梗心肌纤维化并改善心功能
小鼠超声心动图(图4)结果显示,与S组比较,MI组LVIDd和LVIDs显著增加(P<0.01),EF和FS显著降低(P<0.01);与MI组比较,ME组LVIDd和LVIDs显著降低(P<0.01),EF和FS显著增加(P<0.01),表明有氧运动显著改善心梗小鼠心功能。

图4 小鼠心动超声图及心功能指标检测结果Figure 4.Echocardiography and Cardiac Function Test Results in Mice
心肌Masson染色观察显示,心肌胶原纤维呈蓝色,心肌纤维呈红色。与S组比较,MI组显著增加(P<0.05);与MI组比较,ME组显著降低(P<0.05,图5),表明有氧运动显著降低心梗心肌CVF%,减缓心梗心肌纤维化。
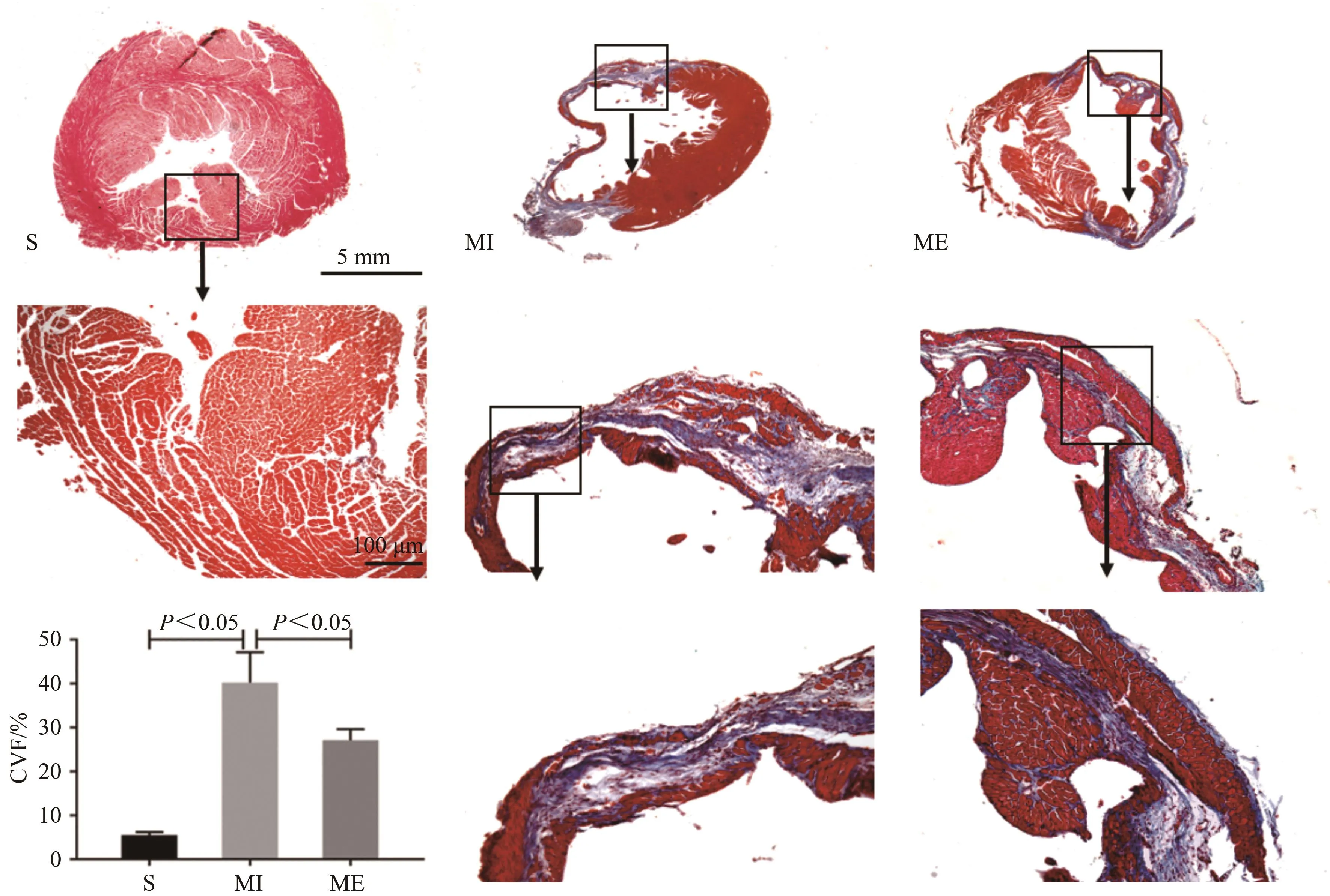
图5 心梗小鼠心脏Masson染色结果Figure 5.Masson Staining Results in the Heart of Myocardial Infarction Mice
2.3 运动促进H9C2细胞吞运HUVEC细胞来源的外泌体
使用AICAR和LPS干预H9C2细胞,并使用HUVEC细胞分泌的外泌体孵育H9C2细胞,PKH26(红色荧光)标记外泌体,α-Actinin(绿色荧光)标记H9C2细胞。结果显示,正常组(H9C2组)无外泌体,与单纯LPS诱导的H9C2凋亡组比较,AICAR干预24 h显著促进H9C2对外泌体的吞运(图6),表明运动干预促进H9C2细胞对HUVEC细胞来源的外泌体的内吞。
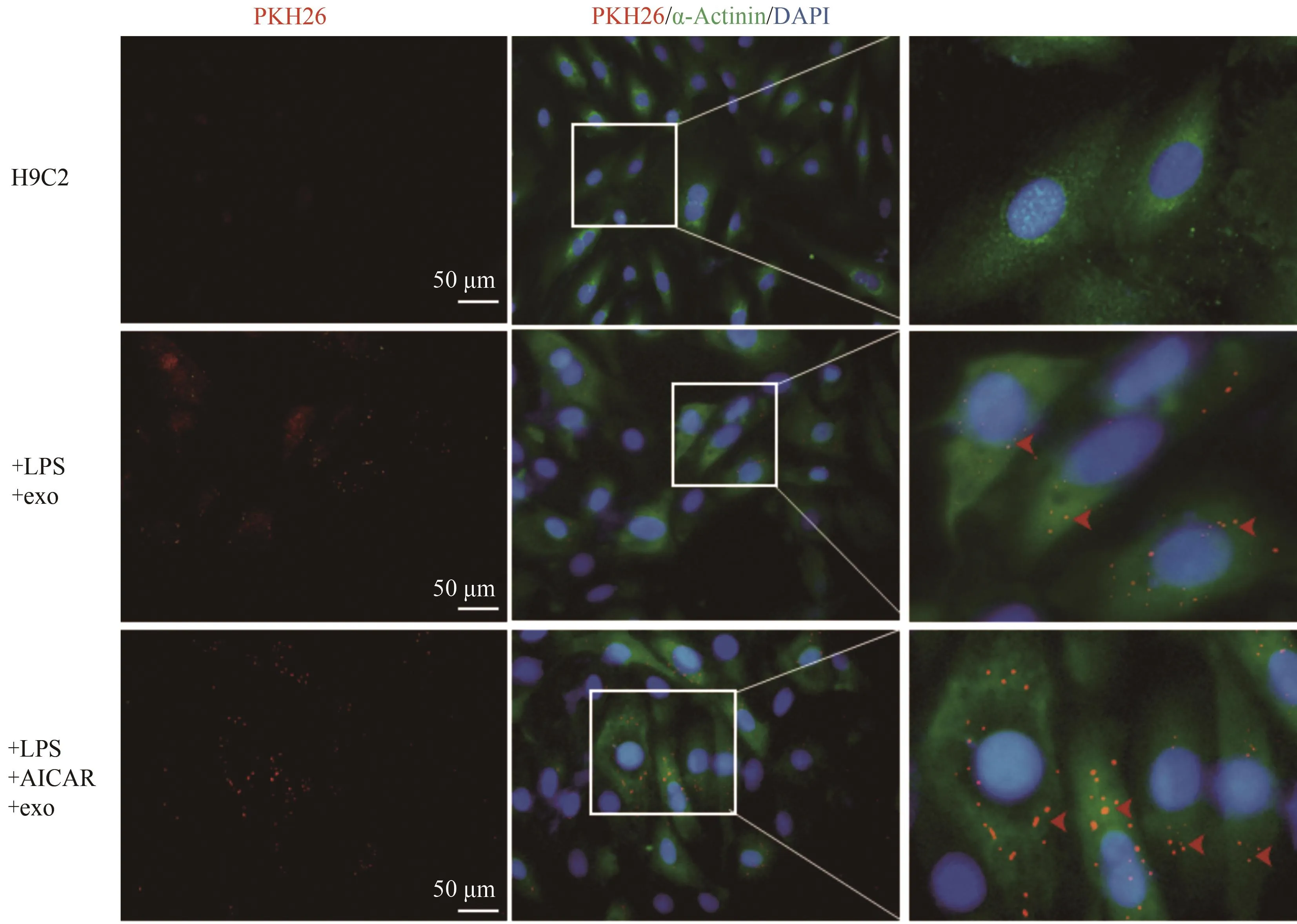
图6 外泌体内吞免疫荧光实验结果Figure 6.Results of Immunofluorescence Experiment of Exocytosis
2.4 运动促进心肌细胞吞运外泌体抑制LPS诱导的H9C2细胞凋亡
使用Hoechst33342细胞核固缩染色和TUNEL标记凋亡细胞,核固缩染色中凋亡细胞核呈紧密、固缩、高亮的蓝色荧光,TUNEL标记中红色荧光为凋亡阳性细胞。结果显示,使用外泌体孵育细胞后,与单纯LPS诱导的H9C2凋亡组比较,AICAR干预后显著抑制H9C2细胞凋亡(P<0.05,图7),表明AICAR干预促进H9C2细胞内吞外泌体,显著抑制心肌细胞凋亡。
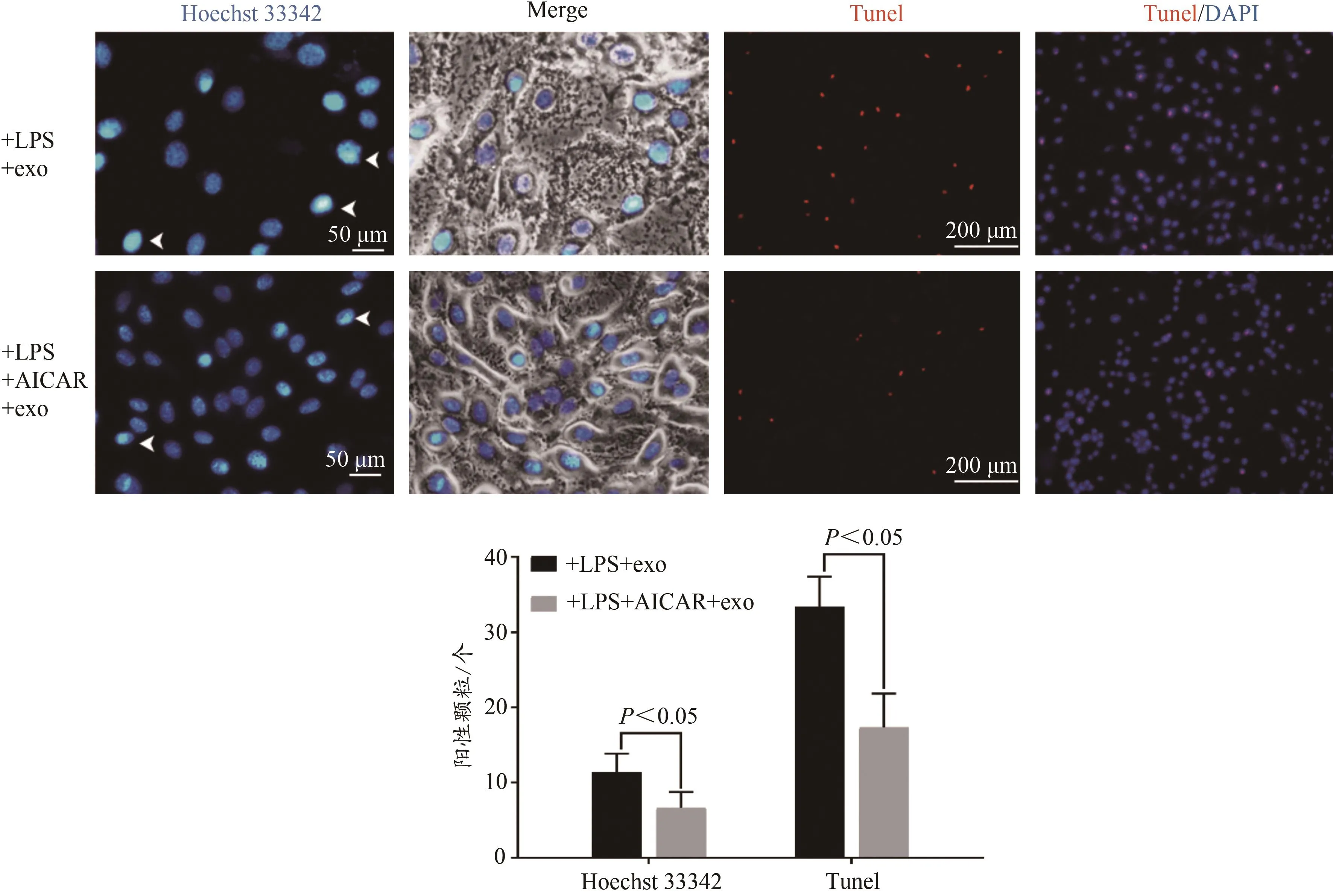
图7 Hoechst 33342染色及TUNEL检测H9C2细胞凋亡实验结果Figure 7.Hoechst 33342 Staining and TUNEL Detection of H9C2 Apoptosis
Western Blotting检测凋亡相关蛋白Bax、Bcl-2和cleaved-Caspase3,与单纯LPS诱导的H9C2凋亡组比较,AIACR干预后Bax/Bcl-2比值和cleaved-Caspase3蛋白表达显著降低(P<0.05),表明同样使用外泌体孵育细胞后,AICAR干预显著抑制H9C2细胞凋亡(图8)。
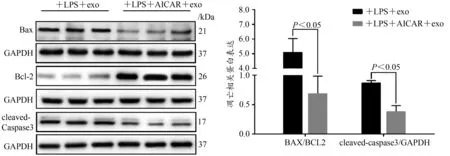
图8 H9C2细胞凋亡相关蛋白Bax、Bcl-2和cleaved-Caspase3蛋白表达结果Figure 8.Expression of Apoptotic Proteins Bax,Bcl-2 and cleaved-Caspase3 in H9C2 Cell
3 讨论
外泌体由机体的多种组织细胞分泌产生,广泛存在于动物血液、汗液和尿液等体液中。作为细胞间信息传递的新途径,外泌体在心血管、免疫和肿瘤等诸多疾病中均发挥作用,因此备受关注(Grigorian-Shamagian et al.,2017;Hervera et al.,2018;Riazifar et al.,2019;Ricklefs et al.,2018)。外泌体作为载体可携带的miRNAs,DNA,蛋白质等生物信息物质,在机体不同生理、病理环境下会产生不同变化(Goetzl et al.,2017)。运动后机体汗液、循环血量、尿液等会发生适应性变化,如分泌汗液增加、循环血量增加等,这些体液随着运动产生变化,而外泌体大量存在于其中,因此外泌体很大程度受运动调节。有研究将外泌体作为载体,向猪模型心梗心脏特异性注射外泌体,使其作为“补丁”改善心功能,证实外泌体具有修复心梗心脏的功能(Gao et al.,2018)。然而,运动能否通过调节外泌体的内吞效率,在心梗心脏的预防或康复中发挥作用,仍有待深入研究。因此,本研究以运动对机体细胞外泌体内吞效率的影响为研究思路,旨在探讨运动对外泌体内吞的影响及其对外泌体抑制心肌细胞凋亡的调节作用。
心肌细胞可通过血液循环实现与血管内皮细胞的交叉对话(Kivela et al.,2019),血管内皮细胞对心肌细胞的保护作用受运动调节。运动训练刺激内皮细胞释放包括激素、蛋白和microRNA等组分,参与心肌细胞的保护(De Keulenaer et al.,2017)。然而,鲜见关于内皮细胞释放的外泌体能否被心肌细胞内吞的报道。因此,本研究提取HUVEC内皮细胞分泌产生的外泌体干预H9C2心肌细胞,观察内皮细胞释放的外泌体在心肌细胞中的内吞效果。荧光染色结果显示,标记外泌体的PKH26(红色荧光)与心肌细胞骨架蛋白α-Actinin(绿色荧光)发生共定位(图6),证实心肌细胞能够内吞内皮细胞释放的外泌体。目前鲜见研究探讨运动对外泌体内吞效率的影响,为此本研究采用AICAR模拟运动刺激(Narkar et al.,2008),发现与LPS+exo组比较,LPS+exo+AICAR组外泌体内吞数量显著增加(图6),表明模拟运动干预增加心肌细胞对外泌体的内吞效率。上述结果提示,运动可能通过促进心肌细胞内吞内皮细胞释放的外泌体,提高心肌细胞外泌体的内吞效率。
细胞凋亡是在生物体中发生的程序性细胞死亡的一种形式,是生化事件导致细胞特征性变化和死亡,这些变化包括细胞皱缩、核破裂、染色质浓缩和染色体DNA片段化等(Fritsch et al.,2019;Newton et al.,2019)。适度细胞凋亡对于生物体的稳态至关重要,但过度凋亡则促进多种心血管疾病的发生和发展(Zhang et al.,2018a)。心肌细胞凋亡受各种应激因素诱导,如某些细胞因子、氧化应激、DNA损伤和铁依赖型死亡等。因此,抑制心肌细胞凋亡是心梗心脏康复的重要靶点之一。外泌体作为体内多种生物活性物质的载体,通过运输传递各类生物信息的方式,在多种组织器官中参与调控细胞凋亡的发展进程。骨组织相关研究发现,间充质干细胞分泌的外泌体通过运载miR-21至髓核细胞,调节免疫反应和细胞凋亡(Cheng et al.,2018;Zhang et al.,2018b)。在胸腺癌细胞中外泌体介导的lncRNA转运进入癌细胞后,促进癌细胞的凋亡进程(Wang et al.,2018)。心肌细胞研究发现,运动促进miR-342-5p分泌并通过外泌体途径靶向缺血性心脏的心肌细胞,通过抑制心肌细胞凋亡改善缺血心脏心功能,且主动脉内皮细胞是运动后循环系统外泌体miR-342-5p增加的主要来源(Hou et al.,2019)。在此基础上,本研究通过检测凋亡相关指标发现,与外泌体单独干预比较,外泌体和AICAR合并干预后TUNEL阳性颗粒数目、Bax/Bcl-2比值和cleaved-Caspase3显著降低(图7~图8),表明外泌体和模拟运动协同干预抑制细胞凋亡的效果显著优于外泌体单独干预。同时,在体研究表明,运动抑制心梗心肌细胞凋亡,改善心功能。提示,运动可能通过促进细胞外泌体吞运方式,发挥抑制细胞凋亡的作用,也表明运动在外泌体运输过程中可能发挥重要作用(图9)。
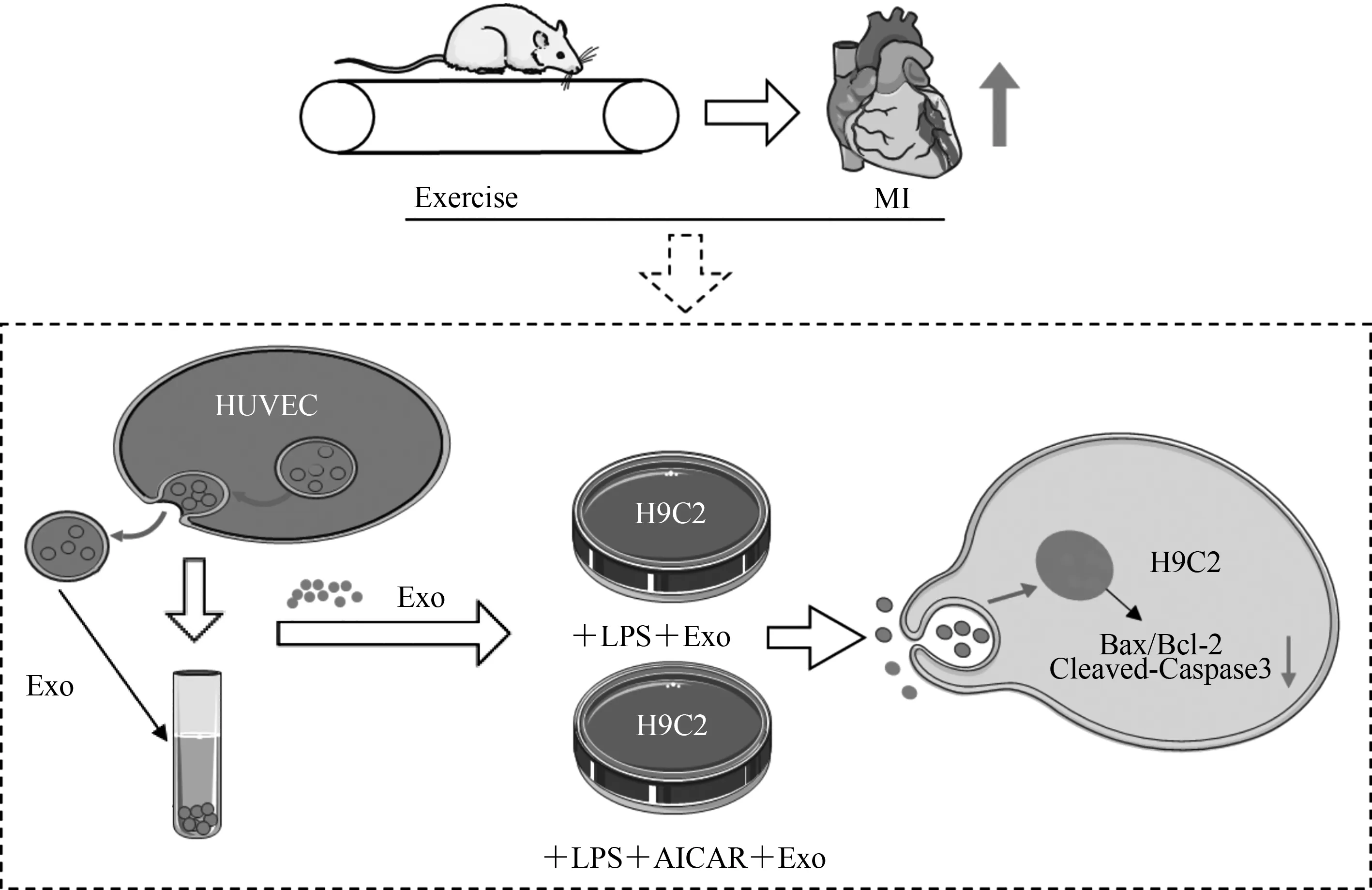
图9 运动可能通过促进心肌细胞外泌体内吞抑制心肌细胞凋亡Figure 9.Exercise Inhibits Myocardial Apoptosis by Promoting Exocytosis of Myocardial Cells
运动效应可能通过改变细胞对外泌体的内吞效率进而对细胞凋亡产生影响,直接提取运动干预后的外泌体进行动物注射干预和体外细胞培养,检测外泌体内吞变化,对细胞外泌体内吞过程进行高分辨率实时动态追踪检测,能更加全面反映运动对外泌体运输过程的影响,这有待进一步深入研究。
4 结论
有氧运动显著抑制心梗心肌细胞凋亡,改善心功能;HUVEC内皮细胞可分泌产生外泌体,且AMPK激动剂AICAR显著促进H9C2心肌细胞对HUVEC细胞来源的外泌体内吞,抑制H9C2心肌细胞凋亡。推测,运动可能通过促进心肌细胞外泌体内吞,抑制心肌细胞凋亡,改善心梗心功能。
