中药材鹿心分子鉴定方法及检测试剂的研究
2021-01-19王艳双姜海瀛刘美琳高丽君李明成孙丽媛张丽华艾金霞
王艳双,姜海瀛,刘美琳,高丽君,李明成, 3,孙丽媛,张丽华,艾金霞, 3*
中药材鹿心分子鉴定方法及检测试剂的研究
王艳双1, 3,姜海瀛2,刘美琳1,高丽君2,李明成2, 3,孙丽媛2,张丽华4,艾金霞2, 3*
1. 北华大学医学院,吉林 吉林 132013 2. 北华大学医学技术学院,吉林 吉林 132013 3. 北华大学 吉林省中药DNA指纹检测技术科技创新中心,吉林 吉林 132013 4. 吉林雷宁食品药品检测技术服务有限公司,吉林 吉林 132013
建立中药材鹿心DNA指纹鉴定方法,研发鹿心DNA检测试剂盒。以梅花鹿和马鹿mtDNA基因作为靶基因,设计小片段特异性引物,研制鹿心DNA提取及PCR检测试剂;应用分子克隆及测序技术,克隆鹿心对照药材;并对试剂的特异性、重现性、稳定性及灵敏度进行考察;对市售鹿心样品进行真伪鉴定。自主研发的试剂提取鹿心的DNA浓度纯度均达到PCR的要求;在退火温度为63 ℃时引物的特异性最强;克隆测序后的鹿心DNA序列与鹿心mtDNA特异指纹区段序列一致;自主研发的试剂重现性、稳定性良好,灵敏度达到0.5%;对市售30个鹿心样品进行检测,伪品率为40%。建立的鹿心DNA指纹鉴定方法特异、准确、可靠,研制的鹿心DNA检测试剂盒操作简便、结果稳定。
鹿心;DNA指纹鉴定;DNA检测试剂盒;分子克隆;测序技术
鹿心为为哺乳纲偶蹄目鹿科鹿属动物梅花鹿Temminck或马鹿Linnacus的心脏[1]。鹿心为吉林省的习用药材,收载在《吉药管注字》[2000]第132号。传统中医认为鹿心具有养气补血、安神的功效,以鹿心为主要原料的“心脑康胶囊”(国药准字号Z20063078),用于冠心病、心绞痛及脑动脉硬化症疗效显著[2-3]。由于鹿心药效独特,疗效确切,其市场价格也较高,大量伪品和混淆品(多为性状相似的猪心、马心、牛心、羊心等)以假乱真现象严重,影响着人们的生命安全。
中药材传统的鉴定方法包括基原鉴定、性状鉴定、显微鉴定、理化鉴定,容易受主观因素及加工炮制的影响[4],市售鹿心多为炮制过的干燥品,目前,鹿心尚无法定的质量标准,亦无明确的功效成分,很难通过传统方法进行鉴定。中药材品种的差异性归根结底是由物种的遗传物质DNA的不同引起的,随着分子生物学技术的发展,依据DNA在不同生物个体的差异来鉴别生物物种的分子鉴定技术正逐步成为中药鉴定的主要手段。《中国药典》2020年版一部收录了川贝母、乌梢蛇、金钱白花蛇以及蕲蛇的分子鉴定方法[5-8]。植物类中药材如紫苏、独活、西洋参、当归、绞股蓝、红景天、浙贝母等的分子鉴定有相关文献报道[9-15],鹿源类中药材的分子鉴定如鹿茸、鹿血、鹿鞭、鹿胎的研究也有相关报道[16-19],但是鹿心的分子鉴定及检测试剂的研究未见相关报道。
因此,本研究利用鹿心、猪心、马心、牛心、羊心、驴心在DNA水平上的差异,以梅花鹿和马鹿线粒体DNA细胞色素b(mtDNA)基因为靶基因设计小片段的特异性引物,采用PCR技术、分子克隆及测序技术,建立中药材鹿心DNA指纹鉴定方法,在此基础上开发出鹿心DNA检测试剂盒,在分子水平上为鹿心真伪鉴定提供一种标准化、规范化的检验方式。
1 材料与仪器
1.1 材料
鹿心对照药材、鹿心干燥样品(梅花鹿鹿心1、2,马鹿鹿心1、2,60~80 ℃烘烤)均由白城市食品药品检验所提供,猪心、马心、牛心、羊心、驴心购自吉林市食品市场(60~80 ℃烘烤后备用)。DL100bp Marker、DNA回收试剂盒、pGM-T载体连接试剂盒、DH5α感受态细胞、质粒DNA小量提取试剂盒、氨苄青霉素(Ampicillin, Amp)、5-溴-4-氯-3-吲哚-β--半乳糖苷(5-bromo-4-chloro-3-indolyl β--galactoside- gal)、异丙基-β--硫代吡喃半乳糖苷(Isopropyl- β--thiogalactopyranoside,IPTG)、2×Taq PCR Master Mix均购自北京天根生化科技有限公司;引物由上海生物工程有限公司合成。市售鹿心样品信息见表1。
1.2 仪器
D3024R型高速冷冻离心机(SCILOGEX公司,美国);D1008E型掌上离心机(大龙创兴实验仪器有限公司);T100型PCR仪(美国BIORAD公司);电泳仪、电泳槽(北京君意东方电泳设备有限公司);UV WHITE-2020D型紫外凝胶成像分析仪(美国BIORAD公司);微量核酸蛋白分析仪:美国Quawell(6000+);千分之一的电子天平、万分之一的电子天平[奥豪斯仪器(常州)有限公司];ZKW-C型恒温水浴锅(上海树立仪器仪表有限公司)。
2 方法
2.1 鹿心DNA提取检测试剂盒的设计
试剂盒为20次用量,由7部分组成,包括DNA提取和PCR扩增(表1)。

表1 自主研发DNA提取及PCR检测试剂盒的组成及特征
2.2 基因组DNA的提取及质量鉴定
2.2.1 自主研发的试剂盒法提取的基因组DNA取供试样品5 g,置乳钵中,充分研磨使成粉末,取样品粉末100 mg置1.5 mL离心管中;加入P1细胞裂解液500 μL[1 mol/L Tris-HCl(pH 7.5)1 mL,0.5 mol/L EDTA 2 mL,NaCl 0.58 g,10% SDS 10 mL,20 mg/mL蛋白酶K 1 mL,加双蒸水定容至100 mL;RNA 酶 5 μL],充分混匀,在55 ℃水浴保温1 h;加到DNA纯化柱中,10 000 r/min离心3 min,弃去过滤液,加入P2洗脱液600 μL[5 mol/L KAc 26 μL,l mol/L Tris-HCI(pH 7.5)18 μL,0.5 mol/L EDTA(pH 8.0)3 μL,无水乙醇 480 μL,无菌双蒸水73 μL],10 000 r/min离心1 min;弃去过滤液,反重复洗脱2次,弃去过滤液,再离心2 min;将DNA纯化柱转移入另一离心管中,加入P3无菌双蒸水100 μL,室温放置10~20 min后,10 000 r/min离心2 min;离心液即供试品DNA溶液,置−20 ℃保存备用。另取鹿心阳性对照药材100 mg,同法制成阳性对照药材模板DNA溶液。
2.2.2 基因组DNA浓度及纯度的测定 将上述提取的模板DNA原溶液1 μL,加样到微量核酸蛋白分析仪的加样孔上,使用计算机分析软件自动呈现出260 nm和280 nm的吸光度()值、核酸的纯度(260/280)值以及核酸浓度值(260×50 ng/μL)。
2.3 PCR扩增对鹿心引物特异性的检测
以“2.1”项提取的DNA为模板,利用鹿心基因特异性鉴别引物F:5’-TCATCGCAGCAC- TCGCTATAGTACACT-3’,R:5’-ATCTCCAAGC- AGGTCTGGTGCGAATAA-3’,扩增片段长度为194 bp,利用自主研发的试剂盒进行PCR扩增。PCR反应总体积为25 μL,包括23 μL反应体系(PCR反应管内包括2×Taq PCR Master Mix 12.5 μL,Primer F(12.5 μmol/L)1 μL,Primer R(12.5 μmol/L)1 μL,ddH2O:8.5 μL)和DNA模板2 μL。利用梯度PCR仪,反应参数:94 ℃预变性 5 min,循环反应30次(94 ℃、30 s,55~65 ℃、30 s,72 ℃、30 s),延伸72 ℃、5 min。另取无菌ddH2O,作为空白对照。并同时利用基因通用引物[14]正向:5’-TACCATGAGGAC- AAATTACATTCTG-3’,反向:5’-CCTCCTAGTT- TGTTAGGGATTGATCG-3’,进行PCR扩增,扩增片段长度约500 bp。反应参数:94 ℃预变性5min,循环反应34次(94 ℃、30 s,57 ℃、30 s,72 ℃、30 s),延伸72 ℃、5 min。PCR扩增结束后,使用1.5%琼脂糖凝胶检测PCR结果。
2.4 鹿心对照药材的克隆及测序
取50 μL鹿心对照药材的特异性PCR产物进行琼脂糖凝胶电泳,回收纯化目的基因;将目的基因与pGM-T载体连接,16 ℃过夜,组成重组子;碎冰上将重组子转入DH5α感受态细胞,增殖4 h后取菌液30 μL涂布于含Amp、-gal和IPTG的LB固体培养基上,37 ℃过夜,进行蓝-白斑筛选阳性重组子;挑选白色菌落,放入含Amp的LB液体培养基中培养12~16 h,次日提取质粒DNA进行PCR扩增验证为阳性重组体,送至上海生工进行测序。样品均采用正、反2个引物双向测序,测序结果分别与每一个样品靶基因进行比对分析。扩增区域DNA序列与靶基因特异性指纹区段DNA序列同源性为100%,确定为鹿心DNA阳性标准对照液。
2.5 DNA提取试剂的性能评价
2.5.1 重现性试验 选取鹿心正品和同一批次的提取DNA试剂,分别在3个实验室,由3位技术人员提取基因组DNA,每人重复5次,对DNA的完整性、浓度及纯度进行分析,观察DNA提取试剂的重现性。
2.5.2 稳定性试验 利用SPSS17.0分析软件,对重现性分析所得数据进行统计学分析,并计算RSD,观察DNA提取试剂的稳定性。
2.6 PCR检测试剂的性能评价
2.6.1 特异性试验 对鹿心正品及其易混品基因组DNA进行PCR特异性扩增,观察引物的特异性。
2.6.2 重现性试验 对鹿心正品及其易混品分别在3个实验室,由3位技术人员检测相同样品,观察试剂的重现性。
2.6.3 稳定性试验 随机挑选1个试剂盒分别在试剂配制的第3、6、9、12个月,对鹿心正品基因组DNA进行PCR特异性扩增,观察试剂的稳定性。
2.6.4 灵敏性试验 鹿心对照药材初始样本量分别为100、50、20、10、5、2、1、0.5、0.2、0.1、0.05 mg,提取基因组DNA,进行PCR扩增,检测琼脂糖凝胶电泳分析试剂的灵敏度。
2.7 自主研发的试剂盒检测市售鹿心样品
使用自主研发的鹿心DNA指纹检测试剂盒,对市售30个鹿心样品进行真伪的鉴定,并与白城市食品药品检验所鉴定结果进行比对。
3 结果与分析
3.1 基因组DNA的提取及质量鉴定结果
自主研发试剂提取出鹿心基因组DNA,通过紫外分光光度法测定260/280值在1.7~1.9,计算出的质量浓度为120~150 ng/µL,达到PCR实验的要求(表2)。

表2 鹿心正品及其伪品DNA纯度及浓度检测结果
3.2 PCR扩增对鹿心引物特异性的检测
利用特异性引物进行PCR扩增后,鹿心对照药材和鹿心正品均在194 bp处有1条特异性扩增条带,伪品及空白对照均无条带;利用通用引物进行PCR扩增后,大约在500 bp所有的样品均出现1条条带,空白对照无条带(图1)。
3.3 鹿心标准对照液的克隆及测序结果
经过分子克隆蓝-白斑筛选,氨苄阳性平皿出现蓝-白菌落(图2)。挑区白色菌落培养后,提取质粒DNA,经特异性引物PCR扩增验证条带的位置(图3)。将鹿心质粒DNA送至上海生工进行测序,比对分析结果显示,特异性引物扩增区域DNA序列与梅花鹿基因特异性指纹区段DNA序列完全一致,同源性为100%,与马鹿基因特异性指纹区段DNA序列同源性为96%,与其他伪品序列比对结果均显示没有发现明显的相似性。因此将梅花鹿鹿心DNA克隆液确定为鹿心DNA阳性对照液(图4),装入鹿心DNA指纹检测试剂盒中。
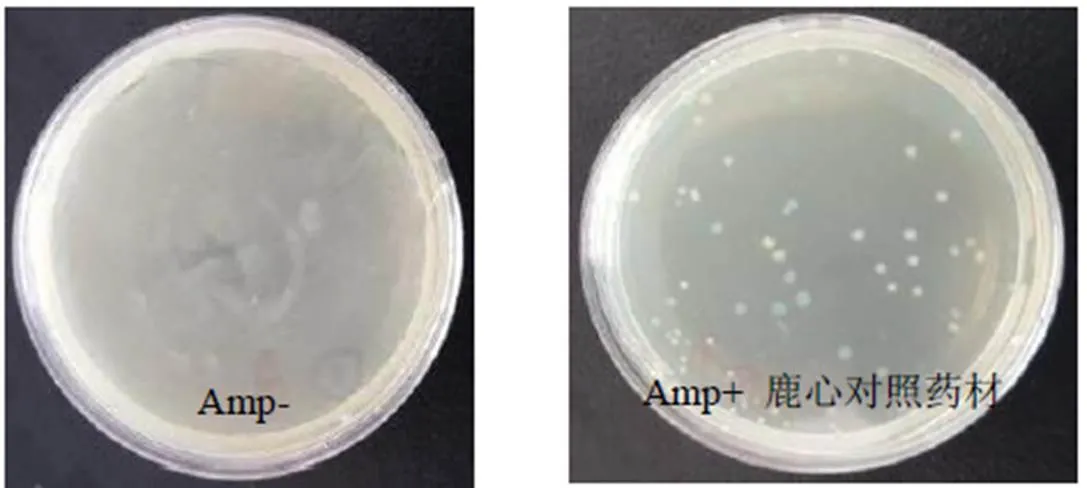
图2 鹿心DNA分子克隆蓝--白斑筛选图
3.4 DNA提取试剂的性能评价
3.4.1 重现性试验 紫外分光光度法检测提取的基因组DNA,纯度在1.7~1.9,质量浓度在130~150 ng/μL。表明自主研发的鹿心DNA提取试剂重现性良好。
3.4.2 稳定性试验 (1)组内分析:第1组基因组DNA的纯度(1.789±0.029),RSD为1.60%,DNA的质量浓度(148.190±2.219)ng/μL,RSD为1.49%;第2组基因组DNA的纯度(1.778±0.040),RSD为2.28%,DNA的质量浓度(141.070±2.837)ng/μL,RSD为2.01%;第3组基因组DNA的纯度(1.809±0.031),RSD为1.74%,DNA的质量浓度(147.78±3.930)ng/μL,RSD为2.66%。(2)组间分析:基因组DNA的纯度(1.792±0.035),RSD为1.96%,DNA的质量浓度(145.68±4.510)ng/μL,RSD为3.10%。可见无论组内和组间的标准差和RSD都很小,表明各组数据非常接近,离散度非常低。证实自主研发的鹿心DNA提取试剂稳定性良好。

图4 鹿心质粒DNA测序与梅花鹿mtDNA Cytb基因比对结果
3.5 PCR检测试剂的性能评价
3.5.1 特异性试验 使用自主研发的鹿心DNA指纹检测试剂盒进行试验,鹿心对照液(A)、鹿心对照药材(B)和鹿心样品均在194 bp处有1条特异性扩增条带,而猪心、牛心、马心、羊心、驴心及空白对照均未出现扩增条带。
3.5.2 重现性试验 使用自主研发的鹿心DNA指纹检测试剂盒,由3个实验室的3个技术人员进行试验,鹿心对照液、鹿心对照药材和鹿心样品均在194 bp处有一条特异性扩增条带,而猪心、牛心、马心、羊心、驴心样品及空白对照均未出现扩增条带。
3.5.3 稳定性试验 使用自主研发的鹿心DNA指纹检测试剂盒进行试验,试剂配制后的3、6、9、12个月鹿心对照液、鹿心对照药材和鹿心样品均在194 bp处有1条特异性扩增条带,而空白对照未出现扩增条带。
3.5.4 灵敏度试验 使用自主研发的鹿心DNA指纹检测试剂盒进行试验,随着样品取样量的减少,PCR产物条带的亮度逐渐降低,取样量为0.5 mg时,PCR产物条带清晰可见,取样量低于0.5 mg时,PCR产物条带均隐约可见模糊不清。因此,自主研发的鹿心DNA指纹检测试剂盒检测的灵敏度为0.5%。
3.6 自主研发的试剂盒检测市售鹿心样品检测结果
使用自主研发的鹿心DNA指纹检测试剂盒进行检测,市售30个鹿心样品,18个是正品(有特异条带),12个是伪品(无特异条带),伪品率为40%。与白城市食品药品检验所鉴定结果一致(图5)。
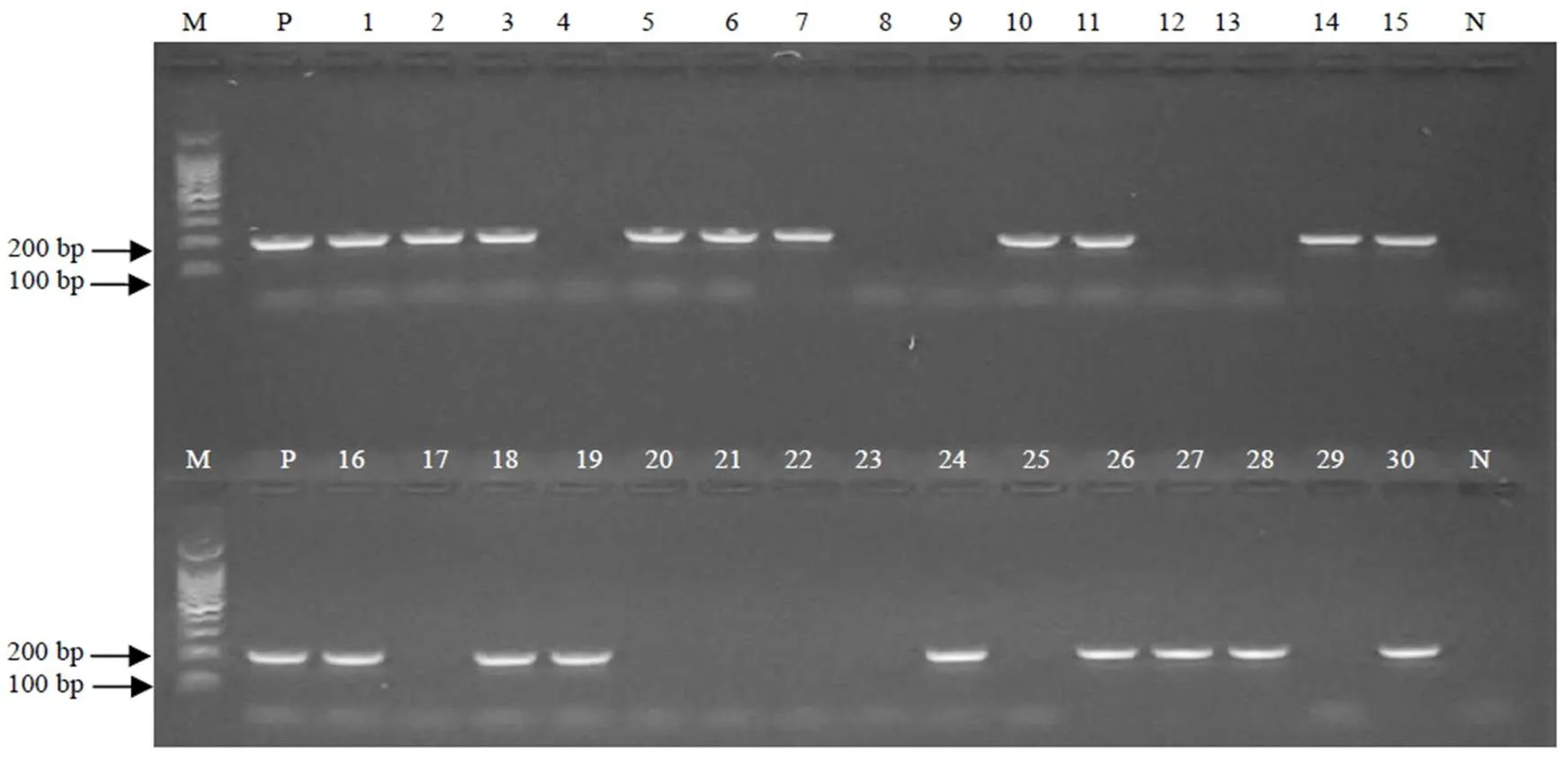
M-Marker P-鹿心阳性对照液 1~30-同表1样品编号 N-空白对照
4 讨论
中药材基原真伪鉴别是中药学研究领域中的重要研究方向和首要问题,中药材是否“正本清源”直接影响到用药安全。对中药材基原鉴别可以从源头上控制中药的质量,对保障中药生产和中药产业的健康发展起到举足轻重的作用[20]。
线粒体DNA作为细胞核外遗传信息载体,具有结构简单、不含间隔区、不含内含子、无重复序列、母系遗传、进化速度快等特点,是研究物种群体分子分类、遗传结构、分子系统发育的理想分子标记[21-22]。Cytb是线粒体DNA唯一参与线粒体呼吸链电子传递的细胞色素,Cytb进化速度适中,含有丰富的SNP位点,结构相对保守,适用于动物种属间差异和进化关系的研究分析[23-26]。作为有效的分子遗传学标记是目前研究的热点,极大地弥补了传统鉴定的不足。
本研究考虑干燥鹿心样品是经高温烘烤而成,会导致DNA降解严重,同时根据各样品基因SNP位点的差异,设计小片段194 bp的特异性引物进行PCR扩增,在退火温度为63 ℃时引物特异性最强,引物只与鹿心的基因的指纹区段特异性结合,扩增出大量的产物,在194 bp处出现一条特异性条带;但是,在此温度时,引物不会与其他伪品的指纹区段结合,因此伪品与空白对照均无条带。利用鹿心基因特异性引物,只要优化好引物的退火温度,就可以准确地鉴定出鹿心的真伪。而如果是通用引物进行扩增,正品与伪品均会出现一样的条带,无法区分,就必须进行聚合酶链式反应-限制性片段长度多态性(Polymerase chain reaction-restriction fragment length polymorphism,RCP-RFLP)。如果就是用来区分鹿心与不同种属的伪品,本研究建立的鉴定方法简单易行,结果准确可靠,完全可以区分。但是如果区分同种属的样本如梅花鹿鹿心与马鹿鹿心,那么RCP-RFLP还是很有优势的,如王凤霞等[16]对鹿血的PCR-RFLP鉴定研究。因为本研究样品鹿心指的就是梅花鹿与马鹿的心脏,所以不用细分,因此本研究建立的鹿心DNA指纹鉴定方法只要与不同种属的伪品区分开来即可。
运用DNA序列分析对比法对未知样品是否属于某一特定物种是最可靠的,最令信服的鉴定方法[27-28]。为了验证引物的特异性以及扩增的特异性基因片段序列的正确性,对鹿心对照药材特异性PCR扩增片段进行克隆和基因序列测定,比对结果与梅花鹿特异的指纹区段DNA序列完全一致,同源性为100%;与马鹿特异的指纹区段DNA序列同源性高达96%,有8个碱基存在差异,表明在种的水平上该指纹区段进化是保守的;而与其他伪品序列比对均显示没有明显的相似性。表明本研究建立的鹿心DNA指纹鉴定方法具有特异性、可行性和可靠性,并且验证了如果是同种属样本的鉴定RCP-RFLP的优势。因此将梅花鹿鹿心克隆液作为鹿心对照液装进试剂盒中。
本研究根据建立了鹿心DNA指纹鉴定方法,进而研制出鹿心DNA指纹检测试剂盒,从特异性、重现性、稳定性及灵敏度4个方面进行评价,性能良好。并且对市售30个鹿心样品进行检测,结果18个正品,12个伪品,伪品率为40%,实用性强。本试剂盒,包括DNA提取试剂、PCR检测试剂和阳性对照药材DNA克隆液,只需按照操作流程约4 h就可以快速、准确地完成鹿心真伪的鉴定,实现了鹿心分子鉴定的标准化和规范化,达到可以推广的条件。
利益冲突 所有作者均声明不存在利益冲突
[1] Glenn T C, Ojerio R S, Braun M J. Microsatellite DNA loci for genetic studies of cranes [J]., 1997, 7: 36-45.
[2] Ellegren H, Chowdhary B P, Johansson M,. Primary linkage map of the genome revealsa low rate of genetic recombination [J]., 1994, 137: 1089-1100.
[3] 徐吉臣, 朱立煌. 遗传图谱中的分子标记 [J]. 生物工程进展, 1992, 12(5): 1-3.
[4] 张军, 邓伟, 张进, 等. 心脑康胶囊联合曲美他嗪治疗冠心病心绞痛的临床研究 [J]. 现代药物与临床, 2017, 32(1): 25-29.
[5] 中国药典[S]. 一部. 2020:38-39.
[6] 中国药典[S]. 一部. 2020:80-81.
[7] 中国药典[S]. 一部. 2020:229.
[8] 中国药典[S]. 一部. 2020:388-389.
[9] 夏至, 李贺敏, 张红瑞, 等. 紫苏及其变种的分子鉴定和亲缘关系研究 [J]. 中草药, 2013, 44(8): 1027-1032.
[10] 魏晓雨, 田义新, 赵智灵, 等. 不同产地西洋参种质遗传多样性的RAPD和ISSR分析 [J]. 中草药, 2014, 45(21): 3153-3158.
[11] 孙稚颖, 姚辉. 不同产地菘蓝ISSR分析与鉴定 [J]. 中草药, 2014, 45(22): 3323-3326.
[12] 李敏, 黄龙妹, 赵欣, 等. 浙贝母特异性PCR鉴定方法研究 [J]. 中草药, 2014, 45(12): 1754-1757.
[13] 朱田田, 晋玲, 张裴斯, 等. 基于ISSR的甘肃不同产区栽培当归遗传多样性研究 [J]. 中草药, 2015, 46(23): 3549-3557.
[14] 李华, 史美荣, 肖娅萍. 绞股蓝种质资源遗传多样性及亲缘关系的ISSR分析 [J]. 中草药, 2015, 46(11): 1666-1672.
[15] 王梦亮, 任晓琳, 崔晋龙, 等. 野生红景天的RAPD和ISSR遗传多样性分析 [J]. 中草药, 2016, 47(3): 469-473.
[16] 王凤霞, 陈媛媛, 任贵奇, 等. 鹿血的PCR-RFLP鉴定研究 [J]. 中草药, 2018, 49(8): 1914-1918.
[17] 白根本, 张林源, 刘春生, 等. 鹿源类中药材DNA序列分析及马鹿和梅花鹿的PCR鉴定 [J]. 中草药, 2006, 37(10): 1566-1569.
[18] 刘向华, 王义权, 周开亚, 等. 鹿类中药材的位点特异性PCR鉴定研究 [J]. 药学学报, 2001, 36(8): 631-635.
[19] 黄璐琦, 袁媛, 蒋超, 等. 一种基于PCR-RFLP鉴定中药材鹿茸的方法, 中国: CN105176988A [P]. 2015- 12-23.
[20] 李西林, 陈科力, 李薇, 等. 试析中药鉴定中的基原鉴定问题 [J]. 中药材, 2009, 32(12): 1929-1932.
[21] Augot D, Ninio C, Akhoundi M,. Characterization of two cryptic species,and(Diptera: Ceratopogonidae), based on barcode regions and morphology [J]., 2013, 38(2): 260-265.
[22] 王健胜, 高雅琴. 基于Cytb基因的动物检材种属鉴定在非传统领域的部分运用 [J]. 生物技术通报, 2010(1): 37-43.
[23] Wang Y S, Yuan G X, Zhang L H,. Establishment of mink heart identification method based on mitochondrial cytochrome b gene and development of its detection kit [J]., 2019, 30(2): 325-331.
[24] 高丽君, 何程远, 李盈诺, 等. 基于双重PCR技术的鹿茸及其伪品DNA指纹特征和鉴定 [J]. 吉林大学学报:医学版, 2018, 44(4): 839-844.
[25] Smerkova K, Vaculovic T, Vaculovicova M,. DNA interaction with platinum-based cytostatics revealed by DNA sequencing [J]., 2017, 539: 22-28.
[26] 曲晓娟,李昭燕,宋倩,等. 基于线粒体DNA序列分析研究泰山赤鳞鱼的分类和进化[J]. 山东理工大学学报: 自然科学版, 2017, 31(5): 18-23.
[27] Marco C. The mitochondrial genome, a growing interest inside an organelle [J]., 2008, 16: 51-57.
[28] Petrovskaya A V. Genetic structure of the sableL. populations from Magadan oblast as inferred from mitochondrial DNA variation [J]., 2007, 43(4): 424-429.
Study on molecular identification method and detection reagent of Chinese medicinal materials deer heart
WANG Yan-shuang1,3, JIANG Hai-ying2, LIU Mei-lin1, GAO Li-jun2, LI Ming-cheng2,3, SUN Li-yuan2, ZHANG Li-hua4, AI Jin-xia2,3
1. Medical College, Beihua University, Jilin 132013,China 2. School ofMedical Technology, Beihua University, Jilin 132013,China 3. Chinese Medicine DNA Fingerprint Detection Technology Innovation Center, Beihua University, Jilin 132013, China 4. Jilin Leining Food and Drug Testing Technology Service Co., Ltd., Jilin 132013, China
To establish a DNA fingerprint identification method for Chinese medicinal materials deer heart and develop DNA detection kit for deer heart.Using the mtDNAgene ofandas the target gene, small fragment specific primers were designed and used to develop the deer heart DNA extraction reagent and PCR detection reagent. Using molecular cloning and the sequencing technology,standard materials to deer heart was cloned. And then the specificity, reproducibility, stability and sensitivity of the reagent was investigated. Finally the authenticity of the commercial deer heart samples was verified.The concentration and purity of DNA extracted by the self-developed reagent reached the requirement of PCR. The specificity of the primer was the strongest when the annealing temperature was 63 ℃. The DNA sequence of deer heart after cloning was consistent with the specific fingerprint section of sika deer heart mtDNAgene. Self-developed reagent had good reproducibility, stability and sensitivity up to 0.5%. Thirty baked deer heart samples for sale were tested and the rate of counterfeitwas 40%.The DNA fingerprint identification method of deer heart established in this study is specific, accurate and reliable. The DNA detection kit for deer heart which developed in this study is simple to use and the result is stable.
deer heart; DNA fingerprint identification method; DNA detection kit; molecular cloning; sequencing technology
R282.2
A
0253 - 2670(2021)02 - 0544 - 08
10.7501/j.issn.0253-2670.2021.02.028
2020-06-09
吉林省发改委项目(2018C048-2);吉林省科技发展计划项目(20180201023YY,20190303093SF,20190301014NY,20200404152YY,20200403047SF);吉林省科技创新中心建设项目(20190902018TC)
王艳双,女,博士,副教授,研究方向为食品及药品DNA指纹技术研究与应用。E-mal: wangys5521@163.com
艾金霞,女,硕士,教授,研究方向为食品及药品DNA指纹技术研究与应用。E-mal: 1047085280@qq.com
[责任编辑 时圣明]
