荆芥1-脱氧-D-木酮糖-5-磷酸合成酶基因克隆及生物信息学分析
2021-01-19林谷音周佩娜尹梦娇刘莉成戴仕林刘潺潺吴啟南
林谷音,周佩娜,尹梦娇,刘莉成,戴仕林,刘潺潺*,吴啟南, 3*
• 药材与资源 •
荆芥1-脱氧--木酮糖-5-磷酸合成酶基因克隆及生物信息学分析
林谷音1, 2,周佩娜1,尹梦娇1, 2,刘莉成1, 2,戴仕林1, 2,刘潺潺1, 2*,吴啟南1, 2, 3*
1. 南京中医药大学药学院,江苏 南京 210023 2. 江苏省中药资源产业化过程协同创新中心,江苏 南京 210023 3. 中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏 南京 210023
克隆荆芥1-脱氧--木酮糖-5-磷酸合成酶(1-deoxy--xylulose 5-phosphate synthase,)基因,并进行生物信息学分析。根据荆芥转录组数据获得的基因序列设计特异性引物,通过RT-PCR技术获得基因cDNA的全长序列,并进行生物信息学分析。荆芥基因全长2177 bp,包含一个长度为2157 bp的开放阅读框,编码718个氨基酸,其理论相对分子质量为77 240,等电点为6.32,定位于叶绿体,不存在跨膜区及信号肽,为非分泌蛋白。同源系统进化树分析表明,该序列与同科植物鼠尾草的基因进化关系较近,均属于1亚家族。密码子偏性分析表明,该基因偏好使用以A/T结尾的密码子,具有28个偏性密码子,烟草为该基因最适合的外源表达宿主。成功克隆荆芥基因并进行生物信息学分析,为从分子水平调控荆芥的生长发育和改善药材产量和品质提供理论基础。
荆芥;1-脱氧--木酮糖-5-磷酸合成酶;基因克隆;生物信息学分析;RT-PCR
中药荆芥为唇形科一年生草本植物荆芥Briq. 的干燥地上部分,具有解表散风、透疹、消疮的功效。其茎、叶、花穗多个部位富含挥发油,经提取可得到荆芥精油,被广泛用于医药、化工、食品和香料等领域。荆芥精油主要含有单萜类成分,也含有少量倍半萜和醛、酮、醌类等化合物,其中薄荷酮(menthone)、胡薄荷酮(pulegone)相对含量较高,占总挥发油含量的70%以上[1],具有镇痛、抗炎以及体内抗病毒活性[2,3]。
单萜类成分在植物体内主要通过2-甲基--赤藓醇-4-磷酸途径(MEP Pathway)合成,该途径以丙酮酸(pyruvate)和3-磷酸-甘油醛(glyceraldehyde-3-phosphate)为原料,经过多步酶促反应生成异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)和其异构体二甲丙烯焦磷酸(dimethylally pyrophosphate,DMAPP),再进一步生成牻牛儿基焦磷酸(geranyl pyrophosphate,GPP),人们熟知的樟脑、柠檬烯、薄荷酮均是GPP的下游产物——单萜类成分[4-5]。1-脱氧--木酮糖-5-磷酸合酶(1-deoxy--Xylulose- 5-phosphate synthase,DXS)是MEP途径的限速酶之一,是催化丙酮酸和3-磷酸-甘油醛合成1-脱氧--木酮糖-5-磷酸(1-deoxy--xylulose 5-phosphate,DXP)的关键酶[6-7]。目前,基因已在厚朴[8]、黄花蒿[9]、滇龙胆[10]、冬凌草[11]等多种药用植物中被分离并鉴定,发现该基因在调节植物生长发育、次生代谢产物的合成与积累以及自身保护和防御等方面具有重要作用。
迄今为止,有关荆芥的研究多聚焦于植物形态学、化学成分以及药理作用方面,从分子水平层面仅报道了荆芥单萜类成分生物合成相关的-柠檬烯合酶(-limonene synthase)基因的分子克隆和酶促实验,并推测了该酶的立体化学结构[12],有关荆芥单萜类成分生物合成分子机制的报道依然鲜有报道。因此,本研究基于课题组前期荆芥转录组测序数据,筛选得到注释为的序列,对其进行特异性引物设计和cDNA全长克隆及生物信息学分析。以期为下一步研究其功能,探索荆芥单萜类成分生物合成机制奠定基础,也为提升中药荆芥的药用品质提供理论指导。
1. 材料与试剂
1.1 材料
本实验植物材料荆芥由购买于河北的荆芥种子繁殖而得,经课题组前期培养30 d得到荆芥新鲜植株,经南京中医药大学吴啟南教授鉴定为唇形科荆芥属植物荆芥Briq.,其新鲜叶片清水洗净后用滤纸吸干水分,作为提取荆芥RNA的材料。
1.2 试剂
多糖多酚植物总RNA提取试剂盒、DH5α大肠杆菌感受态细胞购于北京天根生化科技有限公司;DNA凝胶回收试剂盒购于北京擎科新业生物技术有限公司;PrimeScriptTMII 1st Strand cDNA Synthesis Kit、2×Taq Master Mix、pMD18-T Vector Cloning Kit购于大连宝生物科技有限公司;2×Easy Taq Mix购于北京全式金生物技术有限公司;引物合成和测序技术服务由生工生物工程(上海)股份有限公司提供。
2 方法
2.1 荆芥叶片总RNA的提取及cDNA的合成
将荆芥叶片样品置于液氮中研磨成细粉,按照多糖多酚植物总RNA提取试剂盒说明书提取总RNA,按照PrimeScriptTMII 1st Strand cDNA Synthesis Kit反转录体系进行cDNA的合成。
2.2 荆芥StDXS基因全长的克隆
根据课题组前期荆芥转录组数据获得基因序列,使用Primer Premier 5.0软件设计特异性引物,上游引物DXS-F的序列为5’-CACACAC- ACACAAGATGGCT-3’,下游引物DXS-R的序列为5’-CCATCTAGGACATCATCTC-3’。扩增体系总体积25 μL,包括2×Taq Master Mix 12.5 μL,叶cDNA模板2.5 μL,上游和下游引物各1.0 μL,ddH2O 9.0 μL。PCR反应条件为94 ℃预变性1.5 min;94 ℃变性30 s;50 ℃退火45 s;72 ℃延伸5 min,共35个循环;最后72 ℃保持10 min;4 ℃永久。扩增产物经1%琼脂糖凝胶电泳检测后,使用DNA凝胶回收试剂盒将目的条带切胶回收。用TA-cloning Kit及pMD18-T载体与目的基因连接,将阳性克隆送上海生工有限公司进行测序。
2.3 StDXS基因序列的生物信息学分析
将测序后得到的基因序列通过美国国立生物技术信息中心(NCBI)中的Blast 对比。利用拟南芥在线数据库TAIR-BLAST寻找拟南芥中的同源蛋白;使用NCBI中的Concserved Domain预测蛋白保守域及超家族;使用蛋白结构和功能预测软件对编码的蛋白的理化性质(ProtParam)、结构域(Inter Pro Scan)、信号肽(SignalP 4.1 Server)、亚细胞定位(WoLF-PSORT II)、跨膜结构(Tmhmm Server v.2.0)、糖基化、磷酸化位点(NetNGlyc 1.0 Server、NetPhos 3.1 Server)、蛋白亲疏水性(ProtScale)、蛋白结构(Sopma,Swiss-Model)等进行综合生物信息学分析。使用DNAMAN软件进行氨基酸序列比对,使用MEME在线软件进行氨基酸保守基序分析,利用MEGA-X 10.0的邻接法构建系统发育树(Neighbor-Joining,NJ),最后使用CondoW和EMBOSS软件对该基因的密码子偏好性进行分析。所用生物信息学在线程序见表1。
3 结果与分析
3.1 荆芥StDXS基因cDNA克隆及序列分析
本实验提取得到的荆芥总RNA的28S和18S条带清晰,无弥散拖尾等现象,说明总RNA质量较好。以总RNA逆转录得到的cDNA为模板,利用特异性引物DXS-F、DXS-R进行全长扩增。扩增产物经琼脂糖凝胶电泳检测,发现在2000 bp左右出现特异片段,与该基因片段预期大小基本一致(图1)。
将PCR产物进行TA克隆测序,发现荆芥基因序列全长为2177 bp,命名为。该序列经BLAST搜索比对后发现与唇形科植物丹参Bunge. 的基因序列相似性最高为99%,说明该序列扩增正确。利用NCBI的ORF Finder查询功能对该序列进行分析,发现基因包含一个长为2157 bp的开放阅读框(open reading frame,ORF),编码718个氨基酸残基(图2)。
3.2 荆芥StDXS基因序列编码蛋白的生物信息学分析
利用NCBI中的Concserved Domain搜索后发现基因编码的蛋白质具有PLNO2582活性位点(45~718),属于PLN02582超家族。利用Inter Pro Scan搜索发现StDXS蛋白质属于脱氧木酮糖磷酸合酶(deoxyxylulose-5-phosphate synthase,IPR005477)家族,该家族主要参与萜类化合物的生物合成。StDXS含有3个结构域,分别为转酮醇酶N端结构域(transketolase,-terminal,110~119),类转酮酶嘧啶结合结构域(transket-pyr,397~562)和转酮醇酶结构域(transketolase_C,576~699)。此外StDXS还具有DXS家族基因特征保守序列“DRAG”,进一步证明基因扩增的正确性。利用在线软件Protparam对基因编码的氨基酸序列进行分析,发现其编码718个氨基酸残基,分子式为C3424H5408N952O1023S30,相对分子质量为77 240,等电点为6.32,其半衰期较长,为30 h,不稳定系数为40.00,属于稳定蛋白,脂肪族氨基酸指数为87.14,亲水性总平均值为−0.089,属于亲水性蛋白。在基因编码的氨基酸分布中,丙氨酸(Ala)含量最高为10.6%,其次是亮氨酸(Leu)为10.0%,半胱氨酸(Cys)和色氨酸(Trp)最少为1.8%和0.4%,其中负电荷残基(Asp+Glu)有77个,正电荷残基(Arg+Lys)有69个。

*为终止密码子;阴影部分为转酮酶结构域;下划线部分为基因特征保守序列“DRAG”
*represents the Stop Codon; transketolase domain was marked by the shadow;the DXS signature sequence (DRAG) is underscored
图2 荆芥蛋白质编码区(CDS) 及其氨基酸序列
Fig. 2 Coding sequence region (CDS) ofand its amino acid sequence
利用WoLF-PSORT II在线软件进行StDXS蛋白的亚细胞定位预测,结果表明该蛋白定位于叶绿体、细胞核、胞质的值分别为8、3、3,说明StDXS最可能定位于叶绿体;利用TMHMM Server v.2.0在线软件预测StDXS蛋白的跨膜结构域,发现该蛋白无跨膜结构域,说明其不属于跨膜蛋白(图3-A);利用NetNGlyc 1.0 Server在线软件预测StDXS蛋白的糖基化位点,发现该蛋白有2个糖基化位点(11,106)(图3-B);利用NetPhos 3.1 Server预测StDXS蛋白的磷酸化位点和蛋白激酶结合位点(图3-C),发现该蛋白共有磷酸化位点60个,其中丝氨酸(S)28个,苏氨酸(T)23个,酪氨酸(Y)9个,并存在蛋白激酶C(PKC)、蛋白激酶A(PKA)、络蛋白激酶II(CKII)、细胞周期蛋白依赖性激酶抑制因子(CKI)、细胞分裂周期激酶2(CDC2)、P38信号调节蛋白激酶(p38MAPK)、unsp等多种特异性蛋白激酶结合位点。利用SignalP 4.1 Server在线软件预测StDXS蛋白的信号肽,发现该蛋白不含信号肽,可能为非分泌蛋白(图3-D);利用ExPasy-ProtScale分析StDXS蛋白亲/疏水性(图3-E),发现疏水性最强出现在第602个氨基酸(A)处最高值为2.300;亲水性最强出现在第176个氨基酸(E)处最低值为−2.500。从整条肽链的氨基酸预测值来看,其中大部分为负值,由此可以推断,荆芥DXS蛋白是一种亲水性蛋白,与蛋白质的理化性质预测一致。
3.3 荆芥StDXS基因序列编码蛋白的二级、三级结构预测
利用SOPMA对StDXS蛋白的二级结构进行分析,结果表明该蛋白二级结构主要以α-螺旋(H)和无规卷曲(C)为主,分别为40.25%和37.47%,还存在14.48%的延伸链(E)和7.80%的β-转角(T)。使用Swiss-Model在线软件预测StDXS蛋白的三级结构,并使用Pymol对其进行可视化处理及优化(图4)。
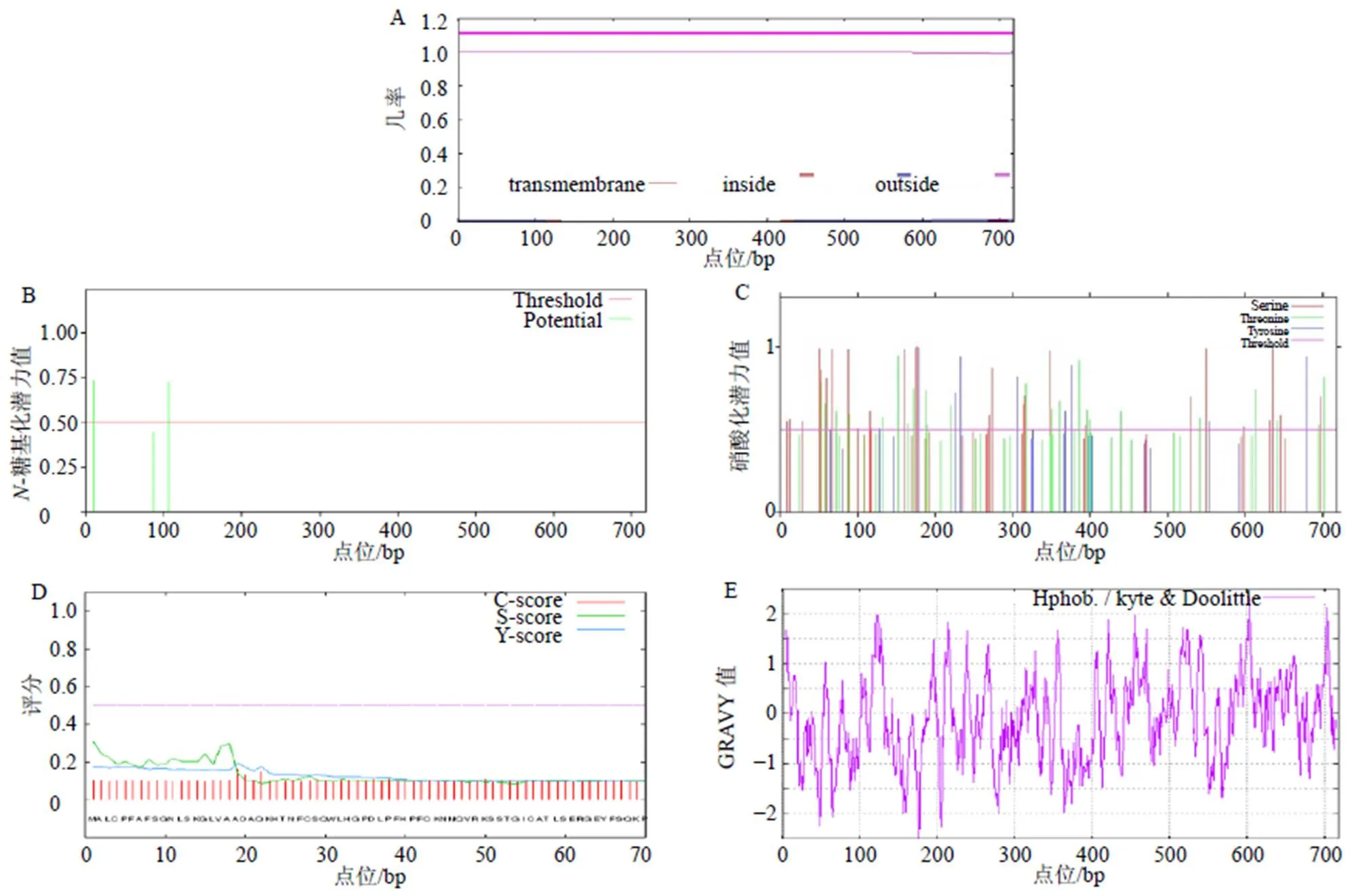
图3 荆芥StDXS蛋白跨膜结构域(A)、蛋白糖基化位点(B)、蛋白磷酸化位点(C)、蛋白信号肽(D)、蛋白亲水性/疏水性(E)预测
3.4 荆芥StDXS蛋白同源性及保守基序分析系统进化分析
利用NCBI中的BLASTp对基因编码的氨基酸与其他植物DXS蛋白的氨基酸序列进行同源比对,发现其与丹参(SmDXS,ACF21004.1)、冬凌草(Hemsl.) Hara(IrDXS,AMM72794.1)、胡椒薄荷L.(MpDXS,AAC33513.1)、蓖麻L.(RcDXS,XP_002533688.1)、番茄L.(SlDXS3,XP_004245186.1)具有较高相似性,分别为96.10%、72.02%、68.84%、59.17%、56.34%,多序列分析表明荆芥、丹参、冬凌草和胡椒薄荷DXS氨基酸序列均含有DXS家族的高度保守的特殊结构域“DRAG”,蓖麻与番茄DXS氨基酸序列含有特殊结构域“TSAG”(图5)。利用MEME在线网站分析以上6种植物DXS氨基酸序列的保守基序(motif),在值<10,值<0.000 1条件下,识别出16个共有的motif,长度为50、43、41、29、21、15个氨基酸各有10、1、1、1、1、2个,这些motif可能是蛋白的功能位点(图6)。
3.5 荆芥StDXS基因系统进化分析
利用MEGA-X 10.0软件的Neighbor-joining模式建立28种植物的StDXS氨基酸序列系统进化树,结果表明荆芥与同科植物鼠尾草L.亲缘关系较高,聚于一支(图7)。系统进化聚类显示植物基因分为3个亚家族1、2、3,与文献报道一致[9,13]。
3.6 荆芥StDXS基因密码子偏好性分析
利用CodonW和EMBOSS软件分析荆芥基因的密码子适应指数(codon adaptation index,CAI)、有效密码子数(effective number of codons,ENC)、不同位置的GC含量(GC1s、GC2s、GC3s)、总GC含量、同义密码子相对使用度(relative synonymous codon usage,RSCU)。结果表明CAI为0.3176、ENC为55.083,说明密码子偏性较弱;总GC值为0.474 7<0.5,GC1s、GC2s和GC3s分别为0.568 8、0.445 1和0.4103,说明该基因编码区的A/T含量高于G/C含量;当RSCU=1时,密码子没有偏好性;当RSCU>1时,密码子具有偏好性,表2中RSCU>1的密码子共有28个,其中19个以A/T结尾,9个以G/C结尾,说明荆芥基因偏好于使用A或T结尾的密码子。
利用在线软件EMBOSS-CHIP分析荆芥基因密码子的使用频率,在数据库CodonUsage Database 查找拟南芥(L.) Heynh.、烟草L.、酵母、大肠杆菌基因组的密码子偏好性,荆芥的基因与拟南芥、烟草、酵母、大肠杆菌各密码子使用频率的比值分别用St/At、St/Ns、St/Sc、St/Ec表示(表3)。若2物种间的密码子使用偏好性差异较小,该比值常在0.5~2.0,不在此范围内则差异较大,差异较大的密码子个数越少则说明2种物种密码子偏好性相似,有利于基因的异源表达。荆芥基因与大肠杆菌、酵母、烟草、拟南芥偏好性差异较大的密码子个数依次为16、15、7、9,说明烟草最适合该基因的异源表达。

不同的基序用不同颜色的方框表示

图7 StDXS氨基酸序列系统进化分析
4 讨论
芳香类药用植物如荆芥、薄荷、紫苏等因含挥发性成分而具有特殊的气味,药材记载常具有解表、化湿、行气、开窍等功能,现代药理学表明此类挥发性成分具有抑菌、抗病毒、抗炎、抗肿瘤、抗氧化等药理活性,在治疗发烧、炎症、病毒性感冒等疾病上具有显著疗效[14-18]。而萜类化合物是挥发性成分发挥药理活性的主要物质基础。荆芥挥发性成分中萜类物质占70%,但目前荆芥精油的获得主要依赖于新鲜植物的水蒸气蒸馏提取,提取效率较低,且耗时较长,造成荆芥资源的浪费。有研究表明荆芥体内的胡薄荷酮和薄荷酮含量随荆芥的生长发育呈现规律性的变化[19],这与荆芥萜类成分生物合成途径中关键酶的表达调控有着必然的联系。因此利用分子生物学和基因编辑手段提高荆芥体内萜类物质的含量可以极大地减少荆芥资源的消耗,使其充分利用,从而为荆芥药材资源的可持续发展提供保障。
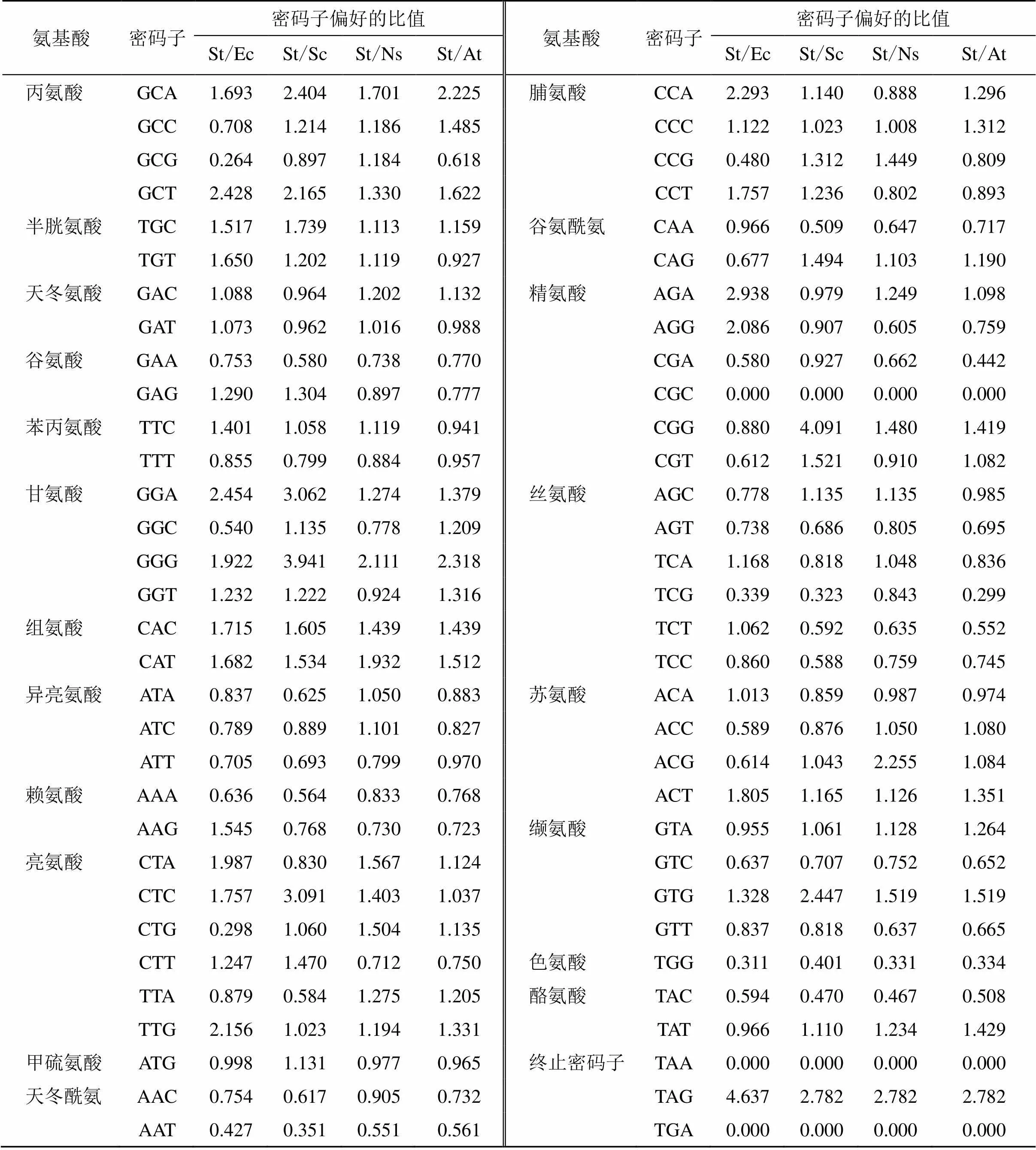
表3 荆芥StDXS基因与大肠杆菌、酵母、烟草、拟南芥基因组密码子使用频率比较
本研究从荆芥中成功克隆了荆芥萜类化合物生物合成途径上的基因,该基因cDNA全长2177 bp,包含一个长度为2157 bp的开放阅读框。生信学分析表明基因编码718个氨基酸残基,理论预测蛋白质相对分子质量为77 240,等电点为6.32,属于PLN02582超家族,含有3个转酮醇酶结构域和DXS家族特征性保守序列“DRAG”。预测该基因的亚细胞定位于叶绿体,编码一种非跨膜、无转运肽的亲水性蛋白。
在荆芥与其他5种植物的氨基酸序列保守基序分析中发现,其保守基序的种类和位置非常相似,同一亚组之间保守基序几乎相同,不同亚组之间保守基序存在一定差异。系统进化树分析发现荆芥基因属于亚家族,同科的冬凌草和胡椒薄荷基因属于亚家族,而蓖麻和番茄属于亚家族,亚家族与其他2个亚家族进化关系较远,它们的氨基酸序列存在一定差异,从而造成了功能上的差异。有研究表明基因的3个亚家族中,亚家族具有看家基因的功能,其所编码的酶催化前体物质形成叶绿素、类胡萝卜素等与初生代谢有关的化合物,如拟南芥中的和黄花蒿中的[20];亚家族主要为一些特殊次生代谢物的合成提供异戊二烯骨架,起到防御草食系动物、吸引昆虫授粉和抵御微生物等作用,如可防御草食性动物取食的番茄[21]和参与抗病反应的烟草[22];亚家族通常存在于植物基因组中,目前研究较少,可能主要参与了植物激素如ABA(Abscisic acid和GA3(Gibberellic acid)的合成[6,23]。因此,推测属于家族的基因较为保守,很可能作为看家基因在初生代谢产物的合成与积累过程中发挥重要作用,其在荆芥植物体内部的具体功能有待于进一步探究。另外,在观察玉米、水稻、拟南芥等植物的亚家族聚类结果时,发现同种植物可能同时具有不同亚家族的基因。由此推测在荆芥中,除了在本研究中发现的属于亚家族的基因外,极可能还具有与萜类等次生代谢产物生物合成相关的亚家族的基因序列。
通过使用大肠杆菌、酵母、烟草、拟南芥等模式生物来研究基因表达的技术已日趋成熟。密码子偏好性的研究有助于人们更好地利用异源表达系统,克服异源表达的困难,选择最合适的表达宿主。本研究发现荆芥基因偏好使用A或T结尾的密码子,且编码区A/T含量高于G/C含量。分析大肠杆菌、酵母、烟草、拟南芥与荆芥基因的密码子使用偏好性,发现荆芥与烟草具偏好性差异较大的密码子个数最少,说明该基因更适合在烟草中表达。
本研究为今后StDXS蛋白功能的鉴定及定向优化荆芥药材品质提供了理论基础,同时StDXS作为MEP途径中的第1个限速酶,也为进一步探究荆芥萜类化合物生物合成的分子机制奠定基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 王凤, 温桃群, 桑文涛, 等. 荆芥挥发油化学成分及药理作用研究现状 [J]. 中南药学, 2017, 15(3): 312-318.
[2] 刘玥欣. 荆芥不同煎煮时间对荆芥汤中胡薄荷酮含量及药效作用的影响 [D]. 长春: 长春中医药大学, 2018.
[3] 何婷, 汤奇, 曾南, 等. 荆芥挥发油及其主要成分抗流感病毒作用与机制研究 [J]. 中国中药杂志, 2013, 38(11): 1772-1777.
[4] Chen C, Zheng Y, Zhong Y,. Transcriptome analysis and identification of genes related to terpenoid biosynthesis in[J]., 2018, 19(1): 550.
[5] Turner G W, Croteau R. Organization of monoterpene biosynthesis in mentha. immunocytochemical localizations of geranyl diphosphate synthase, limonene- 6-hydroxylase, isopiperitenol dehydrogenase, and pulegone reductase [J]., 2004, 136(4): 4215-4227.
[6] Rodríguez-Concepción M, Boronat A. Breaking new ground in the regulation of the early steps of plant isoprenoid biosynthesis [J]., 2015, 25: 17-22.
[7] Wright L P, Rohwer J M, Ghirardo A,. Deoxyxylulose 5-phosphate synthase controls flux through the methylerythritol 4-phosphate pathway in[J]., 2014, 165(4): 1488-1504.
[8] 查良平, 杨健, 刘爽, 等. 厚朴1-脱氧--木酮糖-5-磷酸合成酶基因的鉴定及挥发油成分分析 [J]. 中草药, 2015, 46(24): 3734-3739.
[9] Zhang F Y, Liu W H, Xia J,. Molecular characterization of the 1-deoxy--xylulose 5-phosphate synthase gene family in[J]., 2018, 9: 952.
[10] 张海晨, 李彩霞, 王元忠, 等. 滇龙胆1-脱氧--木酮糖5-磷酸合酶基因的克隆与表达分析 [J]. 生物技术通报, 2016(4): 128-136.
[11] 朱畇昊, 苏秀红, 董诚明, 等. 冬凌草1-脱氧--木酮糖-5-磷酸合成酶基因克隆与表达分析 [J]. 广西植物, 2016, 36(12): 1476-1482.
[12] Maruyama T, Ito M, Kiuchi F,. Molecular cloning, functional expression and characterization of d-limonene synthase from[J]., 2001, 24(4): 373-377.
[13] 张浩宇, 樊俊苗, 王婷, 等. 植物萜类合成关键基因DXS研究进展 [J]. 生物技术通报, 2018(3): 1-8.
[14] 张建红, 刘琬菁, 罗红梅. 药用植物萜类化合物活性研究进展 [J]. 世界科学技术—中医药现代化, 2018, 20(3): 419-430.
[15] Shan M Q, Qian Y, Yu S,. Anti-inflammatory effect of volatile oil fromon carrageenin-induced pleurisy in rats and its application to study of appropriate harvesting time coupled with multi-attribute comprehensive index method [J]., 2016, 194: 580-586.
[16] Chen S G, Cheng M L, Chen K H,. Antiviral activities ofBriq. against Enterovirus 71and[J]., 2017, 7: 935.
[17] Fung D, Lau C B S.: Chemistry, pharmacology, and clinical applications [J]., 2002, 42(1): 30-36.
[18] 黄晓巍, 刘玥欣, 刘轶蔷, 等. 荆芥化学成分及药理作用研究进展 [J]. 吉林中医药, 2017, 37(8): 817-819.
[19] Liu C C, Srividya N, Parrish A N,. Morphology of glandular trichomes of Japanese catnip (Briquet) and developmental dynamics of their secretory activity [J]., 2018, 150: 23-30.
[20] 刘万宏. 青蒿DXS基因家族功能分化及低温促进青蒿素合成的分子机制研究 [D]. 重庆: 重庆大学, 2016.
[21] Paetzold H, Garms S, Bartram S,. The isogene 1-deoxy--xylulose 5-phosphate synthase 2 controls isoprenoid profiles, precursor pathway allocation, and density of tomato trichomes [J]., 2010, 3(5): 904-916.
[22] 罗朝鹏, 李泽锋, 张剑锋, 等. 烟草NtDXS2基因的克隆及表达分析 [J]. 烟草科技, 2018, 51(11): 1-7.
[23] Cordoba E, Porta H, Arroyo A,. Functional characterization of the three genes encoding 1-deoxy--xylulose 5-phosphate synthase in maize [J]., 2011, 62(6): 2023-2038.
Cloning and bioinformatics analysis of 1-deoxy--xylulose 5-phosphate synthasegene from
LIN Gu-yin1, 2, ZHOU Pei-na1, YIN Meng-jiao1, 2, LIU Li-cheng1, 2, DAI Shi-lin1, 2, LIU Chan-chan1, 2, WU Qi-nan1, 2, 3
1. College of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing 210023, China 3. National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Nanjing 210023, China
To clone 1-deoxy--xylulose 5-phosphate synthase () gene fromand perform the bioinformatics analysis.The full-length cDNA sequence ofgene was cloned by using RT-PCR based on transcriptome sequencing data ofgenerated in the previous study and further analyzed by bioinformatic methods.The clonedgene was 2 177 bp, containing a 2 157 bp open reading frame (ORF) which encoded 718 amino acids. The theoretical molecular weight was 77 240 and its isoelectric point was 6.32. StDXS protein might be located in the chloroplast, and it had no signal peptide and membrane spaning domain, it was non-secretory protein. Phylogenetic analysis indicated that sequence of amino acids was closely related to the evolution ofof the same family, and they both belonged tofamily. Codon bias analysis showed thatgene prefered to use A/T ending codon, with 28 skewed codons.was the most suitable host for exogenous expression ofgene.Thegene was cloned fromsuccessfully and its bioinformatics analysis was performed, which provided a theoretical basis for regulating the growth and development ofand improving the yield and quality of.
Briq.; 1-deoxy--xylulose 5-phosphate synthase; gene cloning; bioinformatics analysis; RT-PCR
R286.12
A
0253 - 2670(2021)02 - 0527 - 11
10.7501/j.issn.0253-2670.2021.02.026
2020-03-06
国家自然科学基金面上项目(81973435);国家自然科学基金面上项目(81473313);国家自然科学基金青年科学基金项目(81903756)
林谷音(1996—),女,硕士研究生,研究方向为中药学。E-mail: lgy_grace@sina.com
刘潺潺,女,讲师,主要从事中药资源生产与品质评价研究。E-mail: liuchanchan0317@outlook.com
吴啟南,男,教授,主要从事中药资源生产与品质评价研究。Tel: (025)85811521 E-mail: qnwyjs@163.com
[责任编辑 时圣明]
