基于高通量测序技术的黄芩提取物对热证模型大鼠肠道菌群多样性的影响
2021-01-19李自辉陈平平张亚男刘树民
李自辉,陈平平,王 宇,张亚男,吴 娟,刘树民*
基于高通量测序技术的黄芩提取物对热证模型大鼠肠道菌群多样性的影响
李自辉1, 2,陈平平1,王 宇1,张亚男1,吴 娟3,刘树民1*
1. 黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040 2. 大连大学医学院,辽宁 大连 116622 3. 黑龙江中医药大学 药物安全性评价中心,黑龙江 哈尔滨 150040
探究黄芩提取物对热证模型大鼠肠道菌群多样性的影响,并探讨中医“热者寒之”思想的科学内涵。雄性SD大鼠随机分为对照组、模型组、黄芩提取物(3 g/kg)组。除对照组外,其余各组大鼠于每日上午ig左甲状腺素钠混悬液(0.12 g/kg),造模1 h后,黄芩提取物组ig黄芩提取物(10 mL/kg),对照组与模型组ig等体积的饮用水,连续15 d。采用高通量测序技术对大鼠盲肠内容物的肠道菌群多样性进行测序;取大鼠血清测定神经-内分泌-免疫系统中关键性指标,并构建差异菌属与神经-内分泌-免疫系统的互作体系。黄芩提取物可显著回调热证模型大鼠神经-内分泌-免疫系统中关键性的12个指标,明显改善肠道内分类操作单元(operational taxonomic units,OTUs)数量和α、β多样性的失调,降低菌群生物丰度与多样性指数,对热证模型大鼠的6种差异菌门与25种差异菌属的相对丰度起到调节作用。柯林斯菌属、苍白杆菌属、普雷沃菌属与神经-内分泌-免疫系统具有强相关作用。黄芩提取物可改善热证模型大鼠神经-内分泌-免疫系统和肠道菌群多样性的异常,柯林斯菌属、苍白杆菌属、普雷沃菌属可能是热证模型大鼠肠道的潜在标志菌属。
黄芩;热证;肠道菌群;高通量测序;16S rRNA技术;神经-内分泌-免疫系统
热证是中医理论中的重要证型,病因多以阳气亢盛、热邪入血、阴气不足为主,表现为口干、发热、脉率加快等机体能量亢进的热象[1-2]。中医药治疗热证常以“热者寒之”为指导思想,研究发现神经-内分泌-免疫系统是调控其发生与发展的关键性靶标[3],药物通过不同途径,以对神经-内分泌-免疫系统的影响为主要特征,可反映出中药作用靶点与中医证候靶点的关联性,是中医药“辨证论治”的重要体现。肠道微生态与中医证候存在密切关系[4]。张北华等[5]通过研究发现肠道菌群紊乱会导致脾虚泄泻,加重脾虚证中湿困的病理表现;黄腾杰[6]发现肠道菌群结构失调与阳虚证密切相关,并找出罗斯氏菌属等为阳虚证的特征菌属。热证状态下,宿主肠道菌群多样性的功能和结构与正常机体之间是否存在差异尚未见报道。
黄芩Georgi性寒,味苦,归肺、胆、胃、大肠经,课题组前期研究将黄芩作为寒性模式中药,已证明其对热证模型大鼠物质与能量代谢及其相关生物酶具有显著的抑制作用[7],但其是否能对神经-内分泌-免疫系统产生影响尚不明确。本研究采用Illumina MiSeq平台的16S rRNA高通量测序技术,探讨黄芩提取物对热证模型大鼠肠道菌群多样性的变化和神经-内分泌-免疫系统的影响,对差异菌属与神经-内分泌-免疫系统相关指标进行Pearson相关性分析,旨在从肠道微生态层面揭示黄芩干预热证的作用机制,构建宿主-菌群-证候的相互作用关系,为完善中医证候评价体系奠定理论基础,并进一步诠释“热者寒之”的科学内涵。
1 材料
1.1 动物
SPF级雄性SD大鼠30只,6~8周龄,体质量(180±20)g,由黑龙江中医药大学实验动物中心提供,许可证号SCXK(黑)2015-004,饲养于黑龙江中医药大学GLP实验中心,室温20~25 ℃,相对湿度为40%~60%,实验动物给予标准饲料和自由饮水,并获得黑龙江中医药大学伦理委员会批准(批准号DXLL2015061601)。
1.2 药品与试剂
黄芩(批号20140623)购自河北承德药材有限公司,经黑龙江中医药大学中药资源教研室王振月教授鉴定为唇形科植物黄芩Georgi的干燥根;左甲状腺素钠片(批号H20160056,规格50 μg/片)购自德国默克-里昂制药公司;大鼠去甲肾上腺素(norepinephrine,NE)酶联免疫试剂盒、大鼠5-羟色胺(5-hydroxytryptamine,5-HT)酶联免疫试剂盒、大鼠多巴胺(dopamine,DA)酶联免疫试剂盒、大鼠促甲状腺激素(thyrotropin,TSH)酶联免疫试剂盒、大鼠促甲状腺激素释放激素(thyrotropin-releasing hormone,TRH)酶联免疫试剂盒、大鼠促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)酶联免疫试剂盒、大鼠促肾上腺皮质激素释放激素(corticotropin-releasing-hormone,CRH)酶联免疫试剂盒、大鼠17-羟皮质类固醇(17-hydroxycorticosteroids,17-OHCS)酶联免疫试剂盒、大鼠白细胞介素-2(interleukin-2,IL-2)酶联免疫试剂盒、大鼠白细胞介素-6(interleukin-6,IL-6)酶联免疫试剂盒、大鼠白细胞介素-10(interleukin-10,IL-10)酶联免疫试剂盒、大鼠γ干扰素(interferon-γ,IFN-γ)酶联免疫试剂盒,批号均为20160816,购自南京建成生物工程研究所;大鼠饲料购自北京科澳协力饲料有限公司。
1.3 仪器
FLx800型多功能酶标仪(美国BioTek公司);RS232G型紫外分光光度计(德国Eppendorf公司);AUT0520型凝胶成像系统、32RL117950型综合式紫外分析仪(美国BG公司);Pico17型离心机(美国Thermo公司);QuantiFluor TBS380型荧光计(美国Promega公司)。
2 方法
2.1 黄芩提取物的制备
黄芩饮片浸泡30 min,分别加入10倍量和8倍量的蒸馏水提取,合并2次提取液,冷凝回流2 h,减压回收提取液,真空冻干制成干燥粉末(经HPLC测得黄芩苷质量分数为12.87%,黄芩素质量分数为0.51%,汉黄芩苷质量分数为3.36%,汉黄芩素质量分数为0.28%),存放于干燥器内备用。
2.2 动物分组、造模与给药
大鼠适应性饲养3 d后,按照体质量均衡分配原则,随机分为对照组、模型组、黄芩提取物(3g/kg)组,每组10只[8]。左甲状腺素钠片研磨至粉末,溶于饮用水配制成质量浓度为0.04 g/mL的溶液;黄芩提取物冻干粉溶于饮用水配制成质量浓度为1 g/mL的混悬液。每天9: 00时对照组ig饮用水(10 mL/kg),其余各组大鼠ig左甲状腺素钠混悬液(0.12 g/kg)[9];自造模开始,每天10: 00时黄芩提取物组ig黄芩提取物(10 mL/kg),对照组、模型组ig等体积饮用水,连续15 d。
2.3 体征指标检测
每天给药前记录大鼠饮水量和体质量的变化,于给药第0、5、10、15天检测并记录大鼠肛温。
2.4 样本收集与处理
末次给药24 h后,大鼠ip 20%乌拉坦麻醉,腹主动脉取血,常温静置30 min,4 ℃、3500 r/min离心10 min,取上清液,于−80 ℃冰箱保存备用。
每组随机选取5只大鼠,脱颈椎处死后取盲肠部位内容物于无菌离心管中,迅速冻存于液氮中,立即转存于−80 ℃冰箱,用于肠道菌群多样性的分析。
2.5 肠道菌群多样性分析
采用Illumina MiSeq测序平台,选用16S rRNA V4可变区的通用引物进行扩增,引物序列长度为280 bp,前引物为5’-AYTGGGYDTAAAGNG-3’,后引物为5’-TACNVGGGTATCTAATCC-3’,98 ℃预变性30 s,变性15 s,50 ℃退火30 s,循环25次,72 ℃延伸30 s,72 ℃最终延伸5 min,4 ℃终止保存。扩增结果用凝胶回收试剂盒回收片段。在Illumina MiSeq平台应用文库检测和定量试剂盒对PCR产物进行定量分析,制备试剂盒与高灵敏度DNA检测试剂盒进行建库,MiSeq试剂盒循环2×300 bp进行双端测序。采用QIIME软件、R软件、Mothur软件对测序结果进行可视化分析。
2.6 血清指标检测
按照酶联免疫试剂盒说明书分别检测大鼠血清中NE、5-HT、DA、TSH、TRH、ACTH、CRH、17-OHCS、IL-2、IL-6、IL-10、IFN-γ水平。
2.7 数据处理
3 结果
3.1 黄芩提取物对热证模型大鼠体征指标的影响
如图1所示,第15天,与对照组比较,模型组大鼠肛温升高,饮水量和体质量显著增加(<0.01);与模型组比较,黄芩提取物组大鼠肛温降低,饮水量和体质量显著降低(<0.01),表明黄芩提取物能够明显改善热证模型大鼠一般体征的变化。
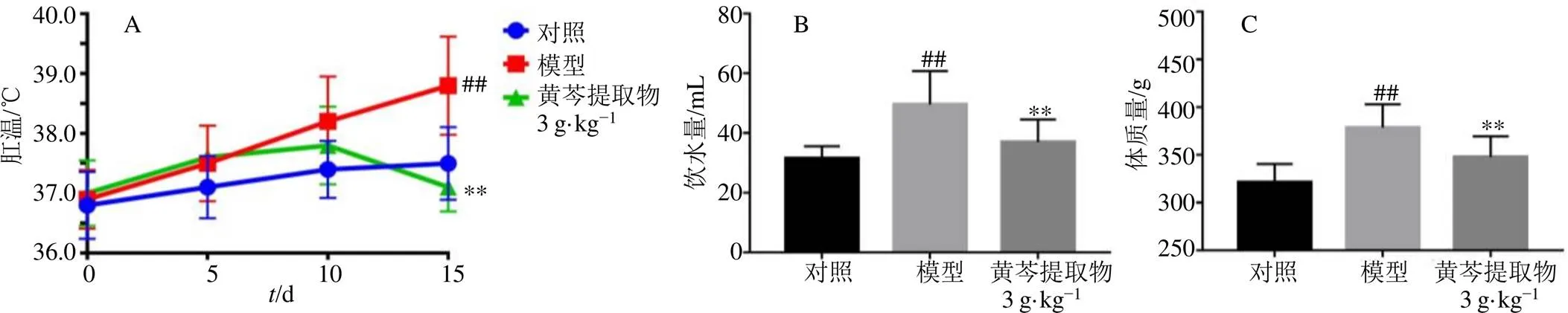
与对照组比较:##P<0.01;与模型组比较:**P<0.01
3.2 黄芩提取物对热证模型大鼠血清指标的影响
如表1~3所示,与对照组比较,模型组大鼠血清中NE、DA、TSH、TRH、CRH、ACTH、17-OHCS、IL-2、IFN-γ水平显著升高(<0.05、0.01),5-HT、IL-6、IL-10水平显著降低(<0.01);与模型组比较,黄芩提取物组大鼠NE、DA、TSH、TRH、CRH、ACTH、17-OHCS、IL-2、IFN-γ水平显著降低(<0.05、0.01),5-HT、IL-6、IL-10水平显著升高(<0.01)。
3.3 肠道菌群分类操作单元(operational taxonomic units,OTUs)与多样性分析
如图2所示,与对照组比较,模型组大鼠肠道菌群门、纲、目、科、属、种6类OTUs地位丰度明显增加;与模型组比较,黄芩提取物组大鼠肠道菌群门、纲、目、科、属、种6类OTUs地位丰度在一定程度上均有所减少。如图3所示,随着样本数量增加,肠道菌群数量会趋于某一恒定值,表明测序深度充分,Specaccum物种累积曲线能足够反映群落丰度水平。α多样性分析结果如表4所示,与对照组比较,模型组大鼠肠道菌群丰度指数(Chao1、ACE)与多样性指数(Simpson、Shannon)显著升高(<0.01);与模型组比较,黄芩提取物组大鼠肠道菌群丰度指数与多样性指数显著降低(<0.01)。采用主成分分析(principal component analysis,PCA)考察大鼠肠道菌群β多样性的差异,如图4所示,模型组与对照组大鼠肠道菌群明显分开,表明2组菌群结构具有显著性差异;黄芩提取物组大鼠肠道菌群趋向对照组,表明黄芩提取物组肠道菌群结构与对照组相近,两者可能存在一定的亲缘关系。
与对照组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01,下表同
#< 0.05##< 0.01control group;*< 0.05**< 0.01model group, same as below tables
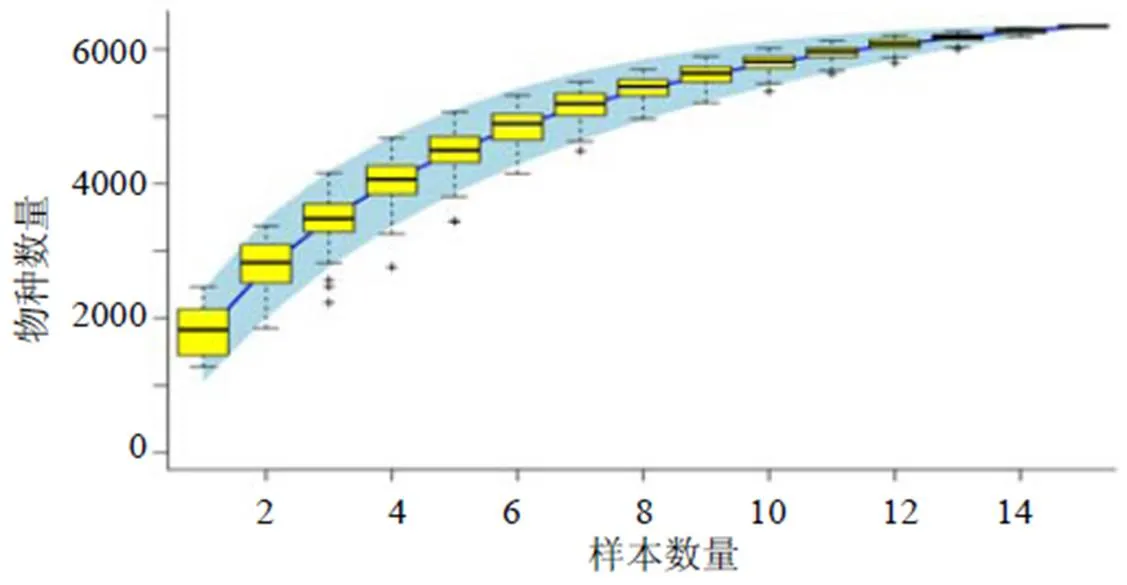
图3 大鼠肠道菌群的Specaccum物种累积曲线
3.4 肠道菌群组成与结构分析
如图5所示,在门水平,与对照组比较,模型组大鼠肠道菌群具有显著性差异的菌门有6个(<0.05、0.01),拟杆菌门(Bacteroidetes)、螺旋菌门(Spirochaetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)上调,厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)下调;黄芩提取物组可显著性回调这6个菌门(<0.05、0.01)。如图6、7所示,在属水平,通过对差异菌门中排前50的优势菌属进行聚类分析,将具有共同差异性菌属的位置在系统发育树中标注,分别是奇异菌属、球杆菌属、布劳特氏菌属、拟杆菌属、克里斯滕森菌属、梭菌属、柯林斯菌属、棒状杆菌属、粪芽孢菌属、粪球菌属、多尔氏菌属、梭杆菌属、螺杆菌属、气球菌属、颤螺旋菌属、苍白杆菌属、狄氏副拟杆菌属、考拉杆菌属、帕拉普氏菌属、普雷沃菌属、罗斯氏菌属、瘤胃球菌属、萨特氏菌属、葡萄球菌属、密螺旋体菌属。如图8所示,与对照组比较,模型组大鼠肠道菌群具有显著性差异的菌属有25个(<0.05、0.01),其中17种菌属上调,8个菌属下调。与模型组比较,黄芩提取物组可显著性回调这25个菌属(<0.05、0.01)。
3.5 差异肠道菌群关联性分析
应用Pearson相关系数分析法,探究黄芩提取物干预热证模型大鼠血清相关指标的过程中差异肠道菌群与神经-内分泌-免疫系统的联系,当||>0.5且<0.05,表示两者之间存在显著相关性;当||>0.8,表示两者之间具有强相关性。如图9、10所示,神经系统与普雷沃菌属、柯林斯菌属、多尔氏菌属关联性较强;免疫系统与普雷沃菌属、柯林斯菌属、螺杆菌属、萨特氏菌属、葡萄球菌属、克里斯滕森菌属、苍白杆菌属关联性较强;内分泌系统与瘤胃球菌属、柯林斯菌属、拟杆菌属、梭菌属、球杆菌属、葡萄球菌属、苍白杆菌属关联性较强。表明黄芩提取物不仅能改善肠道菌群多样性,同时也能回调神经-内分泌-免疫系统的关键指标。
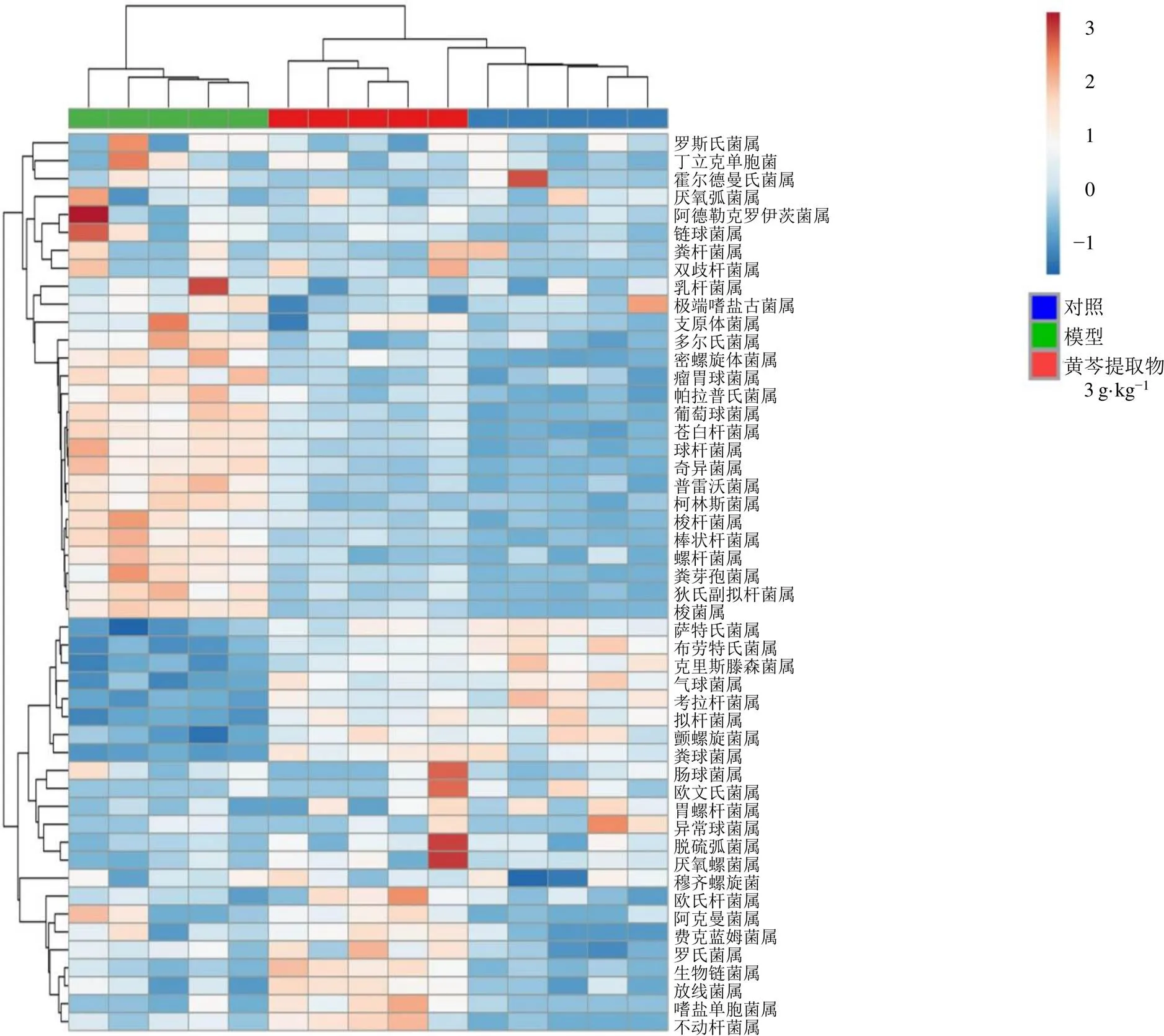
图6 各组大鼠菌群优势菌属的群落分类丰度分布热分析
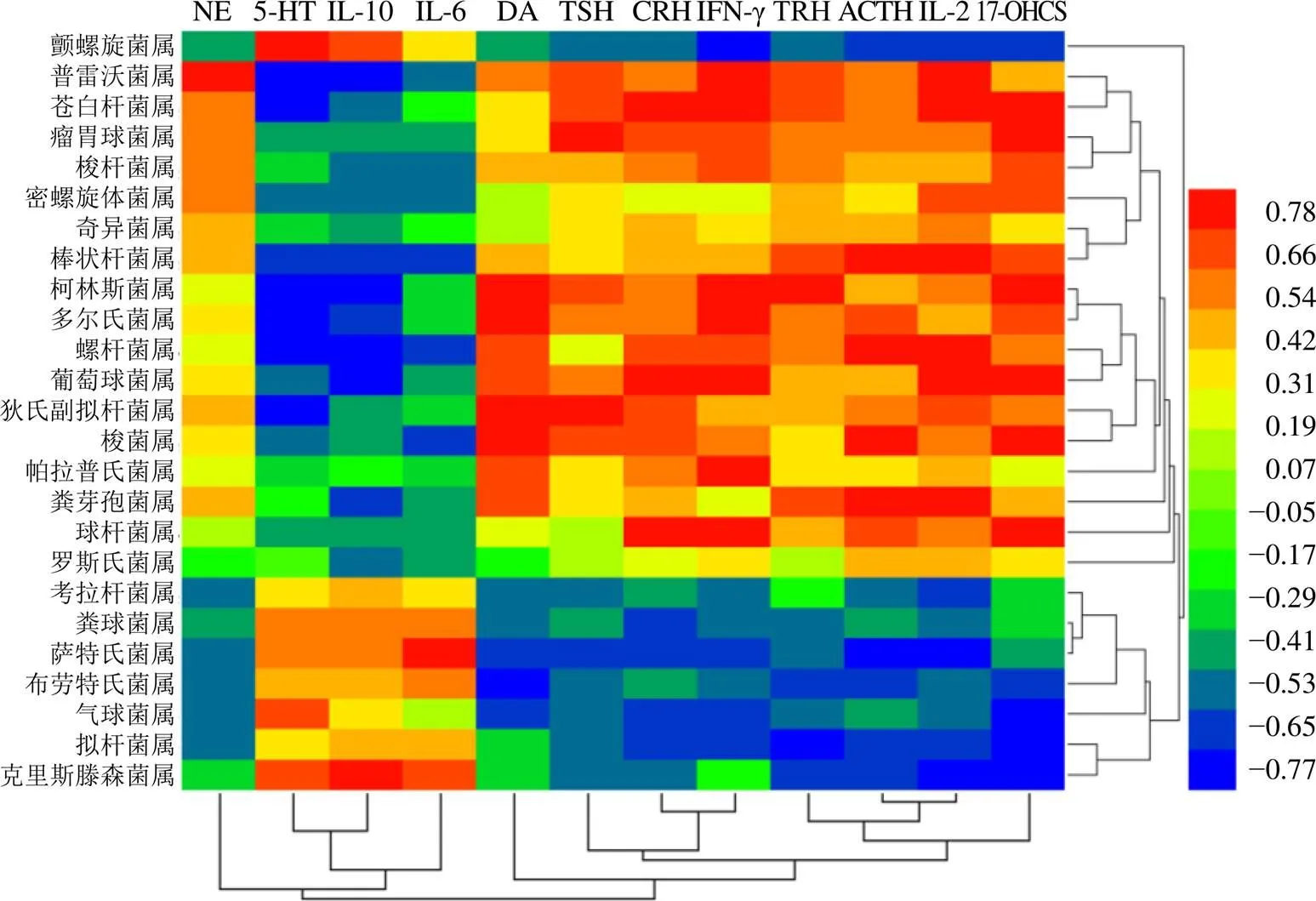
图9 差异菌群与血清指标相关性的热分析
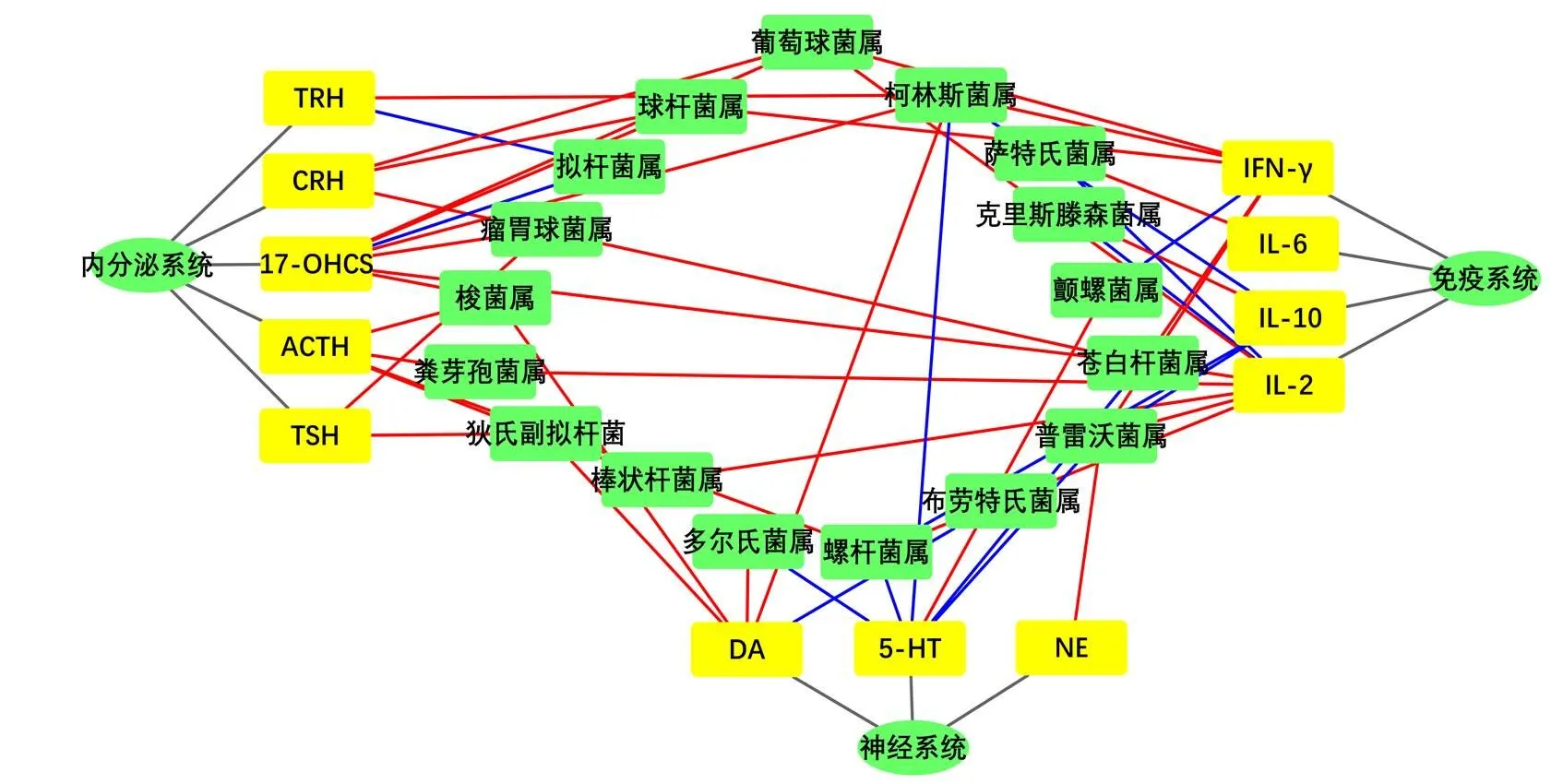
黄色代表血清指标;绿色代表肠道差异菌属;灰色线代表从属关系;红色线代表正相关;蓝色线代表负相关
4 讨论
热证在中医临床中是一个复杂而综合的统称,中医辨证一般将其分为实热证与虚热证,与相应的病变部位或病因相结合产生规范的评价与量化的诊断标准[1]。左甲状腺素钠,又称为优甲乐,临床常用于治疗由各种原因引起的甲状腺功能减退,可促进机体各组织与器官氧化反应[10],饮水量、体质量、体温变化是其一般体征的直观表现[11]。DA、5-HT、NE是中枢神经系统中重要的神经递质,可调控交感神经系统与脊髓神经系统的功能,是大脑内部兴奋活动的重要体现[12];CRH、ACTH、17-OHCS是参与下丘脑与垂体的关键性肾上腺皮质激素,与TRH、TSH共同作用于内分泌系统中下丘脑-垂体-促甲状腺素轴的调节,是中医热证形成物质与能量代谢亢进的表现[13]。中医热证免疫系统会加速消耗免疫系统,T淋巴细胞的转化率增加,造成CD4+T细胞中的IL-2、IFN-γ与CD8+T中的IL-6、IL-10水平失调,导致炎症因子水平升高、抗炎因子水平降低[14-15]。结合饮食量、肛温与体质量相关数据分析,本研究结果显示热证状态下机体的各个系统均处于兴奋水平,黄芩提取物对热证模型大鼠神经-内分泌-免疫系统中的关键指标均起到调节作用,表明黄芩提取物能从整体出发改善神经-内分泌-免疫系统和相应体征,是中医“热者寒之”的价值体现。
肠道微生态系统在人体中处于动态平衡,当受到外界的干预或刺激后,菌群稳态被打破,在不断变化中恢复原先相关肠道菌群的组成与结构的功能,通过对菌群微生态相关指标的评价,能反映出药物对疾病治疗的效果[16-17]。本研究发现黄芩提取物可显著回调具有差异的6个菌门与25个菌属。拟杆菌门与厚壁菌门之和占人体细菌总数量的90%以上,Gulas等[18]通过对厚壁菌门与拟杆菌门相对比例的研究发现,肠道内容物中拟杆菌门与厚壁菌门的比例大于正常值时,将加速肠内微生物对食物中热量的有效吸收,促进机体能量代谢与物质代谢的速率;放线菌门(主要以双歧杆菌为主)和变形菌门(主要以肠杆菌为主)属于中性菌属,若肠道内微环境遭到破坏,会变成带有侵袭性或致病性菌群迁移到身体其他部位,造成相关组织或系统的病变[19]。本研究结果显示黄芩提取物可改善热证大鼠模型中拟杆菌门、厚壁菌门、放线菌门与变形菌门的数量,促进紊乱的肠道微环境恢复正常的动态平衡与稳态,本研究将肠道微生态作为整体,体现出中药黄芩对热证治疗的“整体观”思想。螺旋菌门与梭杆菌门为宿主内的微量菌门,随着生物领域技术的不断发展,其相应的菌物学意义有待于进一步探索。
联合差异菌属与神经-内分泌-免疫系统关键指标的分析结果发现,柯林斯菌属对免疫系统、中枢神经系统与内分泌系统均有强相关作用。柯林斯菌属是一种产气菌属,可促进β-类固醇脱氢酶的产生,加快体内熊去氧胆酸的合成,提高机体物质与能量代谢的转化效率,增强机体抗氧化能力及免疫功能[20-21];普雷沃菌属为拟杆菌门不产芽孢的厌氧菌属,主要代谢产物为乙酸、琥珀酸和少量丁酸[22],能促进神经鞘脂类递质的产生,影响免疫系统和神经系统的反馈调节[23-24];苍白杆菌属是一种条件致病菌属,对免疫功能低下者具有强感染能力,可造成自身免疫应答反应过激、内分泌系统代谢紊乱等现象[25-26]。本研究结果表明,黄芩提取物对25种差异菌属和神经-内分泌-免疫系统轴的关键指标具有显著回调能力,表明中药具有多靶点、多途径的特点,更体现出中医药治疗“整体观”的思维。
综上所述,黄芩提取物可有效改善热证大鼠模型肠道菌群多样性和神经-内分泌-免疫系统的变化,通过16S rRNA高通量测序技术可建立对中医证候评价体系,对相关中药及复方用于此类中医证候研究具有深远的指导意义。肠道微生态变化不仅会对机体肠道菌群多样性产生影响,还会对相关组织细胞中蛋白质合成或转录因子引起反馈效应,课题组后续将联合多组学技术和整合药理学方法,对“热者寒之”的科学内涵进行更深入的诠释。
利益冲突 所有作者均声明不存在利益冲突
[1] 赵洪伟, 张宁, 庞牧, 等. 玄参及其拆分组分对热证大鼠物质与能量代谢的影响 [J]. 中药药理与临床, 2017, 33(6): 93-96.
[2] Zhou N, Yang Y Y, Li K,. Integrating strategies of chemistry, biochemistry and metabolomics for characterization of the medication principle of “treating cold/heat syndrome with hot/cold herbs” [J]., 2019, 239: 111899.
[3] 梁月华. 寒、热证本质研究回顾及展望 [J]. 中国中西医结合杂志, 2019, 39(4): 397-404.
[4] 顾宁宁, 张兴德, 郁红礼, 等. 基于16S rRNA基因测序的黄连对2型糖尿病大鼠肠道微生物多样性影响研究 [J]. 中草药, 2017, 48(19): 3998-4004.
[5] 张北华, 王凤云, 卞兆祥, 等. 证候表型与肠道微生态的相关性 [J]. 中医杂志, 2018, 59(1): 21-25.
[6] 黄腾杰. 阳虚质肠道菌群结构特征研究 [D]. 北京: 北京中医药大学, 2015.
[7] 张亚男, 陈平平, 王洪玉, 等. 黄芩拆分组分寒热药性归属 [J]. 辽宁中医药大学学报, 2017, 19(12): 32-36.
[8] 高鑫, 陈平平, 王喆, 等. 基于大鼠机体能量代谢生物标志物变化的黄芩药性研究 [J]. 中华中医药杂志, 2018, 33(5): 2031-2036.
[9] 陈平平, 张亚男, 王喆, 等. 基于蛋白组学方法研究黄芩对热证大鼠物质能量代谢的影响 [J]. 中药药理与临床, 2018, 34(5): 90-96.
[10] 张宁, 李自辉, 赵洪伟, 等. 基于尿液代谢组学研究玄参对阴虚火旺甲亢大鼠的滋阴降火作用机制 [J]. 药学学报, 2018, 53(11): 1843-1851.
[11] 张宁, 李自辉, 赵洪伟, 等. 玄参提取物对甲亢模型大鼠肝脏代谢组学的影响 [J]. 北京中医药大学学报, 2019, 42(1): 21-29.
[12] 王瑞生, 张振凌, 陈祎甜, 等. 基于寒热证模型大鼠研究五倍子发酵百药煎的药性变化和归属 [J]. 中国中药杂志, 2019, 44(10): 2084-2089.
[13] 张宏伟, 王嘉琪, 张婕, 等. 关黄柏醇提部位化学拆分组分分析及其对热证大鼠的影响 [J]. 中国实验方剂学杂志, 2017, 23(10): 29-33.
[14] Kim J E, Sharma A, Sharma G,.modulates immune response by inducing IL-10 producing Tr1 cells [J]., 2019, 19(6): e39.
[15] Tielking K, Fischer S, Preissner K T,. Extracellular RNA in central nervous system pathologies [J]., 2019, 12: 254.
[16] Guo T T, Song D, Cheng L,. Interactions of tea catechins with intestinal microbiota and their implication for human health [J]., 2019, 28(6): 1617-1625.
[17] Alesa D I, Alshamrani H M, Alzahrani Y A,. The role of gut microbiome in the pathogenesis of psoriasis and the therapeutic effects of probiotics [J]., 2019, 8(11): 3496-3503.
[18] Gulas E, Wysiadecki G, Strzelecki D,. Can microbiology affect psychiatry? A link between gut microbiota and psychiatric disorders [J]., 2018, 52(6): 1023-1039.
[19] Jin J, Zhang H, Li D,. Effectiveness of Xin Jia Xuan Bai Cheng Qi Decoction in treating acute exacerbation of chronic obstructive pulmonary disease: Study protocol for a multicentre, randomised, controlled trial [J]., 2019, 9(11): e030249.
[20] Masha S C, Owuor C, Ngoi J M,. Comparative analysis of the vaginal microbiome of pregnant women with eitheror[J]., 2019, 14(12): e0225545.
[21] Sheng Q, Du H, Cheng X,. Characteristics of fecal gut microbiota in patients with colorectal cancer at different stages and different sites [J]., 2019, 18(5): 4834-4844.
[22] Baba Y, Matsuki Y, Takizawa S,. Pretreatment of lignocellulosic biomass with cattle rumen fluid for methane production: Fate of added rumen microbes and indigenous microbes of methane seed sludge [J]., 2019, 34(4): 421-428.
[23] Yu C, Zhou B, Xia X,.is associated with carboplatin-induced gut toxicity [J]., 2019, 10(10): 714.
[24] Sun X, Gao Y, Wang X,.O101-induced diarrhea develops gut microbial dysbiosis in rats [J]., 2019, 17(1): 824-834.
[25] Zarinviarsagh M, Ebrahimipour G, Sadeghi H. Lipase and biosurfactant fromstrain MZV101 isolated by washing powder for detergent application [J]., 2017, 16(1): 177.
[26] Li L H, Lv S, Lu Y,. Spatial structure of the microbiome in the gut of[J]., 2019, 19(1): 273.
Effect ofextract on intestinal microflora diversity in rats with heat syndrome based on high-throughput sequencing
LI Zi-hui1, 2, CHEN Ping-ping1, WANG Yu1, ZHANG Ya-nan1,WU Juan3, LIU Shu-min1
1. Research Institute of Traditional Chinese Medicine, Heilongjiang University of Chinese Medicine, Harbin 150040, China 2. Medical College, Dalian University, Dalian 116622, China 3. Center of Drug Safety Evaluation, Heilongjiang University of Chinese Medicine, Harbin 150040, China
To explore the effect ofextract on the diversity of intestinal flora in heat syndrome model rats, and explore the scientific connotation of the thought of “treating heat syndrome with cold natured drugs” in traditional Chinese medicine.Male SD rats were randomly divided into control group, model group andextract (3 g/kg) group. Except for the control group, rats in the other group were ig levothyroxine sodium suspension (0.12 g/kg) every morning, one hour after modeling, rats inextract group were igextract (10 mL/kg), rats in control group and model group were ig same volume of drinking water for 15 d. 16 S rRNA technique was used to sequence the intestinal microflora in the V4 area of the cecum, and the rat serum was taken to determine 12 key indexes in the neuro-endocrine-immune system. The interaction system between differential bacteria and neuro-endocrine-immune system was constructed.extract significantly adjusted 12 key indexes in the neuro-endocrine-immune system of heat syndrome model rats, significantly improved the number of operational taxonomic units (OTUs) and the imbalance of diversity between α, β in the intestinal tract, reduced the biological richness and diversity index of flora, and regulated the relative abundance of six different bacteria and 25 different bacteria in heat model rats.,andhad strong correlation with neuro-endocrine-immune system.extract could improve the abnormality of neuro-endocrine-immune system and intestinal flora in heat syndrome model rats.,andmay be potential markers of heat syndrome model.
Georgi;heat syndrome; intestinal flora; high-throughput sequencing; 16S rRNA technique; neuro- endocrine-immune system
R285.5
A
0253 - 2670(2021)02 - 0422 - 10
10.7501/j.issn.0253-2670.2021.02.015
2020-07-01
国家重点基础研究发展“973”计划项目(2013CB531804);黑龙江省自然科学基金联合引导项目(LH2020H099)
李自辉,男,博士,讲师,研究方向为中药性味理论及药效物质基础研究。Tel: 15604616931 E-mail: 1831794073@qq.com
刘树民,男,博士,教授,博士生导师,研究方向为中药性味理论及药效物质基础研究。Tel: 13945133028 E-mail: keji-liu@163.com
[责任编辑 李亚楠]
