鹿茸饮片浸出物提取方法的建立及多成分测定在质量评价中的应用
2021-01-19陆雨顺王泽帅毕晓东夏蕴实孙印石
陆雨顺,王泽帅,毕晓东,夏蕴实,卢 思,孙印石*
鹿茸饮片浸出物提取方法的建立及多成分测定在质量评价中的应用
陆雨顺1,王泽帅1,毕晓东2,夏蕴实1,卢 思2,孙印石1*
1. 中国农业科学院特产研究所,吉林 长春 130112 2. 吉林省鹿产品质量监督检验中心,吉林 长春 130600
比较不同提取方式、不同溶剂、不同料液比、不同提取时间对鹿茸浸出物得率的影响,对15个产地养殖的60批鹿茸饮片中7种核苷类主要成分(尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、尿苷、肌苷和鸟苷)进行分析,比较不同部位鹿茸饮片(蜡片、粉片、纱片和骨片)的差异。参照《中国药典》2015年版四部通则相关方法优化鹿茸浸出物的提取方法,建立鹿茸浸出物最佳提取工艺,采用UPLC法对60批不同批次鹿茸饮片7种核苷类成分进行测定,结合主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA)化学计量学方法对鹿茸饮片进行区分与比较。热浸法提取条件下水溶性浸出物含量显著高于冷浸法,同一批次来源不同部位鹿茸饮片的浸出物含量,骨片低于蜡片、粉片、纱片(<0.05)。不同部位饮片中7种核苷类成分总量在0.95~5.20 mg/g。通过OPLS-DA得出5个主要差异性成分尿嘧啶、鸟嘌呤、次黄嘌呤、尿苷和鸟苷为不同部位鹿茸饮片之间含量变化差异较为显著的成分。建立的鹿茸浸出物提取方法简便高效,结合7种核苷类成分含量测定可将纱片、骨片、蜡片与粉片之间进行初步区分,从而用于鹿茸饮片的质量控制与评价,为进一步完善鹿茸质量标准提供科学依据。
鹿茸;浸出物;核苷成分;正交偏最小二乘法-判别分析;质量控制;主成分分析
鹿茸为鹿科鹿属动物梅花鹿Temminck或马鹿Linnaeus雄鹿未骨化密生茸毛的幼角[1]。鹿茸具有较高的食用和药用价值,富含胶原蛋白[2]、多肽[3]、多糖[4]、甾体化合物[5-6]、氨基酸[7]、脂肪酸[8-9]、无机元素[10]、核苷及生物碱[11-15]等多种营养成分,具有增强免疫[16-18]、抗疲劳[19]、保护神经系统[20]等功效。目前,市场上流通的鹿茸通常按照不同切制部位分为蜡片、粉片、纱片、骨片进行流通,不同部位饮片之间化学成分差异较大且功效物质不明确[21]。因此,针对鹿茸具有多成分多作用靶点的特点,采用浸出物联合含量测定复合指标共同评价饮片质量,以便完善鹿茸品质评价标准。
浸出物测定系指用水或其它适宜的溶剂对药材和饮片中可溶性物质进行的测定[1]。目前,已有研究利用浸出物对不同产地、不同品种及不同炮制方式的中草药进行质量控制[22-26]。而在鹿茸中找到结构明晰、功能明确的某类成分或质量标志物之前,通过测定浸出物含量,对鹿茸进行质量控制更具有可操作性和现实意义。然而《中国药典》2015年版中收录的4个鹿产品中只有鹿角规定了浸出物含量限度,尚未制定鹿茸浸出物的测定方法及浸出物含量。因此,为充分考虑样品的代表性及多样性,本实验收集了全国15个产地养殖的60批不同规格的鹿茸饮片,通过比较不同提取方法、提取溶剂、料液比、提取时间对鹿茸饮片浸出物的影响,建立最佳提取方法。结合浸出物中7种核苷类成分的定量分析,以期在性状鉴别的基础上,采用浸出物联合多成分含量测定复合指标共同评价,建立客观合理的质控指标,为进一步完善鹿茸的质量标准提供科学依据。
1 材料
1.1 仪器与试剂
Acquity UPLC H-Class型超高效液相色谱仪,PDA检测器,美国沃特世公司;DHG-9123A型电热恒温鼓风干燥箱,上海精宏有限公司;MS-204-S电子分析天平,瑞士梅特勒-托利多公司;WP-UP- WF-40微量分析型超纯水机,四川沃特尔水处理设备有限公司;DTC-8超声清洗机,湖北鼎泰恒胜超声波清洗设备有限公司;TGL-16G高速台式离心机,上海安亭科学仪器厂;Vortex 3旋涡混匀器,德国艾卡仪器设备有限公司。
对照品尿嘧啶(批号TM0313XB13)、鸟嘌呤(批号KM0522CA14)、次黄嘌呤(批号TM0313XC13)、黄嘌呤(批号AJ0722MA14)、尿苷(批号TM0313XA13)、肌苷(批号TJ0623XA13)和鸟苷(批号AJ0609NA14),质量分数均大于98%,购自上海源叶生物科技有限公司;甲酸、乙腈,色谱级,购自美国Sigma公司;无水乙醇,分析纯,购自北京化工厂。
1.2 样品
采自全国10个省份、15个不同产地养殖的鲜鹿茸,经中国农业科学院特产研究所孙印石研究员鉴定为鹿科动物梅花鹿Temminck雄鹿未骨化密生茸毛的幼角(二杠),按照行业标准切制成蜡片、粉片、纱片、骨片4个部位,粉碎备用,具体信息见表1。另取梅花鹿鹿茸(二杠),由中国农业科学院特产所左家试验站提供,整只粉碎备用,编号H1。
2 方法
2.1 浸出物提取工艺优化
2.1.1 冷浸法对浸出物含量的影响 参照《中国药典》2015年版附录2201浸出物测定法中冷浸法操作规程,准确称取供试品H1粉末4.00 g,15份,精密称定,置250 mL锥形瓶中,分别精密量取水及20%、40%、60%、80%乙醇各100 mL,每组试验重复3次,冷浸24 h,参照《中国药典》2015年版附录2201测定方法中冷浸法操作规程,计算各浸出物得率。
2.1.2 热浸法对浸出物含量的影响 参照《中国药典》2015年版附录2201浸出物测定法中热浸法操作规程,准确称取供试品H1粉末2.00 g,15份,精密称定,置250 mL的锥形瓶中,分别精密加水及20%、40%、60%、80%乙醇各50 mL,每组试验重复3次,参照《中国药典》2015年版附录2201测定方法中热浸法操作规程,计算各浸出物得率。
2.1.3 料液比对浸出物含量的影响 准确称取供试品H1粉末2.00 g,15份,精密称定,置250 mL的锥形瓶中,选取提取温度为98 ℃、回流提取时间为1 h,以料液比1∶20、1∶25、1∶30、1∶35、1∶40精密量取水,加入锥形瓶,每组实验重复3次,参照《中国药典》2015年版附录2201测定方法中热浸法操作规程,计算各浸出物得率。
2.1.4 提取时间对浸出物含量的影响 准确称取供试品H1粉末2.00 g,12份,精密称定,置250 mL的锥形瓶中,选取提取温度为98 ℃、料液比为1∶25精密量取水,以回流提取时间0.5、1.0、2.0、3.0 h对供试品进行提取,每组实验重复3次,参照《中国药典》2015年版附录2201测定方法中热浸法操作规程,依法计算各浸出物得率。
2.2 鹿茸浸出物中多成分含量测定
2.2.1 供试品溶液制备 取鹿茸片粉末(过60目筛)约0.10 g,精密称定,置于5 mL离心管中,加水2 mL,超声处理30 min后,5000 r/min离心,取上清液,经0.22 μm水系微孔滤膜滤过,供UPLC检测分析。
2.2.2 对照品溶液制备 精密称取尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、尿苷、肌苷和鸟苷对照品各5.00 mg,置于5.00 mL量瓶中,除鸟嘌呤、黄嘌呤采用0.1%氢氧化钠溶解外,其他对照品均采用超纯水溶解,配成质量浓度均为1000 mg/L的对照品储备液。取各对照品储备液800 µL于10 mL量瓶中,室温条件下超纯水定容,配成质量浓度均为80 mg/L的混合对照品母液。
2.2.3 色谱条件 色谱柱为Acquity UPLC HSS T3柱(100 mm×2.1 mm,1.8 μm);流动相为A为0.006%醋酸水溶液,B为乙腈;体积流量0.30 mL/min;柱温35 ℃;进样量1 μL;梯度洗脱程序:0~1 min,100% A;1~10 min,100%~94% A;10~11.5 min,94%~85% A;11.5~13 min,85%~100% A;13~15 min,100% A。
3 结果与讨论
3.1 提取工艺对鹿茸浸出物的影响
3.1.1 不同提取溶剂对鹿茸浸出物得率的影响 从表2中可以看出,热浸法在不同体积分数乙醇提取条件下明显高于冷浸法,为冷浸法浸出物得率的2倍以上。这可能是因为高温增加了目标化合物的溶解度和传质速率,有利于萃取。水溶性浸出物高于醇溶性浸出物,并且随着乙醇体积分数的增加,浸出物得率呈现下降趋势。这是因为水的极性较高,使得鹿茸水溶性多糖和蛋白更好地溶解,从而得到较高的浸出物得率。因此,于热浸法下,选择水作为鹿茸提取溶剂,既达到了较高提取效率又降低了成本。
3.1.2 不同料液比对鹿茸浸出物得率的影响 表3实验结果显示,在热浸法中,当料液比从1∶20增加到1∶25时,鹿茸浸出物的得率随料液比的增加而增加。一般来说,较高的溶剂体积可以更有效地溶解目标化合物,从而得到更好的提取率。当料液比从1∶25增加到1∶35时,没有显著差异(>0.05)。因此,在热浸法中最适合的料液比应为1∶25,鹿茸水溶性浸出物得率达到24.55%,即达到较高的提取效率又避免了溶剂浪费。
上标字母相同表示没有显著性差异(>0.05),否则有显著性差异(<0.05),下表同
The same superscript letters indicate no significant difference (> 0.05); otherwise, there is a significant difference (< 0.05), same as below
3.1.3 不同提取时间对鹿茸浸出物得率的影响 一般来说,为获得较高的提取率需要较长的提取时间,当达到一定提取时间时,提取率达到饱和或逐渐降低[27]。表4实验结果表明,当采用热浸法提取鹿茸时间从0.5 h增加到1.0 h时,热浸法鹿茸浸出物的得率从21.04%增加到24.82%,并在后续的3.0 h内无显著性差异(>0.05)。因此,热浸法的最佳提取时间为1.0 h。
3.1.4 浸出物提取方法应用验证 取鹿茸粉末2 g,在最优的提取条件下,应用热浸法,以水为提取溶剂、料液比为1∶25,提取时间为1.0 h,每组实验重复3次,测定水溶性浸出物的得率,结果见表5。从表5中可以看出,不同产地养殖的鹿茸浸出物含量存在一定差异,6个产地养殖的鹿茸中以吉林省长春市为最高,鹿茸各部位浸出物含量高于其他地区。从鹿茸饮片来看,骨片浸出物含量明显低于其他3个部位。通过进一步检验分析发现,骨片与蜡片、粉片、纱片之间均具有显著性差异(<0.05)。为进一步区分不同规格鹿茸饮片,有必要对不同产地养殖的鹿茸饮片水溶性提取物中的化学成分进行比较分析。
3.2 方法学考察结果
3.2.1 线性关系、检出限和定量限考察 准确量取混合对照品储备液,用水稀释成2、5、10、20、40、80 mg/L系列混合标准溶液,现配现用。以各组分的质量浓度为横坐标(),相应的峰面积为纵坐标(),绘制标准曲线,进行线性回归,得到7种核苷类成分的线性回归方程,按照信噪比(/)=3计算检出限,/=10计算定量限,结果见表6。结果表明,7种核苷成分均在2~80 mg/L呈良好的线性关系。
3.2.2 精密度试验 取混合对照品溶液20 mg/L,连续进样6次,计算各成分峰面积的RSD值。结果显示尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、尿苷、肌苷和鸟苷峰面积的RSD值分别为1.60%、0.11%、0.21%、0.43%、0.05%、0.41%、0.03%。
3.2.3 重复性试验 精密称取鹿茸(L6)粉末6份,每份0.1g,按“2.3.1”项下方法制备供试品溶液,按“2.3.3”项下色谱条件进样1 μL,计算各成分峰面积的RSD值。结果显示尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、尿苷、肌苷和鸟苷质量分数的RSD值分别为0.13%、0.25%、0.81%、0.40%、0.65%、0.87%、1.03%。
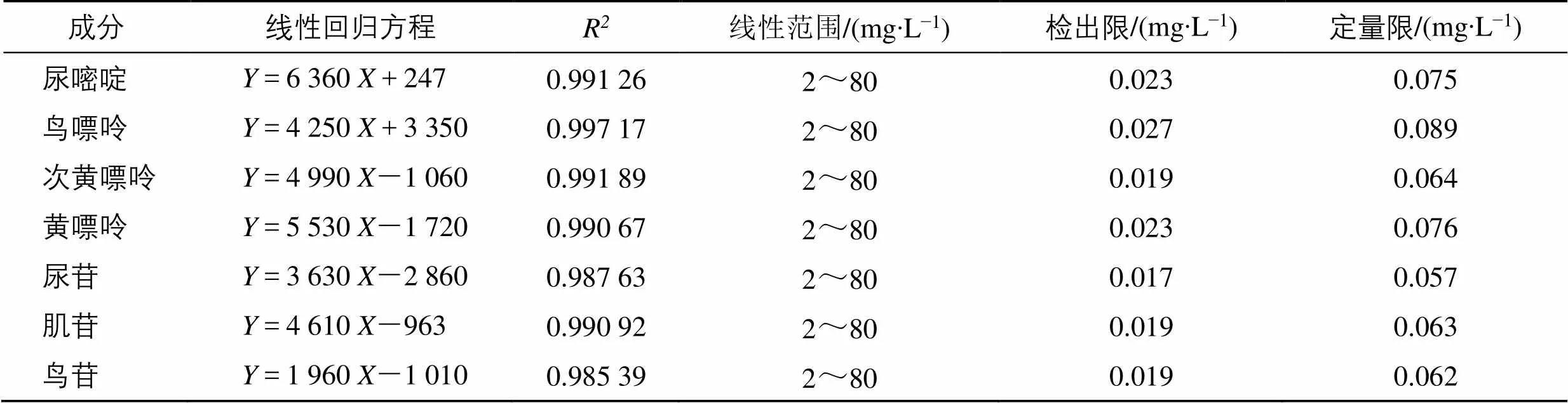
表6 核苷类成分的线性回归方程、检出限和定量限
3.2.4 稳定性试验 取鹿茸(L6)供试品溶液,按“2.3.3”项下色谱条件分别于0、3、6、12、24 h进样1 μL,测定对各成分峰面积,计算RSD值。结果表明,7种核苷类成分峰面积的RSD值分别是0.09%、0.23%、0.68%、0.35%、0.43%、0.94%、0.53%。
3.2.5 加样回收率试验 精密称取6份鹿茸(L6)粉末,每份0.05 g,分别加入适量对照品溶液,按“2.3.1”项下方法制备供试品溶液,测定并计算7种核苷类成分的加样回收率平均值,结果表示,7种核苷类成分平均加样回收率分别为88.50%、109.43%、84.52%、93.67 %、105.40%、108.30%、99.70%,RSD分别为0.10%、0.12%、1.12%、0.36%、0.20%、0.62%、1.60%。加样回收试验结果表明,在不同的质量浓度添加水平下,7种核苷的平均加样回收率均在80%~120%,RSD在0.10%~1.60%,说明该方法准确度较高。
3.3 核苷类成分定量测定
按照“2.3.3”项下色谱条件对鹿茸水溶性浸出物中主要成分进行含量测定,7种核苷类组分对照品及鹿茸样品(L1~G16)色谱图见图1,测定结果见表7。
表7结果表明,不同部位鹿茸饮片核苷成分总量相差较大(<0.05),7种核苷成分总量为0.95~5.20 mg/g,其中蜡片含量最高,15批蜡片为3.15~5.20 mg/g,平均总量约为4.12 mg/g;粉片为2.76~4.42 mg/g,平均总量约为3.56 mg/g;纱片为1.88~3.18 mg/g,平均总量为2.49 mg/g;骨片为0.95~2.54 mg/g,平均总量为1.46 mg/g。不同产地养殖梅花鹿鹿茸饮片之间各核苷成分含量也存在差异,蜡片排名前3的地区分别为吉林省长春市、辽宁省西丰县、吉林省四平市;粉片排名前3的地区黑龙江黑河市、贵州省贵阳市、江西省丰台市;纱片排名前3的地区为吉林省吉林市、山东省青岛市、吉林四平市;骨片排名前3的地区为山东青岛市、吉林白山市、辽宁西丰县。根据鹿茸骨片的7种核苷类成分平均含量以及不同地区检出的最低含量,认为可将其平均含量的70%定为限量标准,建议鹿茸饮片7种核苷总量含量不得低于1.05 mg/g。
表8结果为对取自15个产地养殖的鹿茸饮片(蜡片、粉片、纱片、骨片)中7种核苷类主要成分(尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、尿苷、肌苷和鸟苷)分别计算平均值,除以不同部位鹿茸饮片总核苷平均含量,得到不同部位鹿茸饮片中7种核苷分别占总核苷的比例情况,发现7种核苷类成分的量比关系在不同饮片(蜡片、粉片、纱片、骨片)中存在差异,按照尿嘧啶、鸟嘌呤、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷的顺序,蜡片中7种核苷的量比关系为1.00∶0.60∶0.97∶0.05∶0.78∶0.68∶0.83;粉片中7种核苷的量比关系为1.00∶0.73∶1.07∶0.06∶1.06∶0.78∶0.87;纱片中7种核苷的量比关系为1.00∶0.72∶1.10∶0.11∶1.54∶1.46∶1.74;骨片中7种核苷的量比关系为1.00∶0.48∶0.98∶0.15∶1.43∶1.79∶1.84。从7种核苷量比上看,蜡片、粉片中7种核苷含量比例趋于一致,与纱片和骨片中7种核苷含量的占比情况有所不同,纱片和骨片中尿嘌呤、鸟嘌呤、次黄嘌呤占总核苷的比例有明显减少,肌苷、鸟苷占总核苷的比例有明显上升。可见不同鹿茸饮片中7种核苷成分的比值不同。
续表7
ND:低于定量限,未检出
ND: below the limit of quantitation, not detected
表8 鹿茸饮片中7种核苷含量在总核苷含量中的占比情况(, n = 3)
3.4 化学模式识别区分不同部位鹿茸
3.4.1 主成分分析(PCA) 以60批鹿茸饮片样本测得的7种核苷成分的含量为变量,通过无监督模式的PCA,结果见图2。可以看出蜡片与粉片不能完全区分,纱片、骨片分布比较集中,可以明显区别于蜡片与粉片。在60批样本中江西省丰城市骨片和黑龙江省黑河市粉片出现离群样本情况也实属正常,因为样本本身存在组内差异。

图2 鹿茸饮片PCA图
3.4.2 正交偏最小二乘-判别分析(OPLS-DA) 为了更进一步的比较不同部位鹿茸饮片的成分差异,采用有监督的OPLS-DA法对15个不同产地养殖的梅花鹿鹿茸饮片进行分析[28-31],结果见图3。
通过对所建立的OPLS-DA模型进行=200的置换检验,其中累积解释能力参数认为2和2大于0.5,并且2与轴的截距在原点以下,证明模型具有较好的稳定性及预测能力[32],相反2和2小于0.5,则说明模型不能很好地区分2组。图3中B~F均满足2和2大于0.5,并且2回归截距小于0.05,证明蜡片与纱片、蜡片与骨片、粉片与纱片、粉片与骨片、纱片与骨片之间都有明显区分。但在蜡片和粉片的区分模型构建中,X2为0.612,Y2为0.383,2为0.194小于0.5,说明所建立的模型不能很好地将蜡片和粉片分为2类,黑龙江省大庆市和新疆昌吉市的蜡片倾向于其他地区的粉片,而江西省丰城市和吉林省长春市的粉片趋向于其他地区的蜡片,说明不同产地养殖的鹿茸在蜡片和粉片质量上有所差异,导致个别地区模型不能很好地区分。进一步以变量权重重要性排序(variable importance in projection,VIP)预测值大于1作为标准,得出各标定峰对于区分不同部位梅花鹿鹿茸饮片做出的贡献程度。在蜡片和纱片、蜡片和骨片、粉片和纱片,粉片和骨片进行对比时,均是峰3、2、1的贡献较大,在纱片和骨片进行对比时,峰7、2、5的贡献较大,而蜡片和粉片的主要区别作用的峰分别为峰1、3以及峰7。
4 结论
本实验从浸出物的角度研究其与鹿茸饮片质量的关系,通过系统比较提取方法、提取溶剂(水和不同乙醇浓度)、料液比和提取时间系统地考察了鹿茸浸出物提取方法,发现热浸法下鹿茸水溶性浸出物具有提取率高、成本低的特点。对全国6个产地养殖的不同部位鹿茸浸出物应用验证发现,热浸法下水溶性浸出物可明显区分骨片与其他部位鹿茸饮片(蜡片、粉片、纱片)。同时对60批鹿茸饮片水溶性浸出物中标示性成分核苷类物质进行测定,结果显示鹿茸中7种核苷成分的量比关系及总量在不同部位的鹿茸饮片之间有显著差异。本研究结果从浸出物和核苷成分方面验证了传统分级的科学性,为进一步完善鹿茸及相关产品、药品的质量控制提供数据支撑。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2015: 232.
[2] Price J S, Oyajobi B O, Nalin A M,. Chondrogenesis in the regenerating antler tip in red deer: Expression of collagen types I, IIA, IIB, and X demonstrated bynucleic acid hybridization and immunocytochemistry [J]., 1996, 205(3): 332-347.
[3] Barling P M, Lai A K, Nicholson L F. Distribution of EGF and its receptor in growing red deer antler [J]., 2005, 29(3): 229-236.
[4] Jeon B T, Cheong S H, Kim D H,. Effect of antler development stage on the chemical composition of velvet antler in elk (canadensis) [J]., 2011, 24(9): 1303-1313.
[5] Lu C M, Wang M T, Mu J,. Simultaneous determination of eighteen steroid hormones in antler velvet by gas chromatography-tandem mass spectrometry [J]., 2013, 141(3): 1796-1806.
[6] 李春燕, 芦春梅, 齐燕飞, 等. 鹿茸中18种性激素的提取技术研究 [J]. 分子科学学报, 2016, 32(2): 123-128.
[7] Jeon B, Kim S, Lee S,. Effect of antler growth period on the chemical composition of velvet antler in sika deer () [J]., 2009, 74(5):374-380.
[8] Ivankina N F, Isay S V, Busarova N G,. Prostaglandin-like activity, fatty acid and phospholipid composition of sika deer () antlers at different growth stages [J].:, 1993, 106(1):159-162.
[9] Lee S R, Jeon B T, Kim S J,. Effects of antler development stage on fatty acid, vitamin and GAGs contents of velvet antler in spotted deer () [J]., 2007, 20(10): 1546-1550.
[10] 董万超, 刘春华, 赵立波, 等. 马鹿茸、梅花鹿茸不同部位无机元素含量测定分析 [J]. 特产研究, 2004, 26(3): 32-36.
[11] 刘雪莹, 刘雨霏, 陈昊媛, 等. 梅花鹿鹿茸和马鹿鹿茸中5种核苷类成分的含量比较 [J]. 中国现代应用药学, 2018, 35(11): 1675-1679.
[12] 何慧楠, 唐晓雷, 刘雨霏, 等. 不同加工方法梅花鹿鹿茸中尿嘧啶等五种核苷成分的含量分析 [J]. 时珍国医国药, 2018, 29(10): 2395-2397.
[13] 刘雪莹, 赵雨, 何慧楠, 等. 不同产地梅花鹿鹿茸药材中5种核苷类成分的含量测定及聚类分析 [J]. 中国药房, 2018, 29(14): 1945-1949.
[14] 孙印石, 王燕华, 王玉方, 等. UPLC法测定不同加工方式梅花鹿鹿茸中的核苷类成分 [J]. 中草药, 2018, 49(4): 840-846.
[15] 齐艳萍. 鹿茸对小鼠肿瘤及免疫功能的影响 [J]. 黑龙江八一农垦大学学报, 2012, 24(1): 55-57.
[16] Yang C H, Cai W J, Wen H,. Pilose antler peptide protects osteoblasts from inflammatory and oxidative injury through EGF/EGFR signaling [J]., 2017, 99: 15-20.
[17] 王文龙. 提高免疫力抗疲劳鹿茸片的研究 [D]. 长春: 吉林大学, 2018.
[18] 潘风光, 孙威, 周玉, 等. 梅花鹿鹿茸活性多肽的提取及免疫功效的初步研究 [J]. 中国生物制品学杂志, 2007, 20(9): 669-673.
[19] 罗翔丹, 潘风光, 张铁华, 等. 鹿茸多肽对小鼠耐缺氧和抗疲劳能力的影响 [J]. 食品科学, 2008, 29(4): 386-388.
[20] 周群. 鹿茸多肽对促神经母细胞瘤细胞增殖及抑制其凋亡的相关实验研究 [D]. 长春:长春中医药大学, 2013.
[21] 刘松鑫, 宫瑞泽, 王泽帅, 等. 不同形态梅花鹿鹿茸的化学成分对比研究 [J]. 中草药, 2020, 51(1): 67-75.
[22] 崔曰新, 张景珍, 王思雨, 等. 基于熵权法和灰色关联度法的羌活饮片质量评价研究 [J]. 中草药, 2019, 50(23): 5724-5730.
[23] 姜涛, 施枝江, 姚艺新, 等. 不同品种灵芝多指标的质量评价研究 [J]. 中药材, 2018, 41(12): 2847-2855.
[24] 陈翠莎, 杨丽飞, 刘莎, 等. 基于质量综合评价的积雪草干燥方法筛选研究 [J]. 中草药, 2019, 50(20): 4911-4919.
[25] 扈本荃, 申亚丽, 李金娟, 等. 不同产地马齿苋的质量分析 [J]. 当代化工, 2018, 47(12): 2696-2699.
[26] 王黎, 赵宏光, 刘景煜, 等. 半夏贮藏加工过程中对浸出物的影响 [J]. 中兽医医药杂志, 2018, 37(6): 56-57.
[27] 赵玉红, 张立钢, 张睿. 鹿茸水溶性蛋白质提取条件的优化及组分 [J]. 东北林业大学学报, 2016, 44(7): 120-124.
[28] 姜涛, 施枝江, 陈林明, 等. 基于主成分分析法的枸杞子多元化质量评价研究 [J]. 亚太传统医药, 2018, 14(7): 58-60.
[29] 孙伟杰, 吕程, 杨重晖, 等. 基于指纹图谱和多指标定量测定的鹿茸饮片质量控制研究 [J]. 中草药, 2019, 50(22): 5448-5454.
[30] 刘威, 龚伟, 张嵩, 等. 基于主成分分析和判别分析法对不同品种及规格鹿茸的差异性研究 [J]. 药物分析杂志, 2018, 38(12): 2084-2092.
[31] 刘威, 龚伟, 张嵩, 等. 基于多元统计分析的鹿茸品质评价 [J]. 中国实验方剂学杂志, 2018, 24(14): 57-62.
[32] Westerhuis J A, Hoefsloot H C J, Smit S,. Assessment of PLS-DA cross validation [J]., 2008, 4(1): 81-89.
Establishment of extraction method and quantitative analysis of multicomponents in evaluating differentPantotrichum decoction pieces
LU Yu-shun1, WANG Ze-shuai1, BI Xiao-dong2, XIA Yun-shi1, LU Si2, SUN Yin-shi1
1. Institute of Special Animal and Plant Sciences, China Academy of Agricultural Sciences, Changchun 130112, China 2. Jilin Deer Product Quality Supervision and Inspection Center, Changchun 130600, China
To study the effect of different extraction methods, solvent, material liquid ratio and time on the yield of extract(CCP). To analyze the content of seven chemical constituents (uracil, guanine, hypoxanthine, xanthine, uridine, inosine, and guanosine) from the 60 batches of CCP pieces in 15 habitats, and compare the differences of different parts of CCP pieces (wax slices, powder slices, gauze slices, and bone slices).The CCP extraction method was optimized according to(2015 edition, volume IV), the optimal extraction method of CCP was determined. A total of 60 batches of CCP pieces from different origins were determined by UPLC. Principal component analysis (PCA) and orthogonal partial least squares-discriminant analysis (OPLS-DA) chemometrics were used to distinguish and compare CCP pieces.The water-soluble extract, hot dip method was better than the cold dip method. Water-soluble extracts under hot dip methods could be used to significantly distinguish bone slices with wax slices, powder slices, gauze slices from the same batch of CCP pieces (< 0.05). The total content of seven nucleotides were between 0.95—5.20 mg/g in the decoction pieces of CCP. And uracil, guanine, hypoxanthine, uridine, and guanine were five main components among different parts of CCP pieces by orthogonal partial least squares discriminant analysis (OPLS-DA).The method is simple and efficient for the extraction of CCP. It is suggested that the method of water-soluble extract of CCP and the determination of seven nucleosides and nucleobases should be combined to evaluate the quality of CCP, which can provide scientific basis for further improving the quality standard.
; extract; nucleosides; orthogonal partial least squares-discriminant analysis; quality control; principal component analysis
R283.6
A
0253 - 2670(2021)02 - 0357 - 10
10.7501/j.issn.0253-2670.2021.02.008
2020-08-21
国家重点研发计划(2018YFC 1706604);国家重点研发计划(2018YFC 1706605)
陆雨顺,研究实习员,主要从事特色农产品品质评价研究。E-mail: luyushun@caas.cn
孙印石,研究员,主要从事特种动植物贮藏与产品开发。Tel: (0431)81919580 E-mail: sunyinshi2015@163.com
[责任编辑 郑礼胜]
