补阳还五汤含药血清对TGF-β1诱导的人肺动脉内皮细胞Dll4/Notch4信号的调控作用
2021-01-19渠景连赵惠亮杨邯捷郭永胜
渠景连 赵惠亮 杨邯捷 郭永胜
(贵州中医药大学,贵州贵阳550025)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种病因不明的好发于中老年人群的以刺激性干咳和进行性呼吸困难为主要症状的慢性、进行性、纤维化性间质性肺疾病,其肺功能提示限制性通气功能障碍及弥散功能下降,由于缺乏有效的治疗方法,很多患者在确诊后3至5年内死亡[1-3]。随着人口老龄化,该病发病率越来越高,严重威胁人类健康和生命,因此寻求有效的治疗方法是当前面临的一项极具挑战性的课题。有研究表明,内皮间质转化(endothelial-to-mesenchymal transition,EndMT)是IPF发生发展的重要机制,在这一过程中,包括Dll4/Notch4等在内的Notch信号通路参与了EndMT[4-5]。补阳还五汤是清·王清任《医林改错》中补气活血通络的经典名方,被广泛用于IPF的治疗,且取得了较好的疗效[6-7]。课题组前期研究表明,补阳还五汤能够通过干预EndMT来防治IPF[8],我们推测这一过程与调控Dll4/Notch4信号传导有关。因此,本研究基于血清药理学方法,观察补阳还五汤含药血清对TGF-β1诱导的人肺动脉内皮细胞Dll4/Notch4信号的影响,以期进一步阐明该方防治IPF的作用机制,为临床防治本病提供实验依据。
1 实验材料
1.1 药物 黄芪、当归、赤芍、地龙、川芎、桃仁、西红花均购自贵阳同仁堂药房,经贵州中医药大学药学院孙庆文教授鉴定为正品。
1.2 动物 健康8周龄新西兰兔10只,体重2~2.5 kg,由仪征安立卯生物科技有限公司提供,许可证号SYXK(苏)2016-0005。
1.3 细胞株 HPAEC细胞,由广州吉妮欧生物科技有限公司提供,培养于含10%胎牛血清的RPMI-1640培养基中,常规传代培养。
1.4 主要试剂与仪器 TGF-β1(美国Peprotech公 司,批 号041316-1);RPMI-1640培 养 基,胎牛血清,青霉素/链霉素,胰酶(美国Hyclone公司,批 号 分 别 为AC135526825、AC105264991、AC101511834、AC114002159);DAPT(美国MCE公司,批号11982);Trizol试剂盒,逆转录试剂盒,SYBR®Premix Ex Taq(日本Takara公司,批号分别为AI80403A、RR047A、RR820A);Notch4抗体、Dll4抗体、CBF1抗体、NICD4抗体(英国abcam公 司,批 号 分 别 为GR288351-4、GR162316-12、GR3180240-6、GR288351-4);甘油醛-3-磷酸脱氢酶(GAPDH)抗体(成都正能生物技术有限责任公司,批号HH0607);山羊抗兔辣根过氧化酶(HRP)标记二抗、兔抗山羊HRP标记二抗、山羊抗小鼠HRP标记二抗(美国Affinity公司,批号分别为3825j63、34q9532、1292k61);RIPA蛋 白 裂 解 液,BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号分别为P0013B、P0011);PVDF膜(美国Millipore公司,批号为R8DA5001);免疫共沉淀(Co-IP)试剂盒(美国pierce公司,批号SG251012)。
BSC-03IIA2-SE型生物安全柜(苏州安泰空气技术有限公司);Ts2R型荧光倒置显微镜(日本Nikon公 司);3131型CO2培 养 箱,Multiskan 51119000型酶标仪,NanoDrop 2000紫外分光光度计(美国ThermoFisher公司);Stepone plus荧光定量PCR仪,Veriti PCR热循环仪(美国应用生物系统公司);SDS-PAGE电泳仪,湿法转膜仪(美国Bio-Rad公司);Tanon 5200化学发光图像分析系统(上海天能科技有限公司)。
2 实验方法
2.1 含药血清制备 结合人和动物体表面积折算的等效剂量表(1.5 kg家兔体表面积为70 kg人的0.07倍),根据人的用药量(黄芪120 g,当归6 g,赤芍5 g,地龙3 g,川芎3 g,桃仁3 g,红花3 g)计算家兔等效剂量,得到补阳还五汤的家兔等效剂量为6.67 g/(kg·d)。结合动物数量及实验中的损失,估算出所需总药量,一次煎煮出所需药液,4 ℃保存备用。健康新西兰兔适应性喂养3 d后随机分为补阳还五汤组和空白对照组。补阳还五汤组灌胃给予家兔等效剂量8倍的药物[53.36 g/(kg·d)],空白对照组给予等容积生理盐水,连续给药3 d。末次给药1 h后麻醉状态下颈动脉取血,常温下分离血清,56 ℃水浴灭活,0.22 µm过滤除菌,-80 ℃保存备用。
2.2 EndMT模型制备 将HPAEC细胞种于六孔板中,待细胞长至80%~90%融合度时,去除完全培养基,加入0.5% FBS的1640培养基同步24 h,使细胞处于同一生长周期,然后加TGF-β1(5 mg/L)刺激细胞72 h后观察细胞形态变化,当细胞形态由铺路石样向梭形转化,细胞间连接减少,且细胞间隙变大时,提示EndMT发生,细胞模型制备成功。
2.3 分组 实验分为空白组(10%空白血清)、模型组(10%空白血清+TGF-β1)、DAPT组(10%空白血清+DAPT+TGF-β1)、10%含药血清组(10%含药血清+TGF-β1)、5%含药血清组(5%含药血清+5%空白血清+TGF-β1)和2.5%含药血清组(2.5%含药血清+7.5%空白血清+TGF-β1)。其中TGF-β1浓度均为5 mg/L,DAPT浓度为0.5 µmol/L。
2.4 RT-PCR试验 细胞经同步化培养24 h后,按上述方法造模、给药,培养72 h后收集细 胞,用Trizol法 提 取 细 胞 总RNA。Nanodrop检测浓度,RNA纯度根据Nanodrop检测的浓度和OD230、OD260、OD280决 定。 参 照 逆 转 录 试 剂盒说明书进行逆转录试验,引物由通用生物系统(安徽)有限公司设计合成。Notch4上游引物:5'-AGTGGTGTGAGGTGGAGATA-3',Notch4下 游 引物:5'-GGGCAGTGGCAGATGAAA-3';Dll4上 游 引物:5'-ACGAATGCATCCCCCACAAT-3',Dll4下游引物:5'-ACAGGTGCAGGTGTAGCTTC-3';CBF1上游 引 物:5'-TCATGCCAGTTCACAGCAGT-3',CBF1下 游 引 物:5'-GGAGTGCCATGCCAGTAACT-3';GAPDH上 游 引 物:5'-CAGGGCTGCTTTTAACTCT GGTAA-3',GAPDH下 游 引 物:5'-GGGTGGAATCA TATTGGAACATGT-3'。PCR反 应 体 系:cDNA模板2 µL,SYBR Green solution 10 µL, 上 游 引物(10 µmol/L)0.4 µL,下游 引物(10 µmol/L)0.4 µL,无菌双蒸水7.2 µL,配制成20 µL的反应标准体系。反应条件:酶激活95 ℃,10 min;95 ℃变性5 s,60 ℃退火、延伸1 min,采集荧光信息,扩增40个循环;95 ℃,10 s,溶解曲线60~95 ℃,采集Tm值信息,可以通过Tm值是否单一判断产物是否为特异性扩增。使用软件分析PCR过程中各检测样本的Ct值,通过2-ΔΔCt计算mRNA相对表达量。
2.5 Western blot试验 细胞经同步化培养24 h后,按上述方法造模、给药,培养72 h后收集细胞,加入RIPA裂解液和PMSF蛋白酶抑制剂,4 ℃裂解15 min,13 500 g离心15 min,收集上清液,取少量进行蛋白定量,根据所测浓度加入上样缓冲液,95 ℃水浴5 min,保存于-20 ℃待用。配制分离胶和浓缩胶,将已加入上样缓冲液的标准蛋白质样品及待测样品加入样品槽内,100 V恒压电泳约60 min,当溴酚蓝到达分离胶的底部,关闭电源。100 V,60 min,4 ℃转膜,5%脱脂奶粉室温轻摇封闭60 min。将一抗用含5% BSA的TBST溶液按照1∶1000稀释,4 ℃孵育过夜。TBST洗膜3次,每次10 min。将二抗用TBST按照1∶5000稀释,室温下孵育2 h,取出PVDF膜,TBST洗膜3次,每次10 min。Tanon凝胶成像系统成像,Image J软件进行图片分析。
2.6 免疫共沉淀(Co-IP)试验 细胞经同步化培养24 h后,按上述方法造模、给药,培养72 h后收集细胞,提取蛋白样本,每个试验样本体积为500 µL,每个样本留取30 µL作为试验input。准备protein A/G beads,每500 µL蛋 白 样 品 液 加 入500 µL protein A/G beads,4 ℃缓慢垂直旋转10 min,以去除和bead非特异性结合的蛋白,降低背景,4 ℃、5000 g离心30 s,将上清转移至一个新的离心管中,去除protein A/G beads。每孔加入5 µg抗体,4 ℃,垂直旋转混匀缓慢旋转孵育过夜。加入50 µL的protein A/G beads(含50%浓度)到每个蛋白样品液中,4 ℃缓慢摇动4~6 h,使beads与抗体进行结合。4 ℃、5000 g离心30 s,收集bead-抗原抗体复合物,弃上清,用预冷的wash buffer洗3次,1 mL/次,每次4 ℃缓慢垂直旋转15 min。用50 µL的2×上样缓冲液将bead-抗原抗体复合体重悬,轻轻混匀,100 ℃煮10 min,以分离抗原、抗体和bead,常 温13 000 g离 心1 min,收 集 上 清,IP和input样 本 进 行SDS-PAGE电泳。
3 实验结果
3.1 各组HPAEC细胞Notch4、Dll4和CBF1 mRNA表达比较 见表1。
3.2 各组HPAEC细胞Notch4、Dll4和CBF1蛋白表达比较 见表2,图1。
3.3 各组HPAEC细胞NICD4与CBF1结合情况比较 由Co-IP结果可知,NICD4和CBF1有结合作用,TGF-β1能促进二者的结合,提示EndMT发生时Dll4/Notch4信号被激活,而阻断Notch信号通路后NICD4和CBF1结合被抑制,补阳还五汤含药血清能抑制NICD4和CBF1结合,且随着补阳还五汤含药血清浓度增加,NICD4和CBF1结合作用降低。见图2。
表1 各组HPAEC细胞Notch4、Dll4和CBF1 mRNA表达比较()
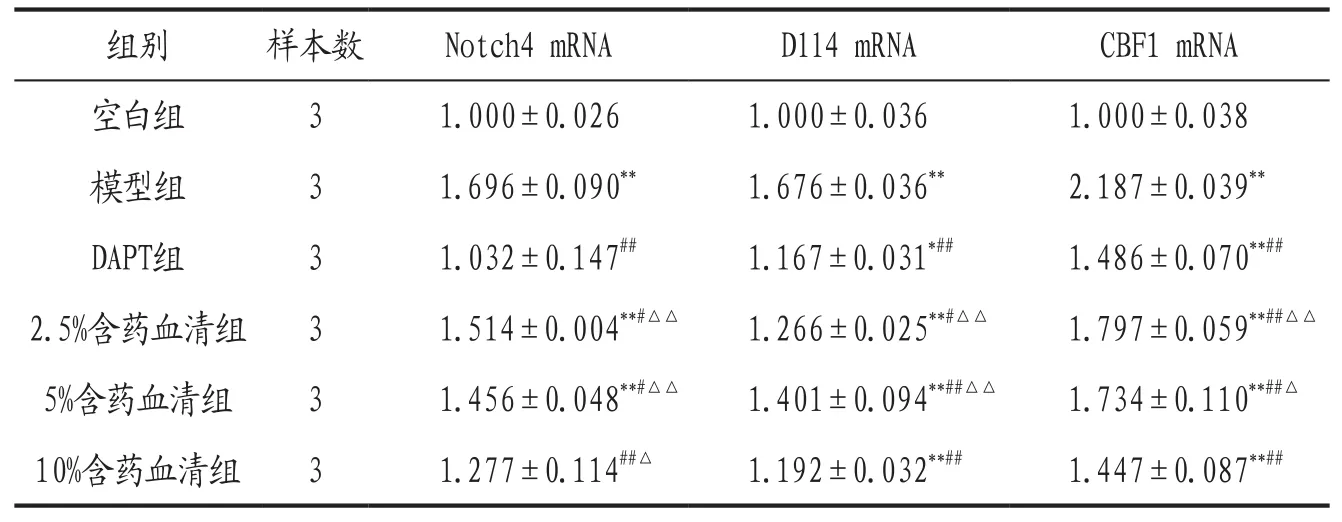
表1 各组HPAEC细胞Notch4、Dll4和CBF1 mRNA表达比较()
注: 与空白组比较,*P<0.05,**P<0.01 ;与模型组比较,#P<0.05,##P<0.01 ;与DAPT组比较,△P<0.05,△△P<0.01。
组别 样本数 Notch4 mRNA Dll4 mRNA CBF1 mRNA空白组 3 1.000±0.026 1.000±0.036 1.000±0.038模型组 3 1.696±0.090** 1.676±0.036** 2.187±0.039**DAPT组 3 1.032±0.147## 1.167±0.031*## 1.486±0.070**##2.5%含药血清组 3 1.514±0.004**#△△ 1.266±0.025**#△△ 1.797±0.059**##△△5%含药血清组 3 1.456±0.048**#△△ 1.401±0.094**##△△ 1.734±0.110**##△10%含药血清组 3 1.277±0.114##△ 1.192±0.032**## 1.447±0.087**##
表2 各组HPAEC细胞Notch4、Dll4和CBF1蛋白表达比较()
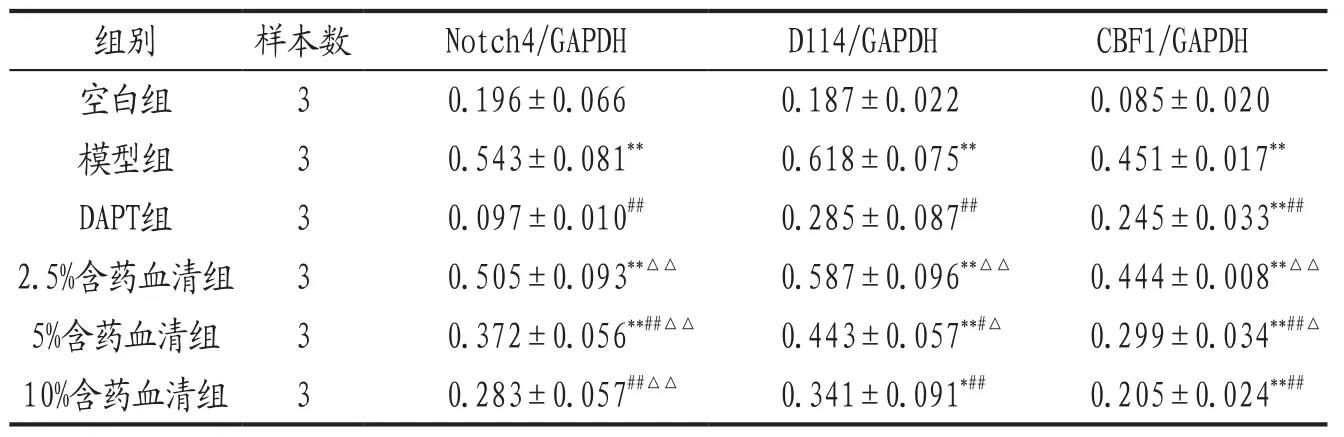
表2 各组HPAEC细胞Notch4、Dll4和CBF1蛋白表达比较()
注: 与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01 ;与DAPT组比较,△P<0.05,△△P<0.01。
组别 样本数 Notch4/GAPDH Dll4/GAPDH CBF1/GAPDH空白组 3 0.196±0.066 0.187±0.022 0.085±0.020模型组 3 0.543±0.081** 0.618±0.075** 0.451±0.017**DAPT组 3 0.097±0.010## 0.285±0.087## 0.245±0.033**##2.5%含药血清组 3 0.505±0.093**△△ 0.587±0.096**△△ 0.444±0.008**△△5%含药血清组 3 0.372±0.056**##△△ 0.443±0.057**#△ 0.299±0.034**##△10%含药血清组 3 0.283±0.057##△△ 0.341±0.091*## 0.205±0.024**##
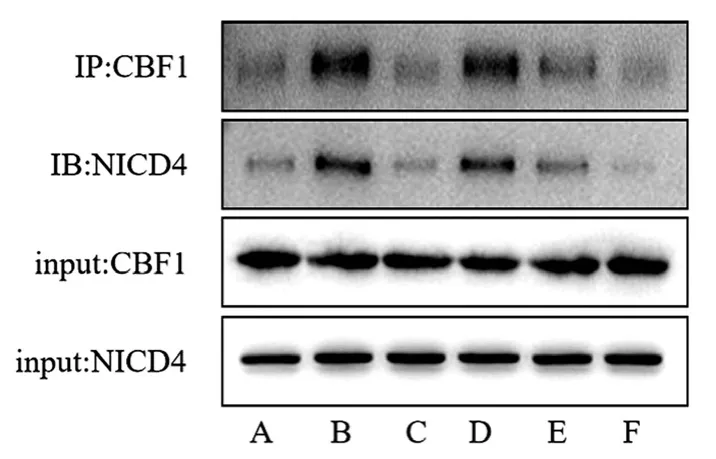
图1 各组HPAEC细胞Notch4、Dll4、CBF1蛋白表达

图2 各组HPAEC细胞NICD4与CBF1结合情况
4 讨论
IPF是最常见、最具侵袭性的肺泡疾病,正常的肺泡结构逐渐消失,进而被纤维化组织所取代,其主要特征是成纤维细胞增殖和细胞外基质过度沉积。如前所述,EndMT是肺部发生纤维化的机制之一,即内皮细胞在各种刺激因素的作用下向间质细胞转化。TGF-β1是调控纤维化EndMT的关键细胞因子,可以诱导EndMT的发生,肺血管内皮细胞可以通过EndMT而形成肺成纤维细胞[9]。因此本研究采用TGF-β1诱导HPAEC细胞发生间质转化建立EndMT细胞模型。
Notch信号通路是在进化上高度保守的单次跨膜信号受体蛋白家族,在哺乳动物体内由Notch受体(Notch1-Notch4)、Notch配体(Dll1、Dll3、Dll4,Jagged 1和Jagged 2)和转录因子CBF1/RBP-Jκ组成[10]。Notch配体和特定受体的结合激活Notch信号,Notch蛋白经过γ-secretase剪切释放其胞内段NICD,此为Notch受体的活性形式,NICD进一步被转运至细胞核内,与转录因子CBF1/RBP-Jκ结合,进而激活下游靶基因的转录[11],使用γ-secretase抑制剂DAPT可抑制Notch信号通路的激活。内皮细胞中激活的Notch信号可导致形态学、表型和功能改变,并诱导EndMT发生[12-13]。Notch4受体作为Notch家族的一员,是血管内皮细胞的特异性受体,Dll4也主要分布于血管内皮细胞,是一种重要的血管生长发育调节因子,通过与邻近细胞上的Notch1、Notch4等受体结合而启动细胞内信号传递,从而影响细胞增殖、迁移,参与血管重塑[14]。在成人期的血管环境中,Dll4下调了内皮细胞的增殖、分化和迁移能力,阻碍了血管发生[15]。CBF1是Notch4信号通路的下游信号分子,也是重要的转录调节因子,参与Dll4/Notch4信号的激活。我们前期研究表明,当大鼠发生肺纤维化时,Dll4/Notch4信号传导被激活[16],本研究结果显示,经TGF-β1诱导后,HPAEC细胞的Notch4、Dll4和CBF1的mRNA和蛋白表达均上调,且Notch4的活性形式NICD4与CBF1有结合作用,说明EndMT发生时Dll4/Notch4信号传导激活,而使用DAPT干预后可抑制Dll4/Notch4信号传导激活,Dll4/Notch4信号的激活抑制了内皮细胞的增殖,这可能加剧了间质转化的发生。
IPF是一种以咳嗽、气短、乏力等为主症的难治性疾病,发病多因肺气亏虚、肺络瘀滞,在病变发展过程中,二者又相互影响。肺气亏虚,无力布津行血,则血行缓慢,停留而为瘀,进而阻滞肺络;肺络瘀滞,治节无权则气血津液难以上行养肺,以致肺体失养,气机不利,甚至瘀久生毒,肺气受损更为严重[8]。总而言之,肺虚络阻是本病的主要病机,治疗当益气活血通络。补阳还五汤是益气活血通络的经典名方,方中重用补气药,并配以少量活血通络之品,使气旺血行以治本,瘀消络通以治标,标本兼顾。本研究结果表明,补阳还五汤含药血清可抑制TGF-β1诱导的HPAEC细胞的Notch4、Dll4和CBF1的mRNA及蛋白表达,且可以抑制NICD4与CBF1的结合,可见补阳还五汤干预EndMT防治肺纤维化的作用机制与调控Dll4/Notch4信号传导有关,但其具体靶点和机制还有待后续进一步确认。此外,本研究结果还显示,2.5%、5%补阳还五汤含药血清组HPAEC细胞Notch4、Dll4和CBF1 mRNA及蛋白表达均显著高于DAPT组,而10%含药血清组除Notch4 mRNA及蛋白表达显著高于DAPT组外,Dll4和CBF1 mRNA及蛋白表达与DAPT组比较差异无统计学意义,且补阳还五汤含药血清和DAPT均能抑制NICD4和CBF1结合,随着补阳还五汤含药血清浓度增加,NICD4和CBF1结合作用降低。提示10%补阳还五汤含药血清调控Dll4/Notch4信号传导干预EndMT的作用与DAPT相当,且补阳还五汤还具有多靶点、多途径的调控作用,在IPF的防治中显示出越来越多的优势。由于本研究只观察了Dll4/Notch4信号传导,是否还和其他信号通路存在交叉作用,将是我们下一步研究的方向。
