COVID-19与白细胞介素的研究进展
2021-01-19张致英刘丽军赵志鹏康龙丽
陈 辉,张致英,李 靖,刘丽军,赵志鹏,康龙丽
(1. 西藏民族大学高原病分子机制与干预研究省级重点实验室;2. 西藏民族大学环境与疾病相关基因研究高校重点实验室,陕西 咸阳 712082)
COVID-19是由SARS-CoV-2引起的新型呼吸道疾病,于2019 年12 月首次被报道。SARS-CoV-2 属于冠状病毒家族,是一种正链RNA 病毒,呈球形,具有典型的“冠状”外观[1],经鉴定为此前未知的β-冠状病毒[2],可引起上呼吸道感染症状,特别是对于易感人群(如老人、体质弱者)可以导致严重感染,如严重的支气管炎和肺炎[3]。除此之外,SARS-CoV-2感染还可出现发烧、乏力和干咳等症状,严重情况下可出现急性呼吸综合征和肾衰竭[1]。COVID-19的暴发给全世界人民的生命健康带来了严峻挑战。当前,COVID-19 的发病机制尚不明确,也没有完全有效的治疗方法。据报道,部分COVID-19 患者会出现细胞因子风暴,本文就白介素与COVID-19 的发生、发展与防治关系进行综述。
1 细胞因子风暴
在冠状病毒感染过程中,炎性细胞因子具有双重作用:一方面,它们可以有效刺激免疫反应的激活,使机体积极对抗外来入侵的病毒;另一方面,它们会介导放大全身炎症的发展,导致免疫功能反应失调,引起细胞因子风暴,但这一反应既对病原体无效,又对身体有害,最终还导致急性呼吸窘迫综合征(ARDS),并有可能导致患者死亡的事件发生[4]。
COVID-19 患者发病后7~10 天是免疫失调的时间窗,此时正是细胞因子风暴肆虐和呼吸窘迫高峰期。通过对患者入院时的血清细胞因子水平和淋巴细胞成分的分析可以发现,存在IL-6、IL-10 和肿瘤坏死因子-α(TNF-α)过度产生,CD4+和CD8+T 淋巴细胞减少以及CD4+T 细胞干扰素-γ(IFN-γ)表达水平降低的情况,它们与冠状病毒导致的病情严重程度有重要联系[2]。大多数细胞因子,如IL-6、TNF-α将进一步促进炎症反应的发展,使机体出现强免疫反应,进而可能导致免疫反应失控,从而使免疫细胞及其信号分子的过度产生,引起细胞因子风暴[5]。有学者认为,细胞因子风暴可能是大量免疫细胞涌入肺部,通过加重肺部病理改变、T 细胞耗竭和CD4+T 细胞功能障碍,造成淋巴细胞减少和间质性肺炎,来诱导ARDS 和继发性噬血细胞性淋巴组织细胞增多症(secondary hemophagocytic lymphohistio⁃cytosis,sHLH)[6]。
2 白细胞介素
有研究表明,COVID-19患者血浆中多种细胞因子成分发生变化,而这一变化与多种IL 有关。HUANG C 等[7]的研究发现,感染SARS-CoV-2 的患者血浆中IL-1β、IL-1RA、IL-7、IL-8、IL-9、IL-10、成纤维细胞生长因子(FGF)、巨噬细胞集落刺激因子(M-CSF)、IFN-γ、干扰素γ 诱导蛋白(IP10)、单核细胞趋化蛋白(MCP1)、巨噬细胞炎症蛋白(MIP1)、血小板衍生因子(PDGF)、TNF-α和血管内皮生长因子(VEGF)等指标均高于健康成人。通过比较重症与轻症患者的血浆细胞因子水平,可发现更多有效信息。MICHOT JM[8]和DI MAURO GABRIELLA[1]等研究发现,入住重症监护病房(ICU)的患者血浆细胞因子IL-2、IL-7、IL-10、IP10、MCP1、TNF-α 水平较高,提示COVID-19 引起的细胞因子风暴很可能与这些细胞因子有关,SARS-CoV-2诱导的细胞因子风暴与疾病的严重程度和转归有关。CONTI P 等[3]也有相似的发现,COVID-19 患者血液检测提示IL-6、铁蛋白和中性粒细胞数目异常高,而与凝血功能下降相关的淋巴细胞和血小板数量显著减少。研究报道,患者感染SARS-CoV-2 期间,机体会过度激活巨噬细胞和单核细胞,造成免疫反应失去控制,产生过多的细胞因子。总体来说,免疫反应导致中性粒细胞、IL-6 和C-反应蛋白(CRP)增加,淋巴细胞总数减少[9],说明细胞因子风暴(特别是IL)与COVID-19的病情程度相关。
SARS-CoV-2感染单核细胞、巨噬细胞和树突状细胞[6],一旦进入细胞,病毒RNA 就被模式识别受体(PRR)检测到,这些受体触发下游的分子级联反应,导致转录因子NF-κB 和干扰素调节因子3(IRF3)的激活,随后产生Ⅰ型干扰素和一系列炎性细胞因子,特别是IL-6和IL-1β[10]。
2.1 IL-6IL-6 是一种调节体液和细胞反应的多功能细胞因子,在感染和退行性疾病(动脉粥样硬化、癌症)的炎症和组织损伤中发挥关键作用。IL-6通过与受体复合物IL-6Rb(也称为gp130)相互作用,将IL-6效应传导至细胞内[11]。然而,IL-6介导的炎症反应可能驱动感染造成不良影响[10]。
CHEN X 等[12]通过检测COVID-19 患者的血清,发现约15%的患者血清中存在SARS-CoV-2 病毒RNA(RNA血症),并且RNA血症仅在危重患者中被诊断,而危重患者IL-6 水平急剧升高,几乎是轻型患者的10 倍,所有死亡患者的IL-6 水平均极高,提示高水平IL-6 与RNA 血症的发生率和病死率密切相关。IL-6 水平是细胞因子风暴的一个标志和重要的驱动力,是主要炎性因子之一,它可能导致危重患者的多器官功能障碍,因此IL-6 可作为评估COVID-19严重程度的生物标志物。
值得注意的是,部分感染SARS-CoV-2 的患者发展为帕金森综合征,他们大多受到与持续高水平IL-6 相关的一些共病(包括高血压、心血管疾病、癌症、慢性肾功能衰竭等)的影响。BIZZARRI M 等[11]推测,SARS-CoV-2感染可以进一步加剧IL-6高水平患者继续释放IL-6,从而导致细胞因子风暴的发生。炎症风暴可能导致肺泡-毛细血管血气交换功能障碍[8],引起一系列相关症状。
2.2 IL-1IL-1 是一种多效性细胞因子,在不同的生物学过程中发挥作用,主要参与炎症、免疫和造血等功能。IL-1R1 与IL-1α 和IL-1β 结合,使其能够招募共同受体IL-1R3,形成三聚体信号复合物,这些过程导致MyD88 的募集和磷酸化的激活,从而通过促炎途径,诱导产生其他细胞因子,放大包括冠状病毒在内的许多疾病的炎症状态[3]。白细胞介素-1 前体α(ProIL-1α)在多种组织细胞中组成性表达,在应激或炎症时表达增加,IL-1RA 基因多态性与炎性细胞因子的表型—基因型相关,其引起的细胞因子水平变化与严重社区获得性肺炎(CAP)的不良结局有关[13]。IL-1β 主要由炎症刺激下的髓系细胞产生,进一步诱导其他炎性细胞因子(如TNF-α和IL-6)的表达,IL-1β 在呼吸道病毒感染过程中上调,其分泌本身可能与高细胞因子血症有关[14]。
COVID-19 患者存在高水平的IL-1β、IL-1RA 和TNF-α,IL-1 可诱导产生一种强有力的促炎性和促凋亡蛋白TNF,TNF 进而促进炎症的启动和扩大,TNF和IL-1能够在病毒感染性疾病(如冠状病毒)中诱导炎性细胞因子IL-6 高表达,除了执行炎症功能外,TNF还与IL-1共享信号通路[3]。
2.3 其他ILIL-2 也被称为T 细胞生长因子,是T细胞增殖、分化和活化所必需的。SHI H 等[15]通过研究发现,部分重症患者IL-2 较普通患者升高,而当病情进展为危重症时,IL-2水平呈下降趋势,推测CD8+T 细胞减少可能与IL-2 信号通路有关。危重患者IL-2/IL-2R 的抑制通过JAK1-STAT5 途径引起CD8+T 细胞和淋巴细胞减少。血浆IL-2 进行性下降可能是COVID-19患者肺炎病情恶化的预警因素。
除了导致免疫反应加剧的IL产生,也有如IL-10等对细胞因子活化起抑制作用的IL 产生,可能是机体对体内过多的细胞因子做出的有益反馈。研究数据表明,危重组血清IL-10 水平明显高于中、重度组,进行Spearman 等级相关分析发现CRP 与IL-10呈显著正相关[5]。高水平的外源性IL-10 促进CD8+T细胞的细胞毒作用,而中等水平的内源性IL-10则诱导肿瘤中CD8+T细胞的耗竭,由于IL-10可以抑制IL-2 的分泌,并且对CD8+T 细胞的激活具有异质性,因此推测IL-10可能通过IL-2途径参与T 细胞的激活[15]。IL-10 可作为疾病恶化风险较高的患者快速诊断的预测指标。
与大多数的研究不同的是,LUO W 等[16]通过观察25例好转出院的重症患者细胞因子变化情况,发现这些患者IL-2、IL-4、TNF-α、IFN-γ 和CRP 并不显著升高,仅部分患者IL-6、IL-10 水平超过参考值。同样,HAN H等[5]的研究发现,重症患者与普通患者的IFN-γ、IL-4 差异无显著性,且IL-2 和TNF-α 的表达则不随病情加重而增加。可能是由于重症患者病情得到控制,没有进展为危重症,也可能是每个人的免疫系统反应机制的区别,因此应检测循环炎性细胞因子的水平,使后续抗炎治疗更加精确。归纳COVID-19与IL的关系如下(见图1)。
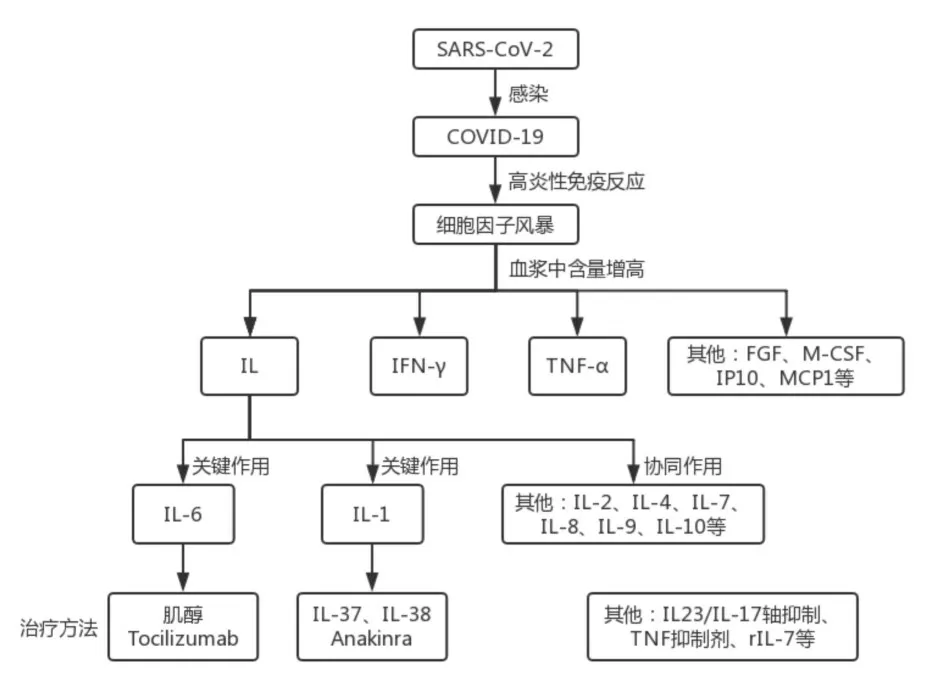
图1 COVID-19与IL关系图
3 治疗前景
严重COVID-19 患者可能会出现细胞因子风暴综合征,因此下调免疫功能被认为是有益的治疗方法[11]。为了消除导致COVID-19 患者功能障碍的高炎性免疫反应,目前有多种免疫调节药物正在进行临床试验。然而,任何减轻炎症的干预措施都可能对病毒清除产生负面影响,不适当的消炎治疗对机体反而是有害的[16]。在治疗过程中,需要充分考虑细胞因子水平与病情的变化情况,减少炎症相关的肺损伤。尽管IL-6 和IL-1β 在细胞因子风暴综合征中均升高,然而并不清楚这两种IL 产生的因果关系,降低单一IL 或是联合降低治疗的效果尚不清楚[17]。IL-6和IL-1以及其他靶向治疗的研究仍在进行中。
3.1 IL-6 受体拮抗剂由于IL-6 升高可能造成更大程度的细胞因子风暴,导致预后不良,因此IL-6可能是具有过度炎症反应的危重患者的潜在治疗靶点,用单克隆抗体阻断IL-6 的特异性受体来抑制IL-6被认为是一种有希望的尝试[12]。
针对IL-6的单克隆抗体或能够下调IL-6的药物可能有效地阻断炎性风暴,成为治疗重症COVID-19的潜在药物。肌醇(myo-inositol)可以降低IL-6 水平,减轻炎症级联反应,目前没有发现其存在明显的不良反应,如BIZZARRI M 等[11]的研究表明IL-6是肌醇的一个主要靶点,肌醇对肺功能的化学保护作用直接与IL-6 的下调和微环境免疫反应的调节有关。
对IL-6受体拮抗剂,特别是托珠单抗(tocilizumab)的临床研究表明,使用其他非IL-6 定向的生物疗法通常导致严重感染的发生率增加[11]。Tocilizumab是一种单克隆抗体,可以抑制IL-6 与可溶性受体特异性结合,抑制信号转导,最近在中国被批准用于减少SARS-CoV-2感染患者的肺部并发症[1]。MICHOT JM等[8]报告一例与冠状病毒相关的呼吸衰竭患者,在接受注射Tocilizumab 治疗后迅速获得良好的效果。这表明,IL-6 受体拮抗剂可以通过减轻冠状病毒在肺部的细胞因子风暴来降低进展为重症肺炎的风险。
IL-6 受体拮抗剂可以抑制顺式和反式信号,有效改善重症COVID-19 患者病情,从而最大限度地降低对重症监护的需求,但从长远来看,还是需要开发IL-6受体拮抗剂相关的抗病毒药品和疫苗[6]。
3.2 IL-1 受体拮抗剂IL-37 属于IL-1 家族成员,是一种具有炎症抑制作用的细胞因子。IL-37 蛋白由健康人的单核细胞表达,也由人巨噬细胞、B 细胞、浆细胞、T 细胞和肿瘤细胞表达。IL-37 缺陷的受试者更容易患炎症性疾病,IL-1 的抑制可以通过使用IL-37来实现。IL-37信号通过抑制磷酸化和炎症抑制mTOR 的激活。在病毒感染中,IL-37 与炎症反应有关,并随疾病严重程度的增加而增加,抑制促炎的IL-1 家族成员和IL-6,但另一方面,IL-37 也会导致不必要的免疫抑制。IL-38也是具有抗炎特性的IL-1 家族成员,IL-38是与IL-1相关的炎性细胞因子的抑制剂,能抑制病毒感染,如SARS-CoV-2诱导的IL-6[3]。
由于IL-1 是SARS-CoV-2 诱导的肺部炎症和纤维化的重要介质,抑制这种高度促炎的细胞因子可能具有重要的治疗价值。临床应用中,使用阻断IL-1受体的药物(如阿那白滞素,Anakinra)治疗微生物感染的患者可以有更高的存活率[3]。
Anakinra 是一种重组IL-1 受体拮抗剂,被许多儿科风湿科医生视为治疗MAS/sHLH 的一线药物。一项关于Anakinra 在有冷卟啉相关周期性综合征(CAPS)的儿童和成人中的长期安全性的研究,在感染期间继续进行Anakinra治疗,可以预防疾病爆发,而不会使感染过程复杂化[17]。Anakinra 在冠状病毒相关的sHLH 表现中也十分活跃。AOUBA A 等[18]通过病例研究发现,尽管使用Anakinra 的患者CRP水平没有像自体炎症疾病中观察到的那样显著下降,但通过作用于炎症小体诱导的炎症信号通路的上游,Anakinra很可能会强烈地阻断细胞因子风暴。严重的新冠肺炎可导致化疗免疫治疗后血液病患者出现危及生命的高炎综合征。JAMES W DAY等[19]通过对3 例患者使用Anakinra 治疗,表明在新冠肺炎和急性白血病患者中筛查高炎症状态的重要性,提供了进一步的证据证明这种药物在临床背景下的有效性,并支持对这一表型的患者使用免疫调节剂,以改善高炎性COVID-19 患者的预后。因此抗IL-1 治疗可能有助于平息这场风暴,并可能防止进展为呼吸衰竭,应该鼓励建立循证治疗方案,用前瞻性对照研究来确认IL-1 拮抗剂的最佳治疗剂量。
3.3 其他可能的免疫治疗方法MESSINA F 等[4]描述了一例接受生物疗法的银屑病患者冠状病毒感染的病例,此病例的结果提示IL-23/IL-17 轴抑制在冠状病毒感染的背景下可能有一定效果,因此,可研究IL-23/IL-17轴抑制对SARS-CoV-2的有效机制。
TNF 是病毒感染的免疫反应介质,TNF-α 具有很强的抗轮状病毒作用,其抗轮状病毒作用是由NF-κB调控的基因通过激活经典的NF-κB信号实现的,并且不依赖于Ⅰ型干扰素的产生[13],但却会导致炎症反应的加剧。抑制TNF 后可减轻炎症反应,但在SARS-CoV-2 感染的患者中贸然使用TNF 抑制剂可能会促进病毒的重新激活。因此,抗肿瘤坏死因子疗法会增加许多感染的潜在风险,因为参与对抗病毒疾病(包括由SARS-CoV-2 诱导的疾病)的免疫系统受到了抑制[3]。有必要权衡TNF 对免疫系统功效的影响,探索TNF 家族配体作为病毒疫苗佐剂的效果,慎重使用TNF抑制剂。
IL-7 能增强淋巴细胞分泌,作为逆转T 细胞耗竭的细胞因子在恢复免疫系统内稳态方面可能是有用的。IL-7 发挥抗凋亡特性,诱导T 细胞有效增殖,增加T 细胞受体谱系的多样性,改善T 细胞运输至感染部位的能力,对机体抵抗病毒有积极效果。重组白细胞介素-7(rIL-7)不会通过刺激获得性免疫而导致高炎性反应的发生,且rIL-7用于治疗感染性休克后的T 细胞衰竭和恢复艾滋病患者的CD4+T 细胞时,没有出现促炎性标志物(TNF-α、IL-6、CRP)及临床恶化的不良后果,需要实验来评估rIL-7 对COVID-19的治疗效果[14]。
综上所述,IL 参与了COVID-19 造成的细胞因子风暴,且与冠状病毒疾病的严重程度密切相关。IL-6 和IL-1 很可能是细胞因子风暴的关键细胞因子,针对白细胞介素受体的靶向治疗有一定效果,且有多种其他免疫治疗方法正在积极尝试,用于抑制体内细胞因子的产生,以改善COVID-19患者的病情。我们需要认识到,虽然IL-6和IL-1与COVID-19关系密切,但可能存在细胞因子共同作用造成的影响,后续需进一步实验性研究来探明。随着对COVID-19 研究深入,SARS-CoV-2 引起的免疫途径一定会更加清晰,针对不同病情的抗炎药物也有希望被研发并用于个性化治疗。
