超声造影定性及定量分析鉴别乳腺良恶性非肿块型病变
2021-01-18吴兰英
徐 平,杨 敏,刘 勇,张 红,吴兰英
(首都医科大学附属北京世纪坛医院超声科,北京 100038)
乳腺非肿块型病变(non-mass lesions, NML)[1]指超声声像图未显示明确边界、且在2个以上不同切面上不具备空间占位效应的病变,约占全部乳腺病变的10%,常规超声诊断特异度低[2]。近年来超声造影(contrast-enhanced ultrasound, CEUS)用于诊断乳腺病变,可为鉴别良恶性病变提供重要依据[3-5],但观察乳腺NML的CEUS研究较少。本研究探讨CEUS定性及定量分析鉴别乳腺良恶性NML的价值。
1 资料与方法
1.1 一般资料 回顾性分析2019年1月—2020年1月57例于首都医科大学附属北京世纪坛医院就诊的乳腺NML患者,均为女性,年龄23~65岁,平均(42.2±9.9)岁。纳入标准:①灰阶超声表现符合乳腺NML标准;②接受CEUS检查;③具备病理学诊断结果;④临床及影像学资料完整。排除图像质量欠佳者。
1.2 仪器与方法 采用迈瑞Resona7彩色多普勒诊断仪,L11-3U探头,频率3~11 MHz,MI 0.07~0.08,帧频10帧/秒。造影剂为SonoVue,以5 ml生理盐水稀释振荡产生微气泡后,抽取4.8 ml经肘静脉团注。观察显示乳腺血流最丰富或有明显粗大血管的切面,期间探头避免施压。
1.3 图像分析 由具有10年以上乳腺超声诊断经验的副主任医师及主治医师各1名共同分析图像,经讨论得出结论。
1.3.1 定性分析参数 ①以周围正常乳腺组织为参照判定病灶增强时间(早于、晚于或同步)、增强程度(高增强、等-低增强)及消退时间(晚于、早于或同步);②增强顺序(向心性、非向心性)、增强均质性(均匀、不均匀);③病变范围(扩大、无扩大),即病变增强达峰后病变范围相比二维超声范围有无扩大;④周边血管(有、无),包括放射状灌注和穿入灌注,放射状灌注定义为至少2个不同方向的血管样灌注从病灶外汇集于病变边缘,穿入灌注定义为1支或多支粗大血管从同一方向自病灶边缘穿入病灶。
1.3.2 定量分析参数 在增强强度最高部位选取直径约2 mm圆形ROI,绘制时间-强度曲线,记录造影剂到达时间(arrival time, AT)、达峰时间(time to peak, TTP)、峰值强度(peak intensity, PI)、曲线下面积(area under the curve, AUC)及平均通过时间(mean transit time, MTT)。
1.4 统计学分析 采用SPSS 22.0统计分析软件。以频数或百分比表示CEUS定性指标,以χ2检验进行组间比较;以±s表示定量指标,采用t检验进行组间比较。使用BinaryLogistic过程对定性分析、定量分析及二者联合分析结果进行Logistic回归向前逐步分析,得出3种Logistic回归方程,获取新变量后,以受试者工作特征(receiver operating characteristic, ROC)曲线分析诊断效能。P<0.05为差异有统计学意义。
2 结果
57例乳腺NML中,经病理确诊良性病变31例(良性组),包括18例腺病、5例导管内乳头状瘤、3例硬化性腺病、2例浆细胞性乳腺炎及血管平滑肌错构瘤、导管上皮柱状细胞病变及导管上皮不典型增生各1例;恶性病变26例(恶性组),其中导管内癌16例,浸润性导管癌8例,浸润性小叶癌、黏液癌各1例。
2.1 CEUS定性及定量参数比较 乳腺良性与恶性NML的增强强度、病变范围、周边血管及PI、AUC和MTT差异有均统计学意义(P均<0.05),见表1、2及图1、2。
2.2 定性、定量分析及二者联合分析的Logistic回归分析结果 将表1、2中差异有统计学意义的指标纳入多因素分析,结果显示定性分析中的增强强度、病变范围,定量分析中PI、AUC以及二者联合分析中的病变范围、PI均为鉴别乳腺良恶性NMLs的独立因子(P均<0.05),见表3。将上述独立因子纳入回归方程,得到3个回归方程,即定性分析回归方程:P=1/[1+e-(1.188+0.882X1+0.891X2)],其中X1为增强强度,X2为病变范围;定量分析回归方程:P=1/[1+e-(0.322+0.09Y1+0.034Y2)],其中Y1为PI,Y2为AUC;联合分析回归方程:P=1/[1+e-(-1.466+0.901X2+0.101Y1)]。
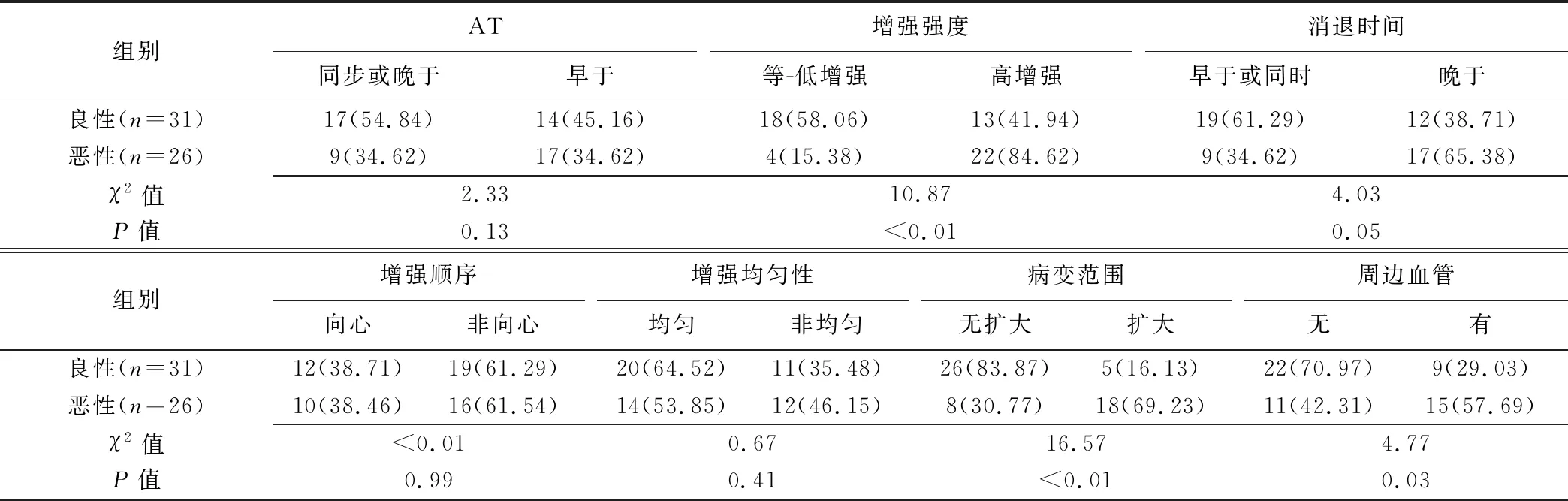
表1 乳腺良恶性NML的CEUS定性指标比较[个(%)]
表2 良恶性乳腺NML的CEUS定量指标比较(±s)

表2 良恶性乳腺NML的CEUS定量指标比较(±s)
组别AT(s)TTP(s)PI(dB)AUC(dB·s)MTT(s)良性(n=31)11.41±4.2322.83±6.2815.05±7.09607.26±267.5049.85±13.61恶性(n=26)11.26±2.3919.85±5.0519.58±5.00945.83±351.7960.07±16.28t值0.16 1.95 -2.74 -4.12 -2.58P值0.87 0.06 0.01 <0.010.01
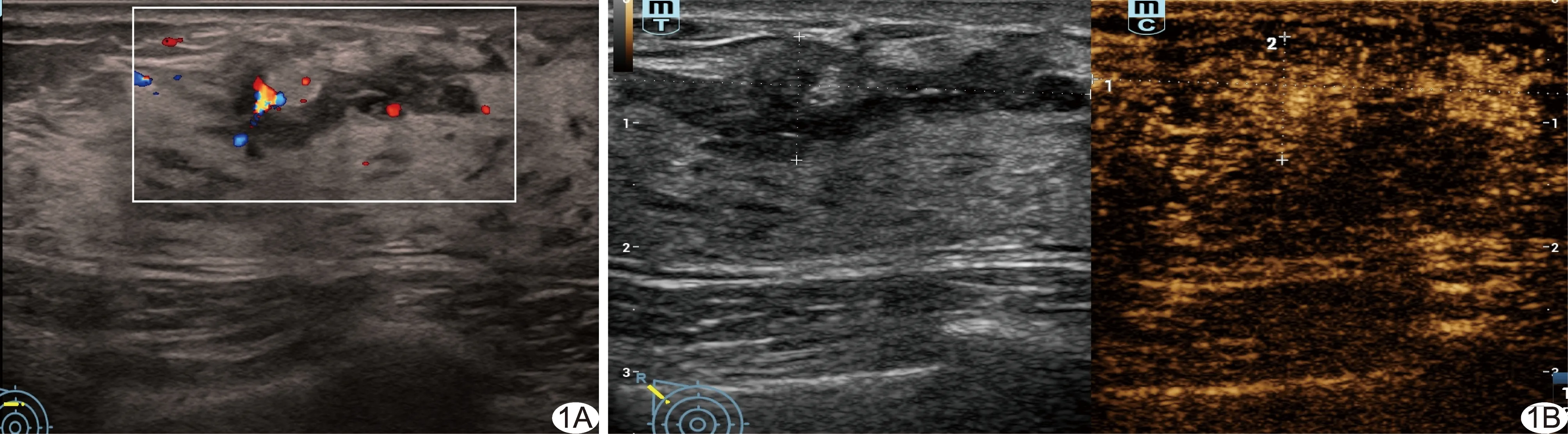
图1 患者女,39岁,右乳NML,病理诊断为腺病 A.常规灰阶超声声像图示病变边界及形态不确定,导管增宽,无微钙化,无后方回声衰减,CDFI示其内血流信号较丰富; B.CEUS定性分析示病变早增强、高增强,CEUS所示范围无扩大,与周边腺体同步消退,造影剂分布不均匀,可见穿入灌注;定量分析示PI=11.44 dB,TTP=17.20 s,AT=10.00 s,AUC=532.53 dB·s,MTT=29.90 s
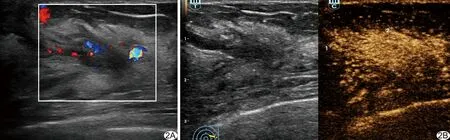
图2 患者女,41岁,左乳NML,病理示浸润性导管癌 A.常规灰阶超声声像图示病变边界及形态不确定,导管增宽,无微钙化,无后方回声衰减,CDFI示内部血流较丰富; B.CEUS定性分析示早增强、高增强,病变范围扩大,周边可见放射状增强;定量分析示PI=13.33 dB,TTP=10.20 s,AT=9.60 s,AUC=633.87 dB·s,MTT=37.20 s

表3 CEUS定性、定量分析及二者联合诊断乳腺良恶性NML的多因素分析结果
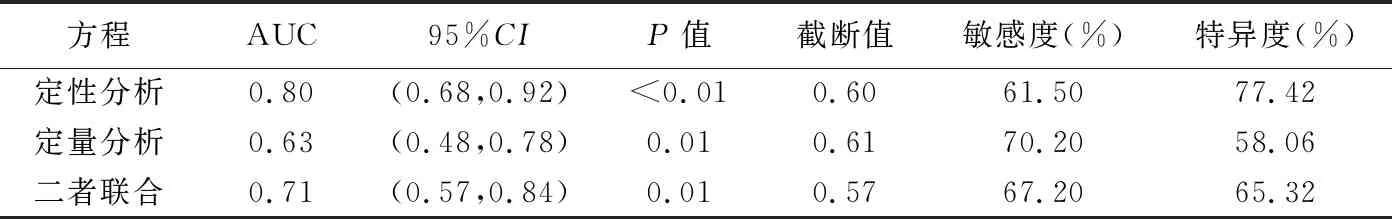
表4 CEUS定性、定量分析及二者联合诊断乳腺良恶性NML的ROC曲线分析结果
2.3 诊断效能 定性、定量及二者联合分析回归方程预测乳腺恶性NML的AUC分别为0.80、0.63及0.71,定性分析优于定量分析(Z=-3.02,P=0.00),而与联合分析间差异无统计学意义(Z=-0.10,P=0.54),见表4及图3。
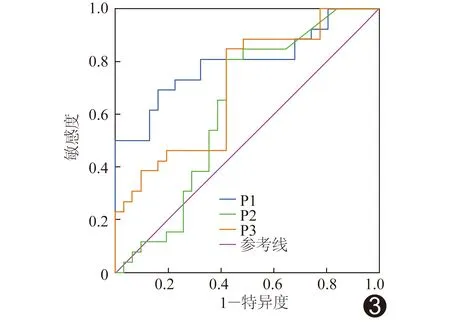
图3 CEUS定性、定量及二者联合分析回归方程诊断乳腺良恶性NML的ROC曲线 P1:定性分析回归方程; P2:定量分析回归方程; P3:二者联合分析回归方程
3 讨论
常规超声诊断乳腺NML特异度低,导致增加不必要的活检。CEUS定性及定量分析可为鉴别乳腺良恶性病变提供依据,但目前关于NML的CEUS研究较少。
本研究结果显示,CEUS定量及定性分析均可用于鉴别诊断乳腺良恶性NML,尤以定性指标中的增强强度和病变范围、定量指标中的PI和AUC鉴别诊断价值较高。恶性NML可分泌大量血管内皮生长因子,在病变内部及周边形成大量微小血管,致其CEUS呈高增强,PI增高[6];同时单位时间内通过病变的血流量增加,AUC增大,造影后病变周边微小血管显影,表现为病变范围扩大。以上结果与ZHANG等[7]的结果基本相符,而与部分定性及定量分析乳腺肿块型病变研究结果[8-9]存在差异,可能原因如下:①NML多与正常腺体实质混合生长,常规超声及CEUS均为无明确边界及固定形态,导致增强边界及增强形态对于鉴别良恶性病变不具参考意义;②NML与正常腺体实质混合生长,测量AT、TTP难以避免受正常腺体实质影响;③研究方法不同也可能导致结果存在差异,如ROI选取、造影剂用量、心率、血管弹性和检查时患者精神状态等均可影响定量指标测值[10-11]。
本研究结果显示,相比CEUS定量分析,定性分析鉴别乳腺良恶性NML的效能更优,与既往研究[3,9,12]基本相符。定性及定量分析均可反映病变的微循环状况,但存在差异,定性指标中的造影前后病变范围变化可为诊断恶性NML提供重要依据。既往研究[13-14]显示灰阶超声常低估乳腺癌病灶大小、尤其是导管内癌,而CEUS所测病变范围更接近术后病理标本实测值,即造影所示病变大小及形态更为真实。大部分NML与正常腺体混杂存在,灰阶超声易识别病变的低回声部分;造影状态下,腺体的基线回声被屏蔽,恶性NML表现为增强后范围扩大,而除炎性病变外,良性NML一般无改变。CEUS定性指标中,周边病理血管形成具有重要辅助诊断价值。恶性NML细胞分泌大量血管内皮生长因子,诱导病变周边大量异常血管生成,CEUS可显示异常穿支及放射状血管,多数学者[15]认为这是恶性病变的特异性征象,可提高诊断乳腺癌的准确率,而现有定量指标无法反映上述病理变化。此外,测定定量指标受多因素影响,目前尚无统一测量标准,亦影响其诊断效能。
综上所述,CEUS定性及定量分析均有助于鉴别诊断乳腺良恶性NML,且定性分析的诊断效能优于定量分析。本研究样本量较小,有待大样本、多中心研究进一步观察CEUS鉴别乳腺良恶性NML的价值。
